Thiếc(II) chloride
Bài viết này cần thêm chú thích nguồn gốc để kiểm chứng thông tin. |
| Thiếc(II) chloride | |||
|---|---|---|---|
| |||
 | |||
 Mẫu thiếc(II) chloride | |||
| Danh pháp IUPAC | Thiếc(II) chloride Thiếc đichloride | ||
| Tên khác | Thiếc protochloride Stanơ chloride Thiếc đichloride Stanum(II) chloride Stanum đichloride | ||
| Nhận dạng | |||
| Số CAS | |||
| PubChem | |||
| ChEBI | |||
| Số RTECS | XP8700000 (khan) XP8850000 (2 nước) | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| InChI | đầy đủ
| ||
| Thuộc tính | |||
| Công thức phân tử | SnCl2 | ||
| Khối lượng mol | 189,6154 g/mol (khan) 225,64596 g/mol (2 nước) | ||
| Bề ngoài | chất rắn màu trắng dạng tinh thể | ||
| Mùi | không mùi | ||
| Khối lượng riêng | 3,95 g/cm³ (khan) 2,71 g/cm³ (2 nước) | ||
| Điểm nóng chảy | 247 °C (520 K; 477 °F) (khan) 37,7 °C (99,9 °F; 310,8 K) (2 nước) | ||
| Điểm sôi | 623 °C (896 K; 1.153 °F) (phân hủy) | ||
| Độ hòa tan trong nước | 83,9 g/100 ml (0 ℃) Thủy phân trong nước nóng, xem thêm bảng độ tan | ||
| Độ hòa tan | tan trong ethanol, aceton, ether, tetrahydrofuran không tan trong xylen tạo phức với amonia, hydrazin, ure, thioure, selenoure | ||
| Cấu trúc | |||
| Cấu trúc tinh thể | Cấu trúc lớp (chuỗi các nhóm SnCl3), α = 90°, β = 91°, γ = 90° (chóp tứ diện) α = 90°, β = 90°, γ = 90° (rutil)[1] | ||
| Hằng số mạng | a = 0,842 nm (chóp tứ diện) 0,74 nm (rutil)[1], b = 0,439 nm (chóp tứ diện) 0,437 nm (rutil)[1], c = 1,194 nm (chóp tứ diện) 0,881 nm (rutil)[1] | ||
| Tọa độ | Chóp tứ diện, Rutil (khan)[1] ngậm hai phân tử nước cũng có dạng ba tọa độ | ||
| Hình dạng phân tử | Bent (pha khí) | ||
| Các nguy hiểm | |||
| MSDS | ICSC 0955 (khan) ICSC 0783 (2 nước) | ||
| Chỉ mục EU | không liệt kê | ||
| Nguy hiểm chính | Kích thích, nguy hiểm đối với sinh vật thủy sinh | ||
| NFPA 704 |
| ||
| Các hợp chất liên quan | |||
| Anion khác | Thiếc(II) fluoride Thiếc(II) bromide Thiếc(II) iodide | ||
| Cation khác | Germani đichloride Thiếc(IV) chloride Chì(II) chloride | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Thiếc(II) chloride là chất rắn dạng tinh thể màu trắng với công thức SnCl2. Hợp chất này bền ở dạng ngậm hai phân tử nước nhưng trong dung dịch nước thì bị thủy phân, đặc biệt trong nước nóng. SnCl2 được dùng nhiều để làm chất khử (trong dung dịch axit) và trong bể điện phân để mạ thiếc. Cần phân biệt thiếc(II) chloride với thiếc(IV) chloride (SnCl4).
Cấu trúc hóa học[sửa | sửa mã nguồn]
SnCl2 có một cặp electron không liên kết, làm cho phân tử ở trạng thái khí bị bẻ cong. Trong trạng thái rắn, SnCl2 kết tinh tạo thành các chuỗi liên kết thông qua các cầu chloride như thể hiện trong hình. Trạng thái ngậm nước đihydrat cũng là phối trí 3 chiều, với 1 phân tử nước liên kết vào nguyên tử thiếc và phân tử nước thứ hai liên kết với phân tử nước thứ nhất. Phần chính của phân tử chồng đống thành các lớp kép trong lưới tinh thể, với phân tử nước "thứ hai" xen vào giữa các lớp.
SnCl2 có cấu trúc giống PbCl2, với hai dạng cấu trúc: chóp tứ diện và rutil. Dạng chóp tứ diện có các hằng số a = 0,842 nm, b = 0,439 nm, c = 1,194 nm, α = 90°, β = 91°, γ = 90°. Dạng rutil có các hằng số a = 0,74 nm, b = 0,437 nm, c = 0,881 nm, α = 90°, β = 90°, γ = 90°.[1]
Tính chất hóa học[sửa | sửa mã nguồn]
Thiếc(II) chloride có thể hòa tan trong lượng nước nhỏ hơn trọng lượng của chính nó mà không có sự phân hủy rõ ràng nào, nhưng dung dịch loãng bị thủy phân tạo thành muối kiềm không tan:
Vì thế nếu các dung dịch tinh khiết chứa thiếc(II) chloride được sử dụng thì nó phải được hòa tan trong axit clohydric (thường là bằng hay lớn hơn lượng mol của thiếc(II) chloride) để duy trì cân bằng về phía trái (sử dụng nguyên lý Le Chatelier). Các dung dịch của SnCl2 cũng không ổn định về phía oxy hóa bởi không khí:
- 6SnCl2 (dd) + O2 (khí) + 2H2O (lỏng) → 2SnCl4 (dd) + 4SnOHCl (rắn)
Điều này có thể ngăn chặn bằng cách lưu giữ dung dịch trên cả mảng thiếc kim loại.[2]
Có nhiều trường hợp cho thấy thiếc(II) chloride đóng vai trò của tác nhân khử, khử các muối bạc và vàng thành kim loại, và các muối sắt(III) thành sắt(II), chẳng hạn như:
Nó cũng có thể khử các ion đồng(II) thành đồng(I).
Dung dịch thiếc(II) chloride cũng có thể đơn giản chỉ phục vụ như nguồn cung cấp ion Sn2+ để tạo ra các hợp chất thiếc(II) khác thông qua các phản ứng tạo kết tủa. Chẳng hạn, phản ứng với natri sulfide tạo ra thiếc(II) sulfide, kết tủa màu nâu đen:
- SnCl2 (dd) + Na2S (dd) → SnS (r) + 2NaCl (dd)
Nếu base kim loại kiềm được thêm vào dung dịch SnCl2 thì ban đầu kết tủa màu trắng là thiếc(II) oxit ngậm nước được tạo ra; chất này sẽ bị hòa tan nếu còn base dư để tạo ra muối stanit, như natri stanit:
- SnCl2(dd) + 2NaOH (dd) → Sn(OH)2 (r) + 2NaCl (dd)
- Sn(OH)2 (rắn) + NaOH (dd) → NaSn(OH)3 (dd)
SnCl2 khan có thể sử dụng để tạo ra một loạt các hợp chất thiếc(II) trong các dung môi không lỏng. Chẳng hạn, muối lithi của 4-metyl-2,6-đi-tert-butylphenol phản ứng với SnCl2 trong THF để tạo ra hợp chất Sn(OAr)2 (Ar = aryl) không gian hai chiều tuyến tính màu vàng.[3]
Thiếc(II) chloride cũng có thể có vai trò như một axit Lewis, tạo ra các phức chất với các phối tử như ion chloride, chẳng hạn:
- SnCl2 (dd) + CsCl (dd) → CsSnCl3 (dd)
Phần lớn các phức chất này có cấu trúc hình chóp, và do các phức chất như SnCl3 có octet đầy đủ, vì thế ít có xu hướng thêm vào trên một phối tử. Tuy nhiên, cặp điện tử cô độc trong các phức chất như vậy lại dễ dàng tạo liên kết, và vì thế bản thân các phức chất có thể phản ứng như một base Lewis hay một phối tử. Điều này có thể thấy trong sản phẩm liên quan tới ferrocen như trong phản ứng sau:
- SnCl2 + Fe(η5-C5H5)(CO)2HgCl → Fe(η5-C5H5)(CO)2SnCl3 + Hg
SnCl2 cũng có thể sử dụng để tạo ra một loạt các hợp chất chứa các liên kết kim loại - kim loại. Chẳng hạn, phản ứng với dicoban octacacbonyl:
- SnCl2 + Co2(CO)8 → (CO)4Co-(SnCl2)-Co(CO)4


Điều chế[sửa | sửa mã nguồn]
SnCl2 khan được điều chế bằng cách cho khí hydro chloride khô tác dụng với thiếc kim loại. Hợp chất đihydrat được điều chế bằng phản ứng tương tự nhưng sử dụng axit clohydric:
- Sn (r) + 2HCl (dd) → SnCl2 (dd) + H2 (k)
Sau đó nước được làm bay hơi cẩn thận từ dung dịch axit để tạo ra các tinh thể SnCl2•2H2O. Đihydrat này cũng có thể khử nước thành dạng muối khan bằng cách sử dụng acetic anhydride ((CH3CO)2O).[5]
Sử dụng[sửa | sửa mã nguồn]
Dung dịch thiếc(II) chloride chứa ít axit clohydric được sử dụng để mạ thiếc cho thép để tạo ra các sản phẩm sắt tây. Một hiệu điện thế giữa hai cực được tạo ra và thiếc kim loại được tạo ra ở catot thông qua quá trình điện phân.
Thiếc(II) chloride cũng được dùng như là một loại thuốc cẩn màu trong lĩnh vực nhuộm màu vải sợi do nó tạo ra các màu sáng hơn cho một số loại thuốc nhuộm như phẩm yên chi. Thuốc cẩn màu này cũng từng được sử dụng đơn lẻ để làm tăng trọng lượng tơ lụa.
Nó cũng được sử dụng làm chất xúc tác trong sản xuất axit polylactic (PLA) dẻo.
Nó cũng được dùng làm chất xúc tác trong phản ứng giữa axeton và hydro peroxide để tạo ra dạng tứ phân của axeton peroxide.
Thiếc(II) chloride cũng được dùng làm tác nhân khử. Điều này được thấy trong việc sử dụng nó để mạ bạc cho gương, trong đó bạc kim loại được kết tủa trên mặt kính:
- Sn2+ (dd) + 2Ag+ → Sn4+ (dd) + 2Ag↓ (r)
Phản ứng khử tương tự theo truyền thống được dùng để phát hiện ion Hg2+(dd). Chẳng hạn, nếu SnCl2 được thêm từng giọt vào dung dịch thủy ngân(II) chloride thì kết tủa màu trắng chứa thủy ngân(I) chloride được tạo ra; và khi thêm tiếp SnCl2 vào thì nó chuyển thành màu đen do thủy ngân kim loại được tạo ra. Thiếc(II) chloride cũng có thể dùng để kiểm tra sự có mặt của các hợp chất vàng. SnCl2 chuyển thành màu tía khi có vàng (xem Tía Cassius).
Khi thủy ngân được phân tích bằng phổ hấp phụ nguyên tử thì người ta phải sử dụng phương pháp hơi lạnh với thiếc (II) chloride thường được dùng làm chất khử.
Trong hóa hữu cơ, SnCl2 chủ yếu được dùng trong phản ứng khử Stephen, trong đó nitril bị khử (thông qua muối imidoyl chloride) thành imin dễ dàng bị thủy phân thành andehit.[6]
Phản ứng này thường làm việc tốt nhất với các nitril Aryl-CN thơm. Phản ứng tương tự (gọi là phương pháp Sonn-Müller) bắt đầu với một amit, được xử lý bằng PCl5 để tạo ra muối imidoyl chloride.

Ngày nay phản ứng khử Stephen ít được sử dụng do nó chủ yếu đã bị thay thế bằng phản ứng khử diisobutyl nhôm hydride.
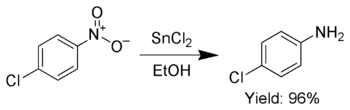
Ngoài ra, SnCl2 cũng được sử dụng để khử có chọn lọc các nhóm nitro thơm thành các anilin.[7]
SnCl2 cũng có thể khử các quinon thành các hydroquinon.
Thiếc(II) chloride cũng được thêm vào một số loại thực phẩm đóng hộp và đóng chai như là một loại phụ gia thực phẩm với số E là E512, trong đó nó có vai trò như là một tác nhân hãm màu và một chất chống oxy hóa.
SnCl2 cũng được dùng trong chụp tâm thất nuclit phóng xạ của y học hạt nhân để khử tác nhân techneti-99m-pertechnetat (Tc-99m) phóng xạ để hỗ trợ trong liên kết các tế bào máu.
Cuối cùng, dung dịch thiếc(II) chloride được nhiều người tinh chế kim loại quý nghiệp dư dùng làm thuốc thử vàng và nhóm kim loại platin (Ru, Rh, Pd, Os, Ir, Pt) trong các dung dịch.[8]
Hợp chất khác[sửa | sửa mã nguồn]
SnCl2 còn tạo một số hợp chất với NH3, như 3SnCl2·2NH3 là tinh thể màu nâu nhạt-đỏ có tính ổn định cao nhất trong số các phức SnCl2–NH3, chỉ bị phân hủy chậm bởi nước[9], SnCl2·NH3 là chất rắn màu vàng[10] hay SnCl2·2NH3 là tinh thể vàng.[9]
SnCl2 còn tạo một số hợp chất với N2H4, như SnCl2·2N2H4 là chất rắn màu nâu nhạt-trắng, không tan trong dung dịch NH3, bị phân hủy bởi nước, khi đun nóng lên sẽ gây nổ.[10]
SnCl2 còn tạo một số hợp chất với CO(NH2)2, như SnCl2·CO(NH2)2 là tinh thể không màu.[11]
SnCl2 còn tạo một số hợp chất với CS(NH2)2, như SnCl2·CS(NH2)2 là tinh thể không màu, các hằng số a = 0,5951 nm, b = 1,3937 nm, c = 0,8883 nm, α = 90°, β = 111,13°, γ = 90°[1]; hay SnCl2·2CS(NH2)2 là tinh thể dạng lăng kính, dễ tan trong nước.[12]
SnCl2 còn tạo một số hợp chất với CSe(NH2)2, như SnCl2·2CSe(NH2)2 là tinh thể màu vàng, tan trong nước, DMF và DMSO tạo thành dung dịch không màu; bị phân hủy trong etanol và axeton, giải phóng seleni nguyên tố.[13]
Tham khảo[sửa | sửa mã nguồn]
- ^ a b c d e f g Handbook… (Pierre Villars, Karin Cenzual, Roman Gladyshevskii; Walter de Gruyter GmbH & Co KG, 24 thg 7, 2017 - 1970 trang). Truy cập 7 tháng 12 năm 2020.
- ^ H. Nechamkin (1968). The Chemistry of the Elements. New York: McGraw-Hill.
- ^ B. Cetinkaya, I. Gumrukcu, M. F. Lappert, J. L. Atwood, R. D. Rogers và M. J. Zaworotko (1980). “Bivalent germanium, tin, and lead 2,6-di-tert-butylphenoxides and the crystal and molecular structures of M(OC6H2Me-4-But2-2,6)2 (M = Ge or Sn)”. J. Am. Chem. Soc. 102 (6): 2088–2089. doi:10.1021/ja00526a054.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ J. M. Leger, J. Haines, A. Atouf (1996). “The high pressure behaviour of the cotunnite and post-cotunnite phases of PbCl2 and SnCl2”. J. Phys. Chem. Solids. 57 (1): 7–16. Bibcode:1996JPCS...57....7L. doi:10.1016/0022-3697(95)00060-7.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ W. L. F. Armarego, C. L. L. Chai (2009). Purification of laboratory chemicals (ấn bản 6). Hoa Kỳ: Butterworth-Heinemann.
- ^ Williams, J. W. (1955). “β-Naphthaldehyde”. Organic Syntheses.; Collective Volume, 3, tr. 626
- ^ F. D. Bellamy và K. Ou (1984). “Selective reduction of aromatic nitro compounds with stannous chloride in non acidic and non aqueous medium”. Tetrahedron Letters. 25 (8): 839–842. doi:10.1016/S0040-4039(01)80041-1.
- ^ “Gold Refining Forum.com • Index page”. Bản gốc lưu trữ ngày 25 tháng 6 năm 2014. Truy cập 10 tháng 2 năm 2015.
- ^ a b A Text-book Of Inorganic Chemistry Vol-x (J.newton Friend; 1928), trang 65. Truy cập 18 tháng 3 năm 2021.
- ^ a b A comprehensive treatise on inorganic and theoretical chemistry, tập 7 (J. W. Mellor; 1922), trang 430. Truy cập 3 tháng 3 năm 2021.
- ^ Schleitzer-Rust, Edith (1977). Komplexverbindungen des Zinns (bằng tiếng Đức). Springer Berlin Heidelberg. tr. 44. ISBN 978-3-540-93345-8.
- ^ Zhurnal obshcheĭ khimii, Tập 8 (Izd-vo "Nauka," Leningradskoe otd-nie, 1876), trang 200. Truy cập 7 tháng 12 năm 2020.
- ^ Izvestii︠a︡ Akademii nauk SSSR.: Serii︠a︡ khimicheskai︠a︡ (Izd-vo AN SSSR, 1971), trang 1556. Truy cập 9 tháng 12 năm 2020.
Đọc thêm[sửa | sửa mã nguồn]
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, ấn bản lần 2, Butterworth-Heinemann, Oxford, Vương quốc Anh, 1997.
- Handbook of Chemistry and Physics, ấn bản lần 71, CRC Press, Ann Arbor, Michigan, Hoa Kỳ, 1990.
- The Merck Index, ấn bản lần 7, Merck & Co, Rahway, New Jersey, Hoa Kỳ, 1960.
- A. F. Wells, 'Structural Inorganic Chemistry, ấn bản lần 5, Nhà in Đại học Oxford, Oxford, Vương quốc Anh, 1984.
- J. March, Advanced Organic Chemistry, ấn bản lần 4, tr. 723, Wiley, New York, Hoa Kỳ, 1992.



