Khác biệt giữa bản sửa đổi của “Acid nitrơ”
←Đổi hướng đến Axít nitrơ Thẻ: Trang đổi hướng mới |
Không có tóm lược sửa đổi Thẻ: Sửa đổi di động Sửa đổi từ trang di động |
||
| Dòng 1: | Dòng 1: | ||
{{Chembox |
|||
| ⚫ | |||
| Verifiedfields = changed |
|||
| Watchedfields = changed |
|||
| verifiedrevid = 462262187 |
|||
| ImageFile = Nitrous acid acsv.svg |
|||
| ImageSize = 200px |
|||
| ⚫ | |||
| PIN = NAxít nitrơ |
|||
| SystematicName = Hydroxidooxidonitrogen |
|||
|Section1={{Chembox Identifiers |
|||
| CASNo = 7782-77-6 |
|||
| CASNo_Ref = {{cascite|correct|CAS}} |
|||
| PubChem = 24529 |
|||
| ChemSpiderID = 22936 |
|||
| ChemSpiderID_Ref = {{chemspidercite|correct|chemspider}} |
|||
| EINECS = 231-963-7 |
|||
| KEGG_Ref = {{keggcite|changed|kegg}} |
|||
| KEGG = C00088 |
|||
| MeSHName = Nitric+acid |
|||
| ChEBI_Ref = {{ebicite|correct|EBI}} |
|||
| ChEBI = 25567 |
|||
| SMILES = O=NO |
|||
| ChEMBL_Ref = {{ebicite|correct|EBI}} |
|||
| ChEMBL = 1161681 |
|||
| StdInChI_Ref = {{stdinchicite|correct|chemspider}} |
|||
| StdInChI = 1S/HNO2/c2-1-3/h(H,2,3) |
|||
| StdInChIKey_Ref = {{stdinchicite|correct|chemspider}} |
|||
| StdInChIKey = IOVCWXUNBOPUCH-UHFFFAOYSA-N |
|||
| Gmelin = 983 |
|||
| 3DMet = B00022}} |
|||
|Section2={{Chembox Properties |
|||
| Formula = HNO<sub>2</sub> |
|||
| Appearance = Dung dịch xanh nước biển nhạt |
|||
| MolarMass = 47.013 g/mol |
|||
| Density = Approx. 1 g/ml |
|||
| Solubility = |
|||
| MeltingPt = Chỉ ở dạng dung dịch |
|||
| pKa = 3.398 |
|||
}} |
|||
|Section7={{Chembox Hazards |
|||
| ExternalSDS = |
|||
| EUIndex = Không liệt kê |
|||
| EUClass = |
|||
| RPhrases = |
|||
| SPhrases = |
|||
| MainHazards = |
|||
| NFPA-H = |
|||
| NFPA-F = |
|||
| NFPA-R = |
|||
| NFPA-S = |
|||
| FlashPt = Không cháy |
|||
}} |
|||
|Section8={{Chembox Related |
|||
| OtherAnions = [[Axít nitric]] |
|||
| OtherCations = [[Natri nitrit]]<br/>[[kali nitrit]]<br/>[[amoni nitrit]] |
|||
| OtherCompounds = [[Đinitơ triôxit]] |
|||
}} |
|||
}} |
|||
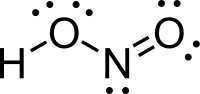
'''Axit nitrơ''' ([[công thức phân tử]] là [[Hiđrô|H]][[nitơ|N]][[ôxy|O<sub>2</sub>]]) là một axit yếu và mônôbazơ chỉ được biết đến trong dung dịch và ở dạng muối nitrit. |
|||
Axit nitơ được sử dụng để làm điazít từ amin; điều này xảy ra bởi sự tấn công nucleophin của amin vào nitrite, proton bằng dung môi xung quanh, và loại bỏ hai [[nước]]. Các diazide sau đó có thể được giải phóng để cho một cacben hoặc carbenoid. |
|||
==Cấu trúc== |
|||
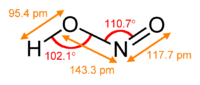
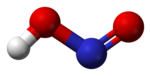
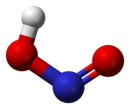
Trong [[pha (vật chất)|pha]] khí, các phân tử axit nitơ phẳng có thể tồn tại cả trong dạng cis và dạng trans. Các dạng trans trội hơn ở nhiệt độ phòng, và các phép đo IR cho thấy dạng này ổn định hơn khoảng 2,3 kJ mol-1.<ref>{{Greenwood&Earnshaw}} p. 462</ref> |
|||
{|align="center" class="wikitable" |
|||
|<center>[[Hình:Trans-nitrous-acid-2D-dimensions.png|200px]]</center>||<center>[[Hình:Trans-nitrous-acid-3D-balls.png|150px]]</center>||<center>[[Hình:Cis-nitrous-acid-3D-balls.png|130px]]</center> |
|||
|- |
|||
|<center>các kích cỡ của dạng ''trans''<br>(từ [[rotational spectroscopy|quang phổ vi sóng]])</center>||<center>[[mẫu bi và que|mẫu]] của dạng ''trans''</center>||<center>dạng ''cis''</center> |
|||
|} |
|||
==Điều chế== |
|||
Khi dung lịch loãng và lạnh của [[ion]] nitrit, NO2- được axit hóa cẩn thận, dung dịch màu xanh biển nhạt của axit nitrơ được tạo ra. Axit nitrơ tự do không ổn định và phân hủy nhanh chóng. |
|||
Chất này có thể được điều chế bằng cách hòa tan [[Đinitơ triôxit|triôxít đinitơ]] trong nước ở 0 °C. |
|||
==Chú thích== |
|||
{{tham khảo}} |
|||
{{sơ khai hóa học}} |
|||
[[Thể loại:Hợp chất nitơ]] |
|||
Phiên bản lúc 11:32, ngày 19 tháng 6 năm 2020
| Acid nitrơ | |
|---|---|
 Axít nitrơ | |
| Tên hệ thống | Hydroxidooxidonitrogen |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số EINECS | |
| KEGG | |
| MeSH | |
| ChEBI | |
| ChEMBL | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| Tham chiếu Gmelin | 983 |
| 3DMet | |
| Thuộc tính | |
| Công thức phân tử | HNO2 |
| Khối lượng mol | 47.013 g/mol |
| Bề ngoài | Dung dịch xanh nước biển nhạt |
| Khối lượng riêng | Approx. 1 g/ml |
| Điểm nóng chảy | Chỉ ở dạng dung dịch |
| Điểm sôi | |
| Độ axit (pKa) | 3.398 |
| Các nguy hiểm | |
| Chỉ mục EU | Không liệt kê |
| Điểm bắt lửa | Không cháy |
| Các hợp chất liên quan | |
| Anion khác | Axít nitric |
| Cation khác | Natri nitrit kali nitrit amoni nitrit |
| Hợp chất liên quan | Đinitơ triôxit |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Axit nitrơ (công thức phân tử là HNO2) là một axit yếu và mônôbazơ chỉ được biết đến trong dung dịch và ở dạng muối nitrit. Axit nitơ được sử dụng để làm điazít từ amin; điều này xảy ra bởi sự tấn công nucleophin của amin vào nitrite, proton bằng dung môi xung quanh, và loại bỏ hai nước. Các diazide sau đó có thể được giải phóng để cho một cacben hoặc carbenoid.
Cấu trúc
Trong pha khí, các phân tử axit nitơ phẳng có thể tồn tại cả trong dạng cis và dạng trans. Các dạng trans trội hơn ở nhiệt độ phòng, và các phép đo IR cho thấy dạng này ổn định hơn khoảng 2,3 kJ mol-1.[1]
 |
 |
 |
(từ quang phổ vi sóng) |
Điều chế
Khi dung lịch loãng và lạnh của ion nitrit, NO2- được axit hóa cẩn thận, dung dịch màu xanh biển nhạt của axit nitrơ được tạo ra. Axit nitrơ tự do không ổn định và phân hủy nhanh chóng.
Chất này có thể được điều chế bằng cách hòa tan triôxít đinitơ trong nước ở 0 °C.
Chú thích
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (ấn bản 2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4 p. 462
