Acid nitrơ
| Acid nitrơ | |
|---|---|
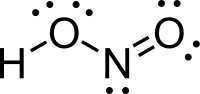 Cấu trúc của acid nitrơ | |
| Tên hệ thống | Hydroxidooxidonitrogen |
| Tên khác | Acid nitric(III) |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số EINECS | |
| KEGG | |
| MeSH | |
| ChEBI | |
| ChEMBL | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| ChemSpider | |
| Tham chiếu Gmelin | 983 |
| 3DMet | |
| Thuộc tính | |
| Công thức phân tử | HNO2 |
| Khối lượng mol | 47,01274 g/mol |
| Bề ngoài | dung dịch màu xanh lam nhạt |
| Khối lượng riêng | xấp xỉ 1 g/cm³ |
| Điểm nóng chảy | Chỉ ở dạng dung dịch |
| Điểm sôi | |
| Độ hòa tan trong nước | không rõ (chỉ tồn tại dưới dạng dung dịch) |
| Độ axit (pKa) | 3,398 |
| Các nguy hiểm | |
| Chỉ mục EU | Không liệt kê |
| Nguy hiểm chính | độc |
| Điểm bắt lửa | Không cháy |
| Các hợp chất liên quan | |
| Anion khác | Acid nitric |
| Cation khác | Natri nitrit Kali nitrit Amoni nitrit |
| Hợp chất liên quan | Dinitơ trioxide |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Acid nitrơ (công thức hóa học HNO
2) là một acid vô cơ yếu, chủ yếu tồn tại ở dạng dung dịch, khí và muối nitrat.[1] Acid nitrơ tự do không ổn định và phân hủy nhanh chóng.[2]
Xem thêm[sửa | sửa mã nguồn]
Tham khảo[sửa | sửa mã nguồn]
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Hóa học của các nguyên tố (xuất bản lần thứ 2). Butterworth-Heinemann. ISBN 978-0-08-037941-8.P. 462.
- ^ Kameoka (tháng 2 năm 1977). “Hấp thụ Nitrogen Dioxide trong nước, Acid sulfuric, Natri Hydroxide và dung dịch nước Natri Sulfite kiềm”. Ind. Eng. Chem. Fundamen. 16: 163–169.
