Acid glyoxylic
| Acid glyoxylic | |
|---|---|
 | |
 | |
| Tên hệ thống | Acid oxoethanoic |
| Tên khác | Acid glyoxylic [1] 2-Acid oxoacetic Acid formylformic |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| DrugBank | DB04343 |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| UNII | |
| Thuộc tính | |
| Khối lượng riêng | 1.384 g/mL |
| Điểm nóng chảy | 80 °C (353 K; 176 °F)[2] |
| Điểm sôi | 111 °C (384 K; 232 °F) |
| Độ axit (pKa) | 3.18,[3] 3.32 [4] |
| Các hợp chất liên quan | |
| Anion khác | glyoxylat |
| Nhóm chức liên quan | acid formic acid acetic acid glycolic acid oxalic acid propionic acid pyruvic |
| Hợp chất liên quan | acetaldehyde glyoxan glycol aldehyde |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Acid glyoxylic[1] hoặc acid oxoacetic là hợp chất hữu cơ. Cùng với acid acetic, acid glycolic, và acid oxalic, acid glyoxylic là một trong những C2 carboxylic. Nó là một chất rắn không màu xuất hiện trong tự nhiên và hữu ích trong công nghiệp.
Cấu trúc và danh pháp[sửa | sửa mã nguồn]
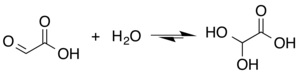
Mặc dù cấu trúc của acid glyoxylic được mô tả là có nhóm chức aldehyde, nhưng aldehyde chỉ là một thành phần phụ của dạng phổ biến nhất trong một số trường hợp. Thay vào đó, nó thường tồn tại dưới dạng hiđrat hoặc chất làm mờ tuần hoàn. Ví dụ, khi có nước, carbonyl nhanh chóng chuyển đổi thành một diol đá quý (được mô tả là "monohydrat"). Hằng số cân bằng (K) là 300 đối với acid dihydroxyacetic hình thành ở nhiệt độ phòng:[5]
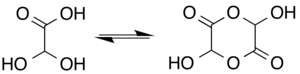
Trong dung dịch, monohydrat tồn tại ở trạng thái cân bằng với dạng dimer hemiacetal:[6]
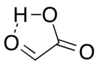
Một cách cô lập, cấu trúc aldehyde có cấu trúc chính là cấu trúc liên kết hydro vòng với aldehyde carbonyl gần với hydro carboxyl:[7]
Hằng số định luật Henry của acid glyoxylic là KH= 1,09 × 104 × exp [(40,0 × 103 / R) × (1 / T - 1/298)].[8]
Điều chế[sửa | sửa mã nguồn]
Cơ sở liên hợp của acid glyoxylic được gọi là glyoxylat và là dạng hợp chất tồn tại trong dung dịch ở pH trung tính. Glyoxylat là sản phẩm phụ của quá trình amid hóa trong quá trình sinh tổng hợp một số Peptide amid hóa.
Đối với hồ sơ lịch sử, acid glyoxylic được điều chế từ acid oxalic bằng phương pháp điện tổng hợp:[9][10] trong tổng hợp hữu cơ, cực âm chì dioxide được sử dụng để điều chế acid glyoxylic từ acid oxalic trong chất điện phân acid sulfuric.[11]
Acid nitric nóng có thể oxy hóa glyoxan thành glyoxilic; tuy nhiên phản ứng này tỏa nhiệt cao và dễ xảy ra hiện tượng thoát nhiệt. Ngoài ra, acid oxalic là sản phẩm phụ chính.
Ngoài ra, quá trình ozo hóa acid maleic cũng có hiệu quả.
Vai trò sinh học[sửa | sửa mã nguồn]
Glyoxylat là chất trung gian của chu trình glyoxylat, cho phép các sinh vật, chẳng hạn như vi khuẩn,[12] nấm và thực vật [13] chuyển đổi acid béo thành carbohydrate. Chu trình glyoxilat cũng rất quan trọng đối với việc cảm ứng các cơ chế bảo vệ thực vật để phản ứng lại nấm.[14] Chu trình glyoxilat được bắt đầu thông qua hoạt động của isoxitrat lyase, chuyển isocitrat thành glyoxilat và sucxinat. Nghiên cứu đang được thực hiện để đồng chọn con đường cho nhiều mục đích sử dụng khác nhau như sinh tổng hợp sucxinat.[15]
Ở người[sửa | sửa mã nguồn]
Glyoxilat được tạo ra thông qua hai con đường: thông qua quá trình oxy hóa glycolat trong peroxisom hoặc thông qua quá trình dị hóa hydroxiprolin trong ti thể.[16] Trong nhóm peroxisom, glyoxilat được chuyển đổi thành glycin bởi AGT1 hoặc thành oxalat bởi glycolat oxitdase. Trong ti thể, glyoxylat được chuyển đổi thành glycin bởi AGT2 hoặc thành glycolat nhờ glycolat reductase. Một lượng nhỏ glyoxylat được chuyển hóa thành oxalat bởi lactat dehydrogenase trong tế bào chất.[17]
Trong thực vật[sửa | sửa mã nguồn]
Ngoài vai trò là chất trung gian trong con đường glyoxylat, glyoxylat còn là chất trung gian quan trọng trong con đường quang hợp. Quang hợp là kết quả của phản ứng phụ của RuBisCO với O2 thay vì CO2. Mặc dù lúc đầu được coi là một sự lãng phí năng lượng và tài nguyên, quang hợp đã được chứng minh là một phương pháp quan trọng để tái tạo carbon và CO2, loại bỏ phosphoglycolat độc hại và khởi động cơ chế bảo vệ. [18][19] Trong phản ứng quang hợp, glyoxilat được chuyển đổi từ glycolat thông qua hoạt động của glycolat oxitdase trong peroxisom. Sau đó nó được chuyển đổi thành glycin thông qua các hoạt động song song của SGAT và GGAT, sau đó được vận chuyển vào ti thể.[16][20] Nó cũng đã được báo cáo rằng phức hợp pyruvat dehydrogenase có thể đóng một vai trò trong chuyển hóa glycolat và glyoxilat.[21]

Bệnh tật liên quan[sửa | sửa mã nguồn]
Bệnh tiểu đường[sửa | sửa mã nguồn]
Glyoxilat được cho là dấu hiệu ban đầu tiềm năng cho bệnh tiểu đường loại II.[17] Một trong những điều kiện quan trọng của bệnh lý tiểu đường là sản xuất các sản phẩm cuối cùng của glycation tiên tiến (AGEs) do tăng đường huyết.[22] AGEs can lead to further complications of diabetes, such as tissue damage and cardiovascular disease.[23] AGEs có thể dẫn đến các biến chứng khác của bệnh tiểu đường, chẳng hạn như tổn thương mô và bệnh tim mạch. Chúng thường được hình thành từ các aldehyde phản ứng, chẳng hạn như những chất có trên đường khử và alpha-oxoaldehyde. Trong một nghiên cứu, nồng độ glyoxylat được phát hiện tăng đáng kể ở những bệnh nhân sau đó được chẩn đoán mắc bệnh tiểu đường loại II.[17] Mức độ tăng cao được tìm thấy đôi khi lên đến ba năm trước khi chẩn đoán, chứng tỏ vai trò tiềm năng của glyoxylat là một dấu hiệu dự đoán sớm.
Bệnh sỏi thận[sửa | sửa mã nguồn]
Glyoxilat có liên quan đến sự phát triển của tăng oxy niệu, một nguyên nhân chính gây sỏi thận (thường được gọi là sỏi thận). Glyoxylat vừa là chất nền vừa là chất dẫn của chất vận chuyển anion sulfat-1(sat-1), một gen chịu trách nhiệm vận chuyển oxalat, cho phép nó tăng biểu hiện mRNA sat-1 và kết quả là dòng oxalat ra khỏi tế bào. Việc tăng giải phóng oxalat cho phép tích tụ calci oxalat trong nước tiểu, và do đó cuối cùng hình thành sỏi thận.[17]
Sự gián đoạn chuyển hóa glyoxylat cung cấp thêm một cơ chế phát triển tăng oxy hóa niệu. Đột biến mất chức năng trong gen HOGA1 dẫn đến mất 4-hydroxi-2-oxoglutarat andolase, một loại enzyme trong con đường hydroxiprolin thành glyoxylat. Glyoxylat tạo ra từ con đường này thường được lưu trữ để ngăn chặn quá trình oxy hóa thành oxalate trong dịch bào. Tuy nhiên, con đường bị gián đoạn gây ra sự tích tụ 4-hydroxi-2-oxoglutarat cũng có thể được vận chuyển đến bào tương và chuyển đổi thành glyoxylat thông qua một andolase khác. Các phân tử glyoxylat này có thể bị oxy hóa thành oxalat làm tăng nồng độ của nó và gây ra chứng tăng oxy niệu.[16]
Phản ứng và sử dụng[sửa | sửa mã nguồn]
Acid glyoxylic là một acid mạnh hơn acid acetic khoảng mười lần, với hằng số phân ly acid là 4,7 × 10−4 (pKa = 3,32): OCHCO2H ⇌ OCHCO2- + H+
Với base, acid glyoxylic mất cân đối, tạo thành acid hydroxiacetic và acid oxalic: [cần dẫn nguồn]
2 OCHCO2H + H2O → HOCH2CO2H + HO2CCO2H
Acid glyoxylic tạo ra dị vòng khi ngưng tụ với ure và 1,2-diaminobenzen. |-
Các dẫn xuất phenol[sửa | sửa mã nguồn]
Nói chung, acid glyoxylic trải qua phản ứng thay thế nhân thơm bằng nhóm phenol, một bước linh hoạt trong quá trình tổng hợp một số hợp chất khác.
Sản phẩm ngay lập tức với phenol là acid 4-hydroxymandelic mà phản ứng với NH3 để tạo hydroxyphenylglycin, một tiền chất của thuốc amoxicillin. Sự khử acid 4-hydroxymandelic tạo acid 4-hydroxyphenylacetic là tiền thân của thuốc atenolol.
Trình tự các phản ứng, trong đó acid glyoxylic phản ứng với guaiacol, thành phần phenol, sau đó là quá trình oxy hóa và khử carboxyl, cung cấp một con đường đến vanillin như một quá trình tạo formyl hóa thực.[9][24][25]
Phản ứng Hopkins Cole[sửa | sửa mã nguồn]
Acid glyoxylic là một thành phần của phản ứng Hopkins – Cole, được sử dụng để kiểm tra sự hiện diện của tryptophan trong protein. [27] |-
Hóa học môi trường[sửa | sửa mã nguồn]
Acid glyoxylic là một trong số các acid carboxylic chứa xeton và aldehyde cùng có nhiều trong aerosol hữu cơ thứ cấp. Trong điều kiện có nước và ánh sáng mặt trời, acid glyoxylic có thể trải qua quá trình oxy hóa quang hóa. Một số con đường phản ứng khác nhau có thể xảy ra sau đó, dẫn đến nhiều sản phẩm acid carboxylic và aldehyde khác.[26]
An toàn[sửa | sửa mã nguồn]
Hợp chất này không độc lắm với LD50 đối với chuột là 2500 mg/kg.
Tham khảo[sửa | sửa mã nguồn]
- ^ a b “Vật chất phía trước”. Danh pháp Hóa học hữu cơ: Các khuyến nghị và tên gọi ưu tiên của IUPAC 2013 (Blue Book). Cambridge: Hiệp hội Hóa học Hoàng gia. 2014. tr. 748. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Chỉ số Merck, 11th Phiên bản, 4394
- ^ “Dissociation Constants Of Organic Acids And Bases”.
- ^ pKa Data Compiled by R. Williams, “Archived copy” (PDF). Bản gốc (PDF) lưu trữ ngày 2 tháng 6 năm 2010. Truy cập ngày 2 tháng 6 năm 2010.Quản lý CS1: bản lưu trữ là tiêu đề (liên kết).
- ^ Sørensen, P. E.; Bruhn, K.; Lindeløv, F. (1974). "Động học và cân bằng cho quá trình hydrat hóa thuận nghịch của nhóm aldehyde trong acid glyoxylic". Acta Chem. Scand. 28: 162–168. doi: 10.3891 / acta.chem.scand.28a-0162.
- ^ Georges Mattioda và Yani Christidis "Glyoxylic Acid" Bách khoa toàn thư về Hóa học Công nghiệp của Ullmann, 2002, Wiley-VCH, Weinheim. doi: 10.1002 / 14356007.a12_495
- ^ Redington, Richard L.; Liang, Chin-Kang Jim (1984). "Phổ dao động của monome acid glyoxylic". Tạp chí Quang phổ phân tử. 104 (1): 25–39. Mã Bib: 1984JMoSp.104... 25R. doi: 10.1016 / 0022-2852 (84) 90242-X.
- ^ [8] Ip, H. S. Simon; Huang, X. H. Hilda; Yu, Jian Zhen (2009). "Hằng số định luật Henry hiệu quả của glyoxal, acid glyoxylic và acid glycolic" (PDF). Thư Nghiên cứu Địa vật lý. 36 (1): L01802. Mã bib: 2009GeoRL..36.1802I. doi: 10.1029 / 2008GL036212.
- ^ a b Tafel, Julius; Friedrichs, Gustav (1904). "Sự điện li của acid carboxylic và este của acid carboxylic trong dung dịch acid sulfuric". Báo cáo của Hiệp hội Hóa học Đức. 37 (3): 3187-3191. doi: 10.1002 / cber.190403703116
- ^ Cohen, Julius (1920). Thực hành Hóa học Hữu cơ lần 2 Ed (PDF). Luân Đôn: Macmillan and Co. Limited. trang 102–104.
- ^ François Cardarelli (2008). Sổ tay Vật liệu: Một tài liệu tham khảo ngắn gọn về máy tính để bàn. Springer. p. 574. ISBN 978-1-84628-668-1.
- ^ Holms WH (1987). "Kiểm soát thông lượng thông qua chu trình acid xitric và bỏ qua glyoxylate trong Escherichia coli". Biochem Soc Symp. 54: 17–31. PMID 3332993.
- ^ Escher CL, Widmer F (1997). "Huy động lipid và tạo gluconeogenesis trong thực vật: các hoạt động của enzyme chu trình glyoxylate có tạo thành một chu trình thực sự không? Một giả thuyết". Biol. Chem. 378 (8): 803–813. PMID 9377475.
- ^ Dubey, Mukesh K.; Broberg, Anders; Sooriyaarachchi, Sanjeewani; Ubhayasekera, Hệ thập phân; Jensen, Dan Funck; Karlsson, Magnus (tháng 9 năm 2013). "Chu trình glyoxylate liên quan đến các kiểu hình đa hướng, đối kháng và cảm ứng các phản ứng bảo vệ thực vật trong tác nhân kiểm soát sinh học nấm Trichoderma atroviride". Di truyền nấm và Sinh học. 58–59: 33–41. doi: 10.1016 / j.fgb.2013.06.008. ISSN 1087-1845. PMID 23850601.
- ^ Zhu, Li-Wen; Li, Xiao-Hong; Zhang, Lei; Li, Hong-Mei; Liu, Jian-Hua; Yuan, Zhan-Peng; Chen, Tao; Tang, Ya-Jie (tháng 11 năm 2013). "Kích hoạt của con đường glyoxylate mà không có sự kích hoạt gen liên quan của nó trong Escherichia coli được thiết kế tạo ra succinate ". Metabolic Engineering. 20: 9–19. doi: 10.1016 / j.ymben.2013.07.004. ISSN 1096-7176. PMID 23876414.
- ^ a b c Belostotsky, Ruth; Pitt, James Jonathon; Frishberg, Yaacov (2012-12-01). "Tăng oxy niệu nguyên phát loại III — một mô hình để nghiên cứu những xáo trộn trong chuyển hóa glyoxylate". Tạp chí Y học phân tử. 90 (12): 1497–1504. doi: 10.1007 / s00109-012-0930-z. hdl: 11343/220107. ISSN 0946-2716. PMID 22729392. S2CID 11549218.
- ^ a b c d Schnedler, Nina; Burckhardt, Gerhard; Burckhardt, Birgitta C. (tháng 3 năm 2011). "Glyoxylate là chất nền của chất trao đổi sulfat-oxalat, sat-1, và làm tăng biểu hiện của nó trong tế bào HepG2". Tạp chí Gan mật. 54 (3): 513–520. doi: 10.1016 / j.jhep.2010.07.036. ISSN 0168-8278. PMID 21093948. Lỗi chú thích: Thẻ
<ref>không hợp lệ: tên “:3” được định rõ nhiều lần, mỗi lần có nội dung khác - ^ "photorespiration". Truy cập ngày 3 tháng 9 năm 2017.
- ^ Peterhansel, Christoph; Horst, Ina; Niessen, Markus; Blume, Christian; Kebeish, Rashad; Kürkcüoglu, Sophia; Kreuzaler, Fritz (2010-03-23). "Photorespiration". Sách Arabidopsis / Hiệp hội các nhà sinh học thực vật Hoa Kỳ. 8: e0130. doi: 10.1199 / tab.0130. ISSN 1543-8120. PMC 3244903. PMID 22303256.
- ^ Zhang, Zhisheng; Mao, Xingxue; Ou, Juanying; Ye, Nenghui; Zhang, Jianhua; Peng, Xinxiang (tháng 1 năm 2015). “Distinct photorespiratory reactions are preferentially catalyzed by glutamate:glyoxylate and serine:glyoxylate aminotransferases in rice”. Journal of Photochemistry and Photobiology B: Biology. 142: 110–117. doi:10.1016/j.jphotobiol.2014.11.009. ISSN 1011-1344. PMID 25528301.
- ^ Blume, Christian; Behrens, Christof; Eubel, Holger; Braun, Hans-Peter; Peterhansel, Christoph (tháng 11 năm 2013). “A possible role for the chloroplast pyruvate dehydrogenase complex in plant glycolate and glyoxylate metabolism”. Phytochemistry. 95: 168–176. doi:10.1016/j.phytochem.2013.07.009. ISSN 0031-9422. PMID 23916564.
- ^ Nguyen, Dung V.; Shaw, Lynn C.; Grant, Maria B. (21 tháng 12 năm 2012). “Inflammation in the pathogenesis of microvascular complications in diabetes”. Frontiers in Endocrinology. 3: 170. doi:10.3389/fendo.2012.00170. ISSN 1664-2392. PMC 3527746. PMID 23267348.
- ^ Piarulli, Francesco; Sartore, Giovanni; Lapolla, Annunziata (tháng 4 năm 2013). “Glyco-oxidation and cardiovascular complications in type 2 diabetes: a clinical update”. Acta Diabetologica. 50 (2): 101–110. doi:10.1007/s00592-012-0412-3. ISSN 0940-5429. PMC 3634985. PMID 22763581.
- ^ Fatiadi, Alexander; Schaffer, Robert (1974). “An Improved Procedure for Synthesis of DL-4-Hydroxy-3-methoxymandelic Acid (DL-"Vanillyl"-mandelic Acid, VMA)”. Journal of Research of the National Bureau of Standards Section A. 78A (3): 411–412. doi:10.6028/jres.078A.024. PMID 32189791.
- ^ Kamlet, Jonas; Mathieson, Olin (1953). Manufacture of vanillin and its homologues U.S. Patent 2,640,083 (PDF). U.S. Patent Office.
- ^ R.A. Joshi (2006). Question Bank of Biochemistry. New Age International. tr. 64. ISBN 978-81-224-1736-4.