Bạc perchlorat
| Bạc perchlorat | |
|---|---|
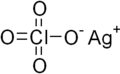 Cấu trúc của bạc perchlorat | |
| Danh pháp IUPAC | Silver perchlorate |
| Tên khác | Perchloric acid, silver(1+) salt |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số EINECS | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| ChemSpider | |
| Thuộc tính | |
| Công thức phân tử | AgClO4 |
| Khối lượng mol | 207,3183 g/mol (khan) 225,33358 g/mol (1 nước) |
| Bề ngoài | tinh thể không màu, hút ẩm |
| Khối lượng riêng | 2,806 g/cm³ |
| Điểm nóng chảy | 486 °C (759 K; 907 °F) (phân hủy) |
| Điểm sôi | |
| Độ hòa tan trong nước | 557 g/100 mL (25 ℃) 792,8 g/100 mL (99 ℃), xem thêm bảng độ tan |
| Độ hòa tan | tan trong amonia, các dung môi hữu cơ (tạo phức) |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Bạc perchlorat là một hợp chất vô cơ có thành phần chính gồm ba nguyên tố: bạc, chlor và oxy, với công thức hóa học được quy định là AgClO4. Hợp chất này tồn tại dưới dạng một rắn màu trắng này tạo thành một monohydrat khá nhẹ. Hợp chất này là nguồn hữu ích của ion Ag+, mặc dù sự xuất hiện của perchlorat gây nguy hiểm. Hợp chất này cũng được sử dụng làm chất xúc tác trong hóa học hữu cơ.
Sản xuất[sửa | sửa mã nguồn]
Bạc perchlorat được tạo ra bằng cách nung một hỗn hợp của acid perchloric với bạc nitrat. Ngoài ra, nó có thể được điều chế bởi phản ứng giữa bari perchlorat và bạc sunfat, hoặc từ phản ứng của acid perchloric với bạc oxide.
Độ hòa tan[sửa | sửa mã nguồn]
Độ hòa tan của bạc perchlorat khác biệt trong các dung môi khác nhau, như trong các dung môi thơm như benzen (52,8 g/L) và toluen (1010 g/L).[1] Trong các dung môi này, cation bạc liên kết với aren, như đã được chứng minh bằng các nghiên cứu tinh thể học rộng lớn trên tinh thể thu được từ các dung dịch tương tự.[2][3] Bạc perchlorat cũng hòa tan đáng kinh ngạc trong nước, lên tới 500 g/100 mL nước.
Hợp chất khác[sửa | sửa mã nguồn]
AgClO4 còn tạo một số hợp chất với NH3, như AgClO4·2NH3 là tinh thể hình thoi không màu.[4]
Tham khảo[sửa | sửa mã nguồn]
- ^ F. Březina; J. Mollin; R. Pastorek; Z. Šindelář (1986). Chemické tabulky anorganických sloučenin [Chemical tables of inorganic compounds] (bằng tiếng Séc). Prague: SNTL.
- ^ E. A. Hall Griffith; E. L. Amma (1974). “Metal Ion-Aromatic Complexes. XVIII. Preparation and Molecular Structure of Naphthalene-Tetrakis(silver perchlorate) Tetrahydrate”. Journal of the American Chemical Society. 96 (3): 743–749. doi:10.1021/ja00810a018.
- ^ R. K. McMullan; T. F. Koetzle; C. J. Fritchie Jr. (1997). “Low-Temperature Neutron Diffraction Study of the Silver Perchlorate–Benzene π Complex”. Acta Crystallographica B. 53 (4): 645–653. doi:10.1107/S0108768197000712.
- ^ Peter Nockemann, Gerd Meyer – [Ag(NH3)2]ClO4: Kristallstrukturen, Phasenumwandlung, Schwingungsspektren. ZAAC 628 (7): 1636–1640. doi:10.1002/1521-3749(200207)628:7%3C1636::AID-ZAAC1636%3E3.0.CO;2-M.
