Carbon tetraiodide
| Carbon tetraiodide | |||
|---|---|---|---|
| |||
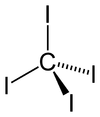 Cấu trúc 2D của carbon tetraiodide | |||
| Danh pháp IUPAC | Tetraiodomethane[1] | ||
| Nhận dạng | |||
| Số CAS | |||
| PubChem | |||
| Số EINECS | |||
| Số RTECS | FG4960000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| Tham chiếu Beilstein | 1733108 | ||
| Thuộc tính | |||
| Công thức phân tử | CI4 | ||
| Khối lượng mol | 519,627 g/mol | ||
| Bề ngoài | Tinh thể tím đen | ||
| Khối lượng riêng | 4,32 g/cm³ | ||
| Điểm nóng chảy | |||
| Điểm sôi | |||
| MagSus | -136·10-6 cm³/mol | ||
| Cấu trúc | |||
| Cấu trúc tinh thể | có bốn gốc | ||
| Hình dạng phân tử | Tứ diện | ||
| Mômen lưỡng cực | 0 D | ||
| Nhiệt hóa học | |||
| Enthalpy hình thành ΔfH | 384,0–400,4 kJ mol-1 | ||
| DeltaHc | -794,4–−778,4 kJ mol-1 | ||
| Nhiệt dung | 0,5 J K-1 g-1 | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Carbon tetraiodide là một tetrahalomethan với công thức hóa học CI4. Nó có màu đỏ tươi, là một ví dụ tương đối hiếm của một dẫn xuất methan có màu sắc đậm. Nó chỉ có 2,31% tính theo trọng lượng carbon, mặc dù các dẫn xuất methan khác được biết đến với lượng carbon thấp hơn.
Cấu trúc[sửa | sửa mã nguồn]
Phân tử tứ diện có khoảng cách liên kết C–I là 2,12 ± 0,02 Å[2]. Các phân tử được hơi dày đặc với các liên lạc ngắn giữa các nguyên tử iod là 3,459 ± 0,03 Å và có thể vì lý do này, nó có nhiệt và quang hóa không ổn định.
Carbon tetraiodide kết tinh trong cấu trúc tinh thể tứ diện (a = 6,409, c = 9,558 (×10−1 nm))[3].
Tính chất, điều chế, sử dụng[sửa | sửa mã nguồn]
Carbon tetraiodide hơi phản ứng với nước, tạo ra iodoform và I2. Nó hòa tan trong dung môi hữu cơ không phân cực. Nó phân hủy bởi nhiệt và ánh sáng thành tetraiodoethylen, C2I4. Sự tổng hợp của nó đòi hỏi việc trao đổi halogen của AlCl3, được tiến hành ở nhiệt độ phòng:[4]
CCl4 + 4EtI → CI4 + 4EtCl
Sản phẩm kết tinh từ dung dịch phản ứng.
Carbon tetraiodide được sử dụng làm chất phản ứng iod, thường khi phản ứng với các base.[5] Xeton được chuyển đổi thành 1,1-diiodoalken khi xử lý bằng triphenylphosphin (PPh3) và carbon tetraiodide. Alcohol được chuyển đổi thành iodide, bằng một cơ chế tương tự như phản ứng của Appel. Trong một phản ứng Appel, carbon tetrachloride được sử dụng để tạo ra alkyl chloride từ alcohol.
An toàn[sửa | sửa mã nguồn]
Các nhà sản xuất khuyên rằng nên bảo quản carbon tetraiodide ở nhiệt độ gần 0 ℃ (32 ℉). Đây là một chất kích thích. LD50 của nó là 178 mg.kg−1. Nói chung, hợp chất hữu cơ perhalogen hóa nên được coi là độc hại, trừ các perfluoroalkan (chủ yếu là trơ do độ bền của liên kết C–F).
Tham khảo[sửa | sửa mã nguồn]
- ^ “Tetraiodomethane – Compound Summary”. PubChem Compound. USA: National Center for Biodechnology Information. ngày 27 tháng 3 năm 2005. Identification and Related Records. Truy cập ngày 29 tháng 2 năm 2012.
- ^ Finbak, Chr.; Hassel, O. (1937). “Kristallstruktur und Molekülbau von CI4 und CBr4”. Zeitschrift für Physikalische Chemie. B36: 301–308.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Pohl, S. (1982). “Die Kristallstruktur von CI4”. Zeitschrift für Kristallographie. 159: 211–216. Bản gốc lưu trữ ngày 16 tháng 2 năm 2013. Truy cập ngày 4 tháng 12 năm 2017.
- ^ McArthur, R. E.; Simons, J. H. (1950). “Carbon Tetraiodide”. Inorganic Syntheses. III: 37–39.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ P. R. Schreiner, A. A. Fokin (2005). “Carbon Tetraiodide”. Trong L. Paquette (biên tập). Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd.
| HI | He | ||||||||||||||||
| LiI | BeI2 | BI3 | CI4 | NI3 | I2O4, I2O5, I4O9 |
IF, IF3, IF5, IF7 |
Ne | ||||||||||
| NaI | MgI2 | AlI3 | SiI4 | PI3, P2I4 |
S | ICl, ICl3 |
Ar | ||||||||||
| KI | CaI2 | ScI3 | TiI2, TiI3, TiI4 |
VI2, VI3, VOI2 |
CrI2, CrI3, CrI4 |
MnI2 | FeI2, FeI3 |
CoI2 | NiI2 | CuI, CuI2 |
ZnI2 | GaI, GaI2, GaI3 |
GeI2, GeI4 |
AsI3 | Se | IBr | Kr |
| RbI | SrI2 | YI3 | ZrI2, ZrI4 |
NbI2, NbI3, NbI4, NbI5 |
MoI2, MoI3, MoI4 |
TcI3, TcI4 |
RuI2, RuI3 |
RhI3 | PdI2 | AgI | CdI2 | InI3 | SnI2, SnI4 |
SbI3 | TeI4 | I | Xe |
| CsI | BaI2 | HfI4 | TaI3, TaI4, TaI5 |
WI2, WI3, WI4 |
ReI, ReI2, ReI3, ReI4 |
OsI, OsI2, OsI3 |
IrI, IrI2, IrI3 |
PtI2, PtI3, PtI4 |
AuI,AuI3 | Hg2I2, HgI2 |
TlI, TlI3 |
PbI2, PbI4 |
BiI2, BiI3 |
PoI2. PoI4 |
AtI | Rn | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| ↓ | |||||||||||||||||
| LaI2, LaI3 |
CeI2, CeI3 |
PrI2, PrI3 |
NdI2, NdI3 |
PmI3 | SmI2, SmI3 |
EuI2, EuI3 |
GdI2, GdI3 |
TbI3 | DyI2, DyI3 |
HoI3 | ErI3 | TmI2, TmI3 |
YbI2, YbI3 |
LuI3 | |||
| Ac | ThI2, ThI3, ThI4 |
PaI3, PaI4, PaI5 |
UI3, UI4, UI5 |
NpI3 | PuI3 | AmI2, AmI3 |
CmI2, CmI3 |
BkI3 | CfI2, CfI3 |
EsI3 | Fm | Md | No | Lr | |||


