Chromyl(VI) fluoride
| Chromiyl(VI) fluoride | |
|---|---|
 Cấu trúc của Chromiyl(VI) fluoride | |
| Danh pháp IUPAC | Difluoro(dioxo)chromium |
| Tên khác | Chromi đioxyđifluoride |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số EINECS | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| UNII | |
| Thuộc tính | |
| Công thức phân tử | CrO2F2 |
| Khối lượng mol | 121,9936 g/mol |
| Bề ngoài | tinh thể tím |
| Điểm nóng chảy | 31,6 °C (304,8 K; 88,9 °F) |
| Điểm sôi | 30 °C (303 K; 86 °F)[1] (thăng hoa) |
| Độ hòa tan trong nước | phản ứng |
| Cấu trúc | |
| Cấu trúc tinh thể | Đơn nghiêng |
| Nhóm không gian | P21/c, No. 14 |
| Các nguy hiểm | |
| Nguy hiểm chính | nguồn oxy hóa |
| Các hợp chất liên quan | |
| Hợp chất liên quan | Chromiyl(VI) chloride Chromiyl(VI) bromide Chromiyl(VI) iodide |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Chromiyl(VI) fluoride là một hợp chất vô cơ có công thức hóa học CrO2F2. Nó là một chất rắn kết tinh màu đỏ tím, nóng chảy thành chất lỏng màu đỏ cam.[2]
Cấu trúc[sửa | sửa mã nguồn]
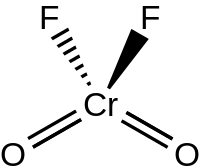
CrO2F2 ở thể lỏng và thể khí có cấu trúc hình học tứ diện với nhóm đối xứng C2v, giống như Chromiyl(VI) chloride.[3] Chromiyl(VI) fluoride đime hóa qua cầu nối fluoride (như O2Cr(μ-F)4CrO2) ở trạng thái rắn, kết tinh trong nhóm không gian P21/c với Z = 4. Độ dài liên kết Cr=O khoảng 157 pm, và Cr–F là 181,7, 186,7 và 209,4 pm. Chromi nằm ở vị trí bát diện biến dạng với số phối trí là sáu.[4]
Lịch sử và điều chế[sửa | sửa mã nguồn]
Chromiyl(VI) fluoride tinh khiết lần đầu tiên được phân lập vào năm 1952 theo báo cáo của Alfred Engelbrecht và Aristid von Grosse.[5] Lần đầu tiên nó được quan sát thấy dưới dạng khí màu đỏ vào đầu thế kỷ 19 khi đun nóng hỗn hợp florit (CaF2), muối Chromiat và axit sunfuric. Những hơi màu đỏ này ban đầu được cho là CrF6, mặc dù một số nhà hóa học cho rằng cấu trúc CrO2F2 tương tự như CrO2Cl2. Fredenhagen, người đã kiểm tra phản ứng của hydro fluoride với Chromiat kiềm đã báo cáo sự tổng hợp thành công hợp chất lần đầu tiên. Một nỗ lực sau đó cho thấy von Wartenberg điều chế CrO2F2 không tinh khiết bằng cách xử lý Chromiyl(VI) chloride với flo nguyên tố.[6] Một nỗ lực khác được thực hiện bởi Wiechert, người đã xử lý HF bằng điChromiat, tạo ra CrO2F2 lỏng không tinh khiết ở -40 ℃.
Quá trình tổng hợp CrO2F2 của Engelbrecht và von Grosse, và hầu hết các lần tổng hợp kế tiếp, đều liên quan đến việc xử lý Chromi(VI) oxit bằng chất flo hóa:[5]
- CrO3 + 2HF ⇌ CrO2F2 + H2O
Phản ứng trên là thuận nghịch, vì nước sẽ dễ dàng thủy phân CrO2F2 trở lại CrO3.
Cách tiếp cận do Georg Brauer xuất bản trong Handbook of Preparative Inorganic Chemistry đã dựa trên cách tiếp cận của von Wartenberg[6] về quá trình flo hóa trực tiếp:
- CrO2Cl2 +F2 → CrO2F2 + Cl2↑
Các phương pháp khác bao gồm xử lý bằng clo fluoride, cacbonyl fluoride hoặc dùng một số hexafluoride kim loại:
- CrO3 + 2ClF → CrO2F2 + Cl2↑ + O2↑
- CrO3 + COF2 → CrO2F2 + CO2↑
- CrO3 + MF6 → CrO2F2 + MOF4 (M = Mo, W)
Phương pháp cuối cùng liên quan đến fluoride của wolfram và molybden được Green và Gard báo cáo là các con đường rất đơn giản và hiệu quả để tạo ra một lượng lớn CrO2F2 tinh khiết.[2] Họ báo cáo năng suất 100% khi các phản ứng được tiến hành ở 120 ℃. Như dự đoán từ các phản ứng tương đối của MoF6 và WF6, phản ứng molybden tiến hành dễ dàng hơn so với wolfram.[7]
Phản ứng[sửa | sửa mã nguồn]
Chromiyl(VI) fluoride phản ứng với nước, tạo ra axit Chromiic và axit flohydric:
- CrO2F2 + 2H2O → H2CrO4 + 2HF
Nó phản ứng với thủy tinh, tạo ra silic tetrafluoride; với muối fluoride, các muối chứa ion floroChromiat (CrO3F−) sẽ được hình thành.[8]
Chromiyl(VI) fluoride là một chất oxy hóa mạnh có khả năng chuyển đổi hydrocarbon thành xeton và axit cacboxylic. Nó cũng có thể được sử dụng làm thuốc thử trong việc điều chế các hợp chất Chromi khác.[2] Giống như một số hợp chất fluoride khác, CrO2F2 phản ứng với thủy tinh và thạch anh, vì vậy nó cần phải được bảo quản trong lọ có nhựa không chứa silic hoặc container kim loại. Khả năng oxy hóa của nó trong các chất vô cơ cũng đã được biết đến.[9] Chromiyl(VI) fluoride có thể trao đổi nguyên tử flo với các oxit kim loại.
- CrO2F2 + MO → MF2 + CrO3
Chromiyl(VI) fluoride cũng sẽ chuyển các oxit của bo và silic thành fluoride.[9] Chromiyl(VI) fluoride phản ứng với fluoride kim loại kiềm và kiềm thổ trong perfluoroheptan (dung môi) để tạo ra ion tetrafloroChromiylat(VI) màu cam:[9]
- CrO2F2 + 2MF → M2CrO2F4
Chromiyl(VI) fluoride cũng phản ứng với axit Lewis, trong đó các phối tử cacboxylat từ anhydride axit hữu cơ và tạo ra sản phẩm phụ acyl fluoride.[9]
- CrO2F2 + 2(CF3CO)2O → CrO2(CF3COO)2 + 2CF3COOF
Chromiyl(VI) fluoride tạo thành sản phẩm cộng với base yếu như NO, NO2 và SO2.
Tham khảo[sửa | sửa mã nguồn]
- ^ Brauer, Georg (1963) [1960]. “Chromyl Fluoride — CrO2F2”. Handbook of Preparative Inorganic Chemistry, Volume 1 (ấn bản 2). Stuttgart; New York: Ferdinand Enke Verlag; Academic Press, Inc. tr. 258–259. ISBN 978-0-32316127-5.
- ^ a b c Gard, G. L. (1986) "Chromium Difluoride Dioxide (Chromyl Fluoride)," Inorg.
- ^ Hobbs, W. E. (1958) "Infrared Absorption Spectra of Chromyl Fluoride and Chromyl Chloride," J. Chem.
- ^ Supeł, J.; Abram, U.; Hagenbach, A.; Seppelt, K. (2007) "Technetium Fluoride Trioxide, TcO3F, Preparation and Properties."
- ^ a b Engelbrecht, A.; von Grosse, A. (1952) "Pure Chromyl Fluoride," J. Am. Chem.
- ^ a b von Wartenberg, H. (1941) "Über höhere Chromfluoride (CrF
4, CrF
5 und CrO
2F
2)" [About higher chromium fluorides (CrF
4, CrF
5 and CrO
2F
2)], Z. Anorg. Lỗi chú thích: Thẻ<ref>không hợp lệ: tên “vonW” được định rõ nhiều lần, mỗi lần có nội dung khác - ^ Green, P. J.; Gard, G. L. (1977) "Chemistry of Chromyl Fluoride. 5.
- ^ Chromyl Fluoride, CrO2F2 trên atomistry.com
- ^ a b c d Brown, S. D.; Green, P.J.; Gard, G.L. (1975) "The Chemistry of Chromyl Fluoride III: Reactions with Inorganic Systems," J. Fluorine Chem. 5(3), 203-219, doi:10.1016/S0022-1139(00)82482-3.
