Interferon beta-1a
 | |
| Dữ liệu lâm sàng | |
|---|---|
| Tên thương mại | Avonex, Rebif, Plegridy, as well as biosimilars |
| Giấy phép | |
| Danh mục cho thai kỳ |
|
| Dược đồ sử dụng | Sub-cutaneous or Intramuscular Injection |
| Mã ATC | |
| Tình trạng pháp lý | |
| Tình trạng pháp lý |
|
| Dữ liệu dược động học | |
| Chu kỳ bán rã sinh học | 10 hrs |
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider |
|
| ChEMBL | |
| Dữ liệu hóa lý | |
| Công thức hóa học | C908H1408N246O252S7 |
| Khối lượng phân tử | 20027.0 g/mol |
| (kiểm chứng) | |
Interferon beta-1a (cũng là interferon beta 1-alpha) là một cytokine trong họ interferon được sử dụng để điều trị bệnh đa xơ cứng (MS).[1] Nó được sản xuất bởi các tế bào động vật có vú, trong khi interferon beta-1b được sản xuất trong E. coli biến đổi.[2] Một số tuyên bố đã được đưa ra rằng Interferon tạo ra khoảng 18%-38% tỷ lệ tái phát MS.[3]
Interferon beta chưa được chứng minh là làm chậm tiến trình khuyết tật.[4][5][6][7] Interferon không phải là thuốc chữa MS (không có cách chữa nào được biết đến); Yêu cầu là interferon có thể làm chậm tiến triển của bệnh nếu bắt đầu sớm và tiếp tục trong suốt thời gian mắc bệnh.[8]
Sử dụng trong y tế[sửa | sửa mã nguồn]
Hội chứng cô lập lâm sàng[sửa | sửa mã nguồn]
Biểu hiện lâm sàng sớm nhất của bệnh đa xơ cứng tái phát là hội chứng cô lập lâm sàng (CIS), nghĩa là một cuộc tấn công duy nhất của một triệu chứng. Trong một CIS, có một cuộc tấn công bán cấp gợi ý về sự khử ion nên được đưa vào phổ của kiểu hình MS.[9] Điều trị bằng interferon sau một cuộc tấn công ban đầu làm giảm nguy cơ phát triển MS xác định lâm sàng.[10][11]
MS tái phát[sửa | sửa mã nguồn]
Các loại thuốc có hiệu quả khiêm tốn trong việc giảm số lần tấn công trong tái phát nhiều lần xơ cứng và giảm tích lũy các tổn thương não, được đo bằng cách sử dụng hình ảnh cộng hưởng từ tăng cường gadolinium (MRI).[10] Interferon làm giảm tái phát khoảng 30% và hồ sơ an toàn của họ làm cho họ trở thành phương pháp điều trị đầu tay. Tuy nhiên, không phải tất cả các bệnh nhân đều đáp ứng với các liệu pháp này. Được biết, 30% bệnh nhân MS không đáp ứng với Beta interferon.[12] Chúng có thể được phân loại trong các đáp ứng di truyền, dược lý và mầm bệnh. Một trong những yếu tố liên quan đến việc không đáp ứng là sự hiện diện của các kháng thể trung hòa beta interferon cao. Liệu pháp interferon và đặc biệt là interferon beta 1b, gây ra việc sản xuất kháng thể trung hòa, thường trong 6 tháng điều trị thứ hai, ở 5 đến 30% bệnh nhân được điều trị. Hơn nữa, một tập hợp con của bệnh nhân RRMS có MS hoạt động đặc biệt, đôi khi được gọi là "MS xấu đi nhanh chóng" thường không đáp ứng với interferon beta 1a.[13][14]
Mặc dù cần nhiều nghiên cứu hơn về tác dụng lâu dài của thuốc,[10] dữ liệu hiện có về tác dụng của interferon chỉ ra rằng liệu pháp dài hạn được bắt đầu sớm là an toàn và nó có liên quan đến kết quả tốt hơn.[8]
Tác dụng phụ[sửa | sửa mã nguồn]
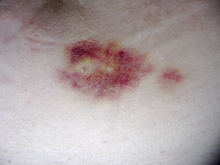
Interferon beta-1a chỉ có sẵn ở dạng tiêm, và có thể gây ra phản ứng da tại vị trí tiêm có thể bao gồm hoại tử da. Phản ứng da với beta interferon phổ biến hơn khi tiêm dưới da và thay đổi rất nhiều trong biểu hiện lâm sàng của họ.[15] Chúng thường xuất hiện trong tháng đầu tiên điều trị mặc dù mức độ thường xuyên và tầm quan trọng của chúng giảm dần sau sáu tháng điều trị. Phản ứng da phổ biến hơn ở phụ nữ. Phản ứng da nhẹ thường không cản trở điều trị trong khi hoại tử xuất hiện ở khoảng 5% bệnh nhân và dẫn đến ngừng điều trị. Cũng theo thời gian, một vết lõm có thể nhìn thấy tại vị trí tiêm do sự phá hủy các mô mỡ cục bộ, được gọi là teo mỡ, có thể phát triển, tuy nhiên điều này hiếm khi xảy ra với điều trị interferon.[16]
Interferon, một phân nhóm của cytokine, được sản xuất trong cơ thể trong các bệnh như cúm để giúp chống lại nhiễm trùng. Họ chịu trách nhiệm cho nhiều triệu chứng nhiễm cúm, bao gồm sốt, đau cơ, mệt mỏi và đau đầu.[17] Nhiều bệnh nhân báo cáo các triệu chứng giống như cúm hàng giờ sau khi dùng beta interferon thường cải thiện trong vòng 24 giờ, là các triệu chứng như vậy liên quan đến sự gia tăng tạm thời của cytokine.[10][15] Phản ứng này có xu hướng biến mất sau 3 tháng điều trị và các triệu chứng của nó có thể được điều trị bằng các thuốc chống viêm không steroid không kê đơn, chẳng hạn như ibuprofen, làm giảm sốt và đau. Một tác dụng thứ cấp thoáng qua khác với interferon-beta là sự suy giảm chức năng của các triệu chứng đã có của bệnh. Tình trạng xấu đi tương tự như bệnh nhân được tạo ra ở bệnh nhân MS do nóng, sốt hoặc căng thẳng (hiện tượng Uhthoff), thường xuất hiện trong vòng 24 giờ điều trị, phổ biến hơn trong những tháng đầu điều trị và có thể kéo dài vài ngày. Một triệu chứng đặc biệt nhạy cảm với tình trạng xấu đi là co cứng. Interferon-beta cũng có thể làm giảm số lượng tế bào bạch cầu (giảm bạch cầu), tế bào lympho (giảm bạch cầu) và bạch cầu trung tính (giảm bạch cầu trung tính), cũng như ảnh hưởng đến chức năng gan. Trong hầu hết các trường hợp, những tác dụng này không nguy hiểm và có thể hồi phục sau khi ngừng hoặc giảm điều trị. Tuy nhiên, khuyến cáo là tất cả bệnh nhân nên được theo dõi thông qua các phân tích máu trong phòng thí nghiệm, bao gồm các xét nghiệm chức năng gan, để đảm bảo sử dụng interferon an toàn.
Để giúp ngăn ngừa phản ứng tại chỗ tiêm, bệnh nhân nên xoay các vị trí tiêm và sử dụng kỹ thuật tiêm vô trùng. Thiết bị tiêm có sẵn để tối ưu hóa quá trình tiêm. Các tác dụng phụ thường rất khó chịu khi nhiều bệnh nhân cuối cùng phải ngừng dùng interferon [cần dẫn nguồn] (hoặc glatiramer axetat, một liệu pháp điều chỉnh bệnh tương đương cần tiêm thường xuyên).
Cơ chế hoạt động[sửa | sửa mã nguồn]
Interferon beta cân bằng sự biểu hiện của các tác nhân chống viêm trong não và làm giảm số lượng tế bào viêm vượt qua hàng rào máu não.[18] Nhìn chung, điều trị bằng beta interferon dẫn đến giảm viêm tế bào thần kinh. Hơn nữa, nó cũng được cho là làm tăng sản xuất yếu tố tăng trưởng thần kinh và do đó cải thiện sự tồn tại của tế bào thần kinh. Trong ống nghiệm, beta interferon làm giảm sản xuất tế bào Th17, một tập hợp con của tế bào lympho T được cho là có vai trò trong sinh lý bệnh của MS.[19]
Dược phẩm tương tự[sửa | sửa mã nguồn]
Tên thương hiệu[sửa | sửa mã nguồn]
Avonex[sửa | sửa mã nguồn]
Avonex đã được chấp thuận tại Hoa Kỳ vào năm 1996 và tại Châu Âu vào năm 1997 và được đăng ký tại hơn 80 quốc gia trên toàn thế giới. Đây là liệu pháp MS hàng đầu ở Mỹ, với khoảng 40% thị trường nói chung và ở châu Âu, với khoảng 30% thị trường nói chung. Nó được sản xuất bởi công ty công nghệ sinh học Biogen, ban đầu được bảo vệ cạnh tranh ở Mỹ theo Đạo luật về thuốc mồ côi.
Avonex được bán trong ba công thức, một loại bột đông khô cần pha chế, một bộ ống tiêm chất lỏng trộn sẵn và bút; nó được dùng một lần mỗi tuần thông qua tiêm bắp.
Tái sinh[sửa | sửa mã nguồn]
Rebif là một loại thuốc điều chỉnh bệnh (DMD) được sử dụng để điều trị bệnh đa xơ cứng trong các trường hợp mắc hội chứng cô lập lâm sàng cũng như tái phát các dạng đa xơ cứng và tương tự như protein beta interferon do cơ thể con người tạo ra. Nó được Merck Serono và Pfizer hợp tác tiếp thị ở Mỹ dưới một ngoại lệ của Đạo luật về thuốc mồ côi. Nó đã được phê duyệt ở châu Âu vào năm 1998 và ở Mỹ vào năm 2002; nó đã được chấp thuận ở hơn 90 quốc gia trên toàn thế giới bao gồm Canada và Úc. EMD Serono đã có quyền duy nhất đối với Rebif tại Hoa Kỳ kể từ tháng 1 năm 2016.[20][21] Rebif được quản lý thông qua tiêm dưới da ba lần mỗi tuần, và có thể được lưu trữ ở nhiệt độ phòng trong tối đa 30 ngày.
CinnoVex[sửa | sửa mã nguồn]
CinnoVex là tên thương mại của Interferon beta-1a tái tổ hợp, được sản xuất dưới dạng sinh học/sinh học ở Iran. Nó được sản xuất ở dạng đông khô và được bán với nước cất để tiêm. Cinnovex được phát triển tại Viện Fraunhofer phối hợp với CinnaGen, và là protein điều trị đầu tiên từ phòng thí nghiệm Fraunhofer được phê duyệt là thuốc sinh học/thuốc sinh học. Có một số nghiên cứu lâm sàng để chứng minh sự giống nhau của CinnoVex và Avonex.[22] Một biến thể hòa tan trong nước nhiều hơn hiện đang được điều tra bởi Vakzine Projekt Management (VPM) GmbH tại Braunschweig, Đức.
Plegridy[sửa | sửa mã nguồn]
Plegridy là tên thương mại của một dạng pegylated của Interferon beta-1a. Lợi thế của Plegridy là nó chỉ cần tiêm hai tuần một lần.[23]
Betaferon (interferon beta-1b)[sửa | sửa mã nguồn]
Liên quan chặt chẽ với interferon beta-1a là interferon beta-1b, cũng được chỉ định cho MS, nhưng được điều chế với một liều khác nhau và được dùng với tần suất khác nhau. Mỗi loại thuốc có một hồ sơ an toàn/hiệu quả khác nhau.[24] Interferon beta-1b chỉ được đưa ra thị trường bởi Bayer ở Mỹ với tên Betaseron và bên ngoài Hoa Kỳ là Betaferon.
Chi phí và bán hàng[sửa | sửa mã nguồn]
Tại Hoa Kỳ vào năm 2015, chi phí là từ 1.284 đến 1.386 USD mỗi lọ 30 mcg.[25] Avonex và Rebif nằm trong top 10 loại thuốc điều trị đa xơ cứng bán chạy nhất năm 2013:[26]
Đó là một ví dụ về một loại thuốc đặc trị chỉ có sẵn thông qua nhà thuốc chuyên khoa. Điều này là do nó đòi hỏi một chuỗi phân phối lạnh và có giá 17.000 đô la một năm.[27]
| Số. | Bán hàng toàn cầu 2013 | INN | Tên thương mại | Các công ty |
|---|---|---|---|---|
| 1 | 4,33 tỷ đô la | Glatiramer axetat | Copaxone | Teva |
| 2 | 3,00 tỷ đô la | Interferon beta 1a | Avonex | Sinh học Idec |
| 3 | 2,51 tỷ đô la | Interferon beta 1a | Tái sinh | Merck KGaA |
| 4 | 1,93 tỷ đô la | Fingerolimod | Gilenya | Novartis |
| 5 | 1,41 tỷ đô la | Natalizumab | Tysabri | Sinh học Idec |
| 6 | 1,38 tỷ đô la | Interferon beta 1b | Betaseron/Betaferon | Chăm sóc sức khỏe |
| 7 | 876 triệu đô la | Dimethyl fumarate | Công nghệ | Sinh học Idec |
| 8 | $ 303 triệu | 4-Aminopyridin | Ampyra | Trị liệu Acorda |
| 9 | 250 triệu đô la | Hormone vỏ thượng thận | Gel Acthar HP | Dược phẩm Questcor |
| 10 | $ 221 triệu | Teriflunomide | Aubagio | Sanofi |
Tham khảo[sửa | sửa mã nguồn]
- ^ Murdoch D, Lyseng-Williamson KA (2005). “Spotlight on subcutaneous recombinant interferon-beta-1a (Rebif) in relapsing-remitting multiple sclerosis”. BioDrugs. 19 (5): 323–5. doi:10.2165/00063030-200519050-00005. PMID 16207073.
- ^ Giovannoni G, Munschauer FE, Deisenhammer F (tháng 11 năm 2002). “Neutralising antibodies to interferon beta during the treatment of multiple sclerosis”. Journal of Neurology, Neurosurgery, and Psychiatry. 73 (5): 465–9. doi:10.1136/jnnp.73.5.465. PMC 1738139. PMID 12397132.
- ^ Stachowiak PhD., Julie (2008). “Is Avonex Right for You?”. Bản gốc lưu trữ ngày 3 tháng 3 năm 2016. Truy cập ngày 7 tháng 5 năm 2008.
- ^ Shirani A, Zhao Y, Karim ME, Evans C, Kingwell E, van der Kop ML, Oger J, Gustafson P, Petkau J, Tremlett H. “Association between use of interferon beta and progression of disability in patients with relapsing-remitting multiple sclerosis”. JAMA. 308: 247–56. doi:10.1001/jama.2012.7625. PMID 22797642.
- ^ Kappos L, Kuhle J, Multanen J, Kremenchutzky M, Verdun di Cantogno E, Cornelisse P, Lehr L, Casset-Semanaz F, Issard D, Uitdehaag BM (tháng 11 năm 2015). “Factors influencing long-term outcomes in relapsing-remitting multiple sclerosis: PRISMS-15”. Journal of Neurology, Neurosurgery, and Psychiatry. 86 (11): 1202–7. doi:10.1136/jnnp-2014-310024. PMC 4680156. PMID 26374702.
- ^ Calabresi, Peter A; Kieseier, Bernd C; Arnold, Douglas L; Balcer, Laura J; Boyko, Alexey; Pelletier, Jean; Liu, Shifang; Zhu, Ying; Seddighzadeh, Ali (tháng 7 năm 2014). “Pegylated interferon beta-1a for relapsing-remitting multiple sclerosis (ADVANCE): a randomised, phase 3, double-blind study”. The Lancet Neurology. 13 (7): 657–665. doi:10.1016/S1474-4422(14)70068-7.
- ^ Jacobs LD, Cookfair DL, Rudick RA, Herndon RM, Richert JR, Salazar AM, Fischer JS, Goodkin DE, Granger CV, Simon JH, Alam JJ, Bartoszak DM, Bourdette DN, Braiman J, Brownscheidle CM, Coats ME, Cohan SL, Dougherty DS, Kinkel RP, Mass MK, Munschauer FE, Priore RL, Pullicino PM, Scherokman BJ, Whitham RH (tháng 3 năm 1996). “Intramuscular interferon beta-1a for disease progression in relapsing multiple sclerosis. The Multiple Sclerosis Collaborative Research Group (MSCRG)”. Annals of Neurology. 39 (3): 285–94. doi:10.1002/ana.410390304. PMID 8602746.
- ^ a b Freedman MS (tháng 1 năm 2011). “Long-term follow-up of clinical trials of multiple sclerosis therapies”. Neurology. 76 (1 Suppl 1): S26-34. doi:10.1212/WNL.0b013e318205051d. PMID 21205679.
- ^ Lublin FD, Reingold SC, Cohen JA, Cutter GR, Sørensen PS, Thompson AJ, Wolinsky JS, Balcer LJ, Banwell B, Barkhof F, Bebo B, Calabresi PA, Clanet M, Comi G, Fox RJ, Freedman MS, Goodman AD, Inglese M, Kappos L, Kieseier BC, Lincoln JA, Lubetzki C, Miller AE, Montalban X, O'Connor PW, Petkau J, Pozzilli C, Rudick RA, Sormani MP, Stüve O, Waubant E, Polman CH (tháng 7 năm 2014). “Defining the clinical course of multiple sclerosis: the 2013 revisions”. Neurology. 83 (3): 278–86. doi:10.1212/WNL.0000000000000560. PMC 4117366. PMID 24871874.
- ^ a b c d Compston A, Coles A (tháng 10 năm 2008). “Multiple sclerosis”. Lancet. 372 (9648): 1502–17. doi:10.1016/S0140-6736(08)61620-7. PMID 18970977.
- ^ Bates D (tháng 1 năm 2011). “Treatment effects of immunomodulatory therapies at different stages of multiple sclerosis in short-term trials”. Neurology. 76 (1 Suppl 1): S14-25. doi:10.1212/WNL.0b013e3182050388. PMID 21205678.
- ^ Bertolotto A, Gilli F (tháng 9 năm 2008). “Interferon-beta responders and non-responders. A biological approach”. Neurological Sciences. 29 Suppl 2 (S2): S216-7. doi:10.1007/s10072-008-0941-2. PMID 18690496.
- ^ Buttinelli C, Clemenzi A, Borriello G, Denaro F, Pozzilli C, Fieschi C (tháng 11 năm 2007). “Mitoxantrone treatment in multiple sclerosis: a 5-year clinical and MRI follow-up”. European Journal of Neurology. 14 (11): 1281–7. doi:10.1111/j.1468-1331.2007.01969.x. PMID 17956449.
- ^ Boster A, Edan G, Frohman E, Javed A, Stuve O, Tselis A, Weiner H, Weinstock-Guttman B, Khan O (tháng 2 năm 2008). “Intense immunosuppression in patients with rapidly worsening multiple sclerosis: treatment guidelines for the clinician”. The Lancet. Neurology. 7 (2): 173–83. doi:10.1016/S1474-4422(08)70020-6. PMID 18207115.
- ^ a b Walther EU, Hohlfeld R (tháng 11 năm 1999). “Multiple sclerosis: side effects of interferon beta therapy and their management”. Neurology. 53 (8): 1622–7. doi:10.1212/wnl.53.8.1622. PMID 10563602.
- ^ Edgar CM, Brunet DG, Fenton P, McBride EV, Green P (tháng 2 năm 2004). “Lipoatrophy in patients with multiple sclerosis on glatiramer acetate”. The Canadian Journal of Neurological Sciences. 31 (1): 58–63. doi:10.1017/s0317167100002845. PMID 15038472.
- ^ Eccles R (tháng 11 năm 2005). “Understanding the symptoms of the common cold and influenza”. The Lancet. Infectious Diseases. 5 (11): 718–25. doi:10.1016/S1473-3099(05)70270-X. PMID 16253889.
- ^ Kieseier BC (tháng 6 năm 2011). “The mechanism of action of interferon-β in relapsing multiple sclerosis”. CNS Drugs. 25 (6): 491–502. doi:10.2165/11591110-000000000-00000. PMID 21649449.
- ^ Mitsdoerffer M, Kuchroo V (tháng 5 năm 2009). “New pieces in the puzzle: how does interferon-beta really work in multiple sclerosis?”. Annals of Neurology. 65 (5): 487–8. doi:10.1002/ana.21722. PMID 19479722.
- ^ Rebif; ngày 29 tháng 7 năm 2016
- ^ EMD Serono Takes on Exclusive Promotion of Rebif (interferon beta-1a) in the US; ngày 19 tháng 1 năm 2016
- ^ Nafissi S, Azimi A, Amini-Harandi A, Salami S, shahkarami MA, Heshmat R (tháng 9 năm 2012). “Comparing efficacy and side effects of a weekly intramuscular biogeneric/biosimilar interferon beta-1a with Avonex in relapsing remitting multiple sclerosis: a double blind randomized clinical trial”. Clinical Neurology and Neurosurgery. 114 (7): 986–9. doi:10.1016/j.clineuro.2012.02.039. PMID 22429566.
- ^ Peginterferon beta-1a description National Multiple Sclerosis Society (ngày 15 tháng 8 năm 2014). Truy cập Jan 2016
- ^ Nikfar S, Rahimi R, Abdollahi M (tháng 10 năm 2010). “A meta-analysis of the efficacy and tolerability of interferon-β in multiple sclerosis, overall and by drug and disease type”. Clinical Therapeutics. 32 (11): 1871–88. doi:10.1016/j.clinthera.2010.10.006. PMID 21095482.
- ^ Langreth, Robert (ngày 29 tháng 6 năm 2016). “Decoding Big Pharma's Secret Drug Pricing Practices”. Bloomberg. Truy cập ngày 15 tháng 7 năm 2016.
- ^ Top 10 best-selling multiple sclerosis drugs of 2013; ngày 9 tháng 9 năm 2014
- ^ Gleason PP, Alexander GC, Starner CI, Ritter ST, Van Houten HK, Gunderson BW, Shah ND (tháng 9 năm 2013). “Health plan utilization and costs of specialty drugs within 4 chronic conditions”. Journal of Managed Care Pharmacy. 19 (7): 542–8. doi:10.18553/jmcp.2013.19.7.542. PMID 23964615.
