Platin(IV) chloride
| Platin(IV) chloride | |
|---|---|
 Cấu trúc của platin(IV) chloride | |
| Danh pháp IUPAC | Platinum(IV) chloride |
| Tên khác | Platin tetrachloride Platinic chloride Bạch kim(IV) chloride Bạch kim tetrachloride |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Ảnh Jmol-3D | ảnh ảnh 2 |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| ChemSpider | |
| Thuộc tính | |
| Công thức phân tử | PtCl4 |
| Khối lượng mol | 336,8908 g/mol (khan) 426,9672 g/mol (5 nước) |
| Bề ngoài | bột nâu (khan) tinh thể đỏ (5 nước) |
| Khối lượng riêng | 4,303 g/cm³ (khan) 2,43 g/cm³ (5 nước) |
| Điểm nóng chảy | 370 °C (643 K; 698 °F) (phân hủy) |
| Điểm sôi | phân hủy |
| Độ hòa tan trong nước | 142 g/100 mL (khan)[1] tan tốt (5 nước) |
| Độ hòa tan | khan: tan trong axeton tan ít trong etanol không tan trong ete 5 nước: tan trong etanol, ete tạo phức với amonia |
| MagSus | -93,0·10-6 cm³/mol |
| Cấu trúc | |
| Hình dạng phân tử | vuông phẳng |
| Các nguy hiểm | |
| Phân loại của EU | không được liệt kê |
| LD50 | 276 mg/kg (đường miệng, chuột) |
| Các hợp chất liên quan | |
| Anion khác | Platin(IV) bromide Platin(IV) fluoride Platin(IV) sulfide |
| Cation khác | Iriđi(IV) chloride |
| Hợp chất liên quan | Platin(II) chloride Platin(VI) fluoride |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Platin(IV) chloride hay bạch kim(IV) chloride là một hợp chất vô cơ của platin và clo với công thức hóa học PtCl4. Chất rắn màu nâu này chứa platin ở trạng thái oxy hóa +4.
Cấu trúc[sửa | sửa mã nguồn]
Là một hợp chất điển hình của Pt(IV), các trung tâm kim loại có dạng hình học phối trí bát diện, {PtCl6}. Cấu trúc này đạt được bằng cách tạo thành một polyme; trong đó, một nửa chloride làm cầu nối giữa các trung tâm platin. Do cấu trúc polyme của nó, PtCl4 chỉ tan khi phá vỡ các phối tử cầu nối chloride. Do đó, thêm HCl sẽ tạo H2PtCl6. Axit và base Lewis của Pt(IV) của các loại cis-PtCl4L2 được biết đến, nhưng hầu hết được điều chế bởi quá trình oxy hóa của dẫn xuất Pt(II).
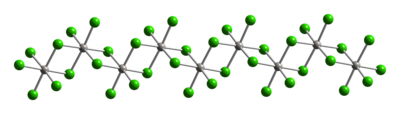 |
Sự hình thành và phản ứng[sửa | sửa mã nguồn]
PtCl4 chủ yếu gặp trong việc xử lý axit hexacloroplatinic(IV), thu được bằng cách hòa tan kim loại Pt trong nước cường toan. Gia nhiệt H2PtCl6 thì thu được PtCl4:
- H2PtCl6 → PtCl4 + 2HCl
Nếu axit dư được loại bỏ, PtCl4 kết tinh từ dung dịch nước trong tinh thể lớn màu đỏ của pentahydrat PtCl4·5H2O,[2] có thể bị khử nước bằng cách đun nóng đến khoảng 300 ℃ trong dòng clo khô. Pentahydrat ổn định và được sử dụng làm dạng thương mại của PtCl4.
Xử lý PtCl4 bằng nước tạo ra ion hexahydroxoplatinat(IV), [Pt(OH)6]2−. Với thuốc thử metyl Grignard sau khi thủy phân một phần, PtCl4 chuyển thành phức hình khối [Pt(CH3)3(OH)]4.[3] Khi đun nóng PtCl4, hợp chất bị mất clo để tạo PtCl2:
- PtCl4 → PtCl2 + Cl2
Các halogen nặng hơn, PtBr4 và PtI4, cũng được biết đến.
Hợp chất khác[sửa | sửa mã nguồn]
PtCl4 còn tạo một số hợp chất với NH3, như PtCl4·2NH3 là tinh thể vàng cam tan trong nước (cis-), tinh thể bát diện màu vàng chanh (trans-), PtCl4·3NH3 là tinh thể dạng lá sáng bóng màu vàng tan trong nước, PtCl4·4NH3 là tinh thể bát diện cỡ micromet màu vàng nhạt[4], PtCl4·5NH3·H2O là tinh thể không màu, D = 2,58 g/cm³[5] hay PtCl4·6NH3 là tinh thể hình kim không màu.[4]
Tham khảo[sửa | sửa mã nguồn]
- ^ CRC Handbook of Chemistry and Physics, 97th Edition
- ^ George Samuel Newth (1920). A text-book of inorganic chemistry. Longmans, Green, and co. tr. 694.
- ^ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ a b A Text-book Of Inorganic Chemistry Vol-x (J.newton Friend; 1928), trang 234; 236; 239; 240. Truy cập 13 tháng 4 năm 2021.
- ^ Handbook… (Pierre Villars, Karin Cenzual, Roman Gladyshevskii; Walter de Gruyter GmbH & Co KG, 24 thg 7, 2017 - 1970 trang). Truy cập 13 tháng 4 năm 2021.
Đọc thêm[sửa | sửa mã nguồn]
- Cotton, S. A. Chemistry of Precious Metals, Chapman and Hall (London): 1997. ISBN 0-7514-0413-6.
