Rutheni(III) chloride
| Rutheni(III) chloride | |
|---|---|
 Mẫu rutheni(III) chloride ngậm nước | |
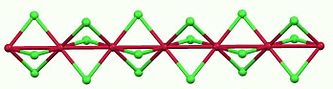 Cấu trúc của beta-rutheni(III) chloride | |
| Tên khác | Rutheni trichloride |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số RTECS | VM2650000 |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| UNII | |
| Thuộc tính | |
| Công thức phân tử | RuCl3 |
| Khối lượng mol | 207,4281 g/mol 261,47394 g/mol (3 nước) |
| Điểm nóng chảy | > 500 °C (773 K; 932 °F) (phân hủy) |
| Điểm sôi | |
| Độ hòa tan trong nước | tan |
| Độ hòa tan | tạo phức với amonia, hydrazin, thiourê |
| MagSus | +1998,0·10-6 cm³/mol |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Rutheni(III) chloride là hợp chất hóa học có thành phần gồm hai nguyên tố là rutheni và clo, với công thức hóa học được quy định là RuCl3. "Rutheni(III) chloride" thường dùng để chỉ dạng ngậm nước của hợp chất này, có công thức chung RuCl3·xH2O. Cả hai loại khan và ngậm nước đều có màu nâu đậm hoặc đen. Dạng ngậm nước, với một tỷ lệ khác nhau của nước kết tinh, thường xấp xỉ với trihydrat, là một vật liệu ban đầu thường được sử dụng trong hóa học về chất rutheni.
Điều chế và tính chất[sửa | sửa mã nguồn]
Rutheni(III) chloride dạng khan thường được điều chế bằng cách đun nóng kim loại rutheni với khí clo. Trong quá trình tổng hợp ban đầu, quá trình clo hóa được tiến hành với sự có mặt của cacbon monoxit, sản phẩm được vận chuyển bởi dòng khí và kết tinh khi làm lạnh.[1] Có hai dạng thù hình của RuCl3 được biết đến. Dạng α là chất rắn màu đen, có cấu trúc CrCl3 với các liên kết Ru–Ru dài 346 pm. Dạng β có màu nâu sẫm kết tinh trong với dạng tinh thể lục giác. Dạng thù hình β được chuyển đổi không thể đảo ngược thành dạng α ở nhiệt độ 450–600 ℃. Dạng β là diamagnetic, trong khi α-RuCl3 là paramagnetic.
Hợp chất khác[sửa | sửa mã nguồn]
RuCl3 còn tạo một số hợp chất với NH3, như:
- fac-RuCl3·3NH3 (tinh thể đỏ)[2], D = 2,42 g/cm³[3];
- 2RuCl3·7NH3 (bột màu tím đậm, tan trong nước tạo ra dung dịch màu đỏ tím đậm);[4]
- RuCl3·4NH3 xuất hiện ở hai dạng cis- và trans- đều là tinh thể cam;[2]
- RuCl3·5NH3 (tinh thể vàng/vàng cam)[2], D = 2,04 g/cm³[3];
- RuCl3·6NH3 (tinh thể không màu)[2], D = 1,87 g/cm³[3].
RuCl3 còn tạo một số hợp chất với CS(NH2)2, như:
- RuCl3·4CS(NH2)2 (tinh thể xám lục);[5]
- RuCl3·5CS(NH2)2 (chất rắn dương);[6]
- RuCl3·6CS(NH2)2 (tinh thể dương đen).[7]
Tham khảo[sửa | sửa mã nguồn]
- ^ Remy, H.; Kühn, M. (1924). “Beiträge zur Chemie der Platinmetalle. V. Thermischer Abbau des Ruthentrichlorids und des Ruthendioxyds”. Z. Anorg. Allg. Chem. 137 (1): 365–388. doi:10.1002/zaac.19241370127.
- ^ a b c d The Chemistry of Ruthenium (E.A. Seddon, K.R. Seddon; Elsevier, 22 thg 10, 2013 - 1373 trang), trang 222; 229; 243; 245. Truy cập 22 tháng 2 năm 2021.
- ^ a b c Handbook… (Pierre Villars, Karin Cenzual, Roman Gladyshevskii; Walter de Gruyter GmbH & Co KG, 24 thg 7, 2017 - 1970 trang), trang 1610. Truy cập 26 tháng 2 năm 2021.
- ^ A Text-book Of Inorganic Chemistry Vol-x (J.newton Friend; 1928), trang 194. Truy cập 10 tháng 6 năm 2021.
- ^ ТИОКАРБАМИДНЫЕ КОМПЛЕКСЫ РУТЕНИЯ(II). Truy cập 31 tháng 5 năm 2020.
- ^ On blue ruthenium complexes with thiourea. Truy cập 31 tháng 5 năm 2020.
- ^ Comptes rendus (doklady) de l'academie des sciences de l'urss, Tập 287,Số phát hành 2 (1986), trang 877 – [1]. Truy cập 31 tháng 5 năm 2020.
