Sắt tetracarbonyl hydride
| Sắt tetracarbonyl hydride | |
|---|---|
 | |
 | |
| Tên khác | tetracarbonyldihydroiron, sắt dihydrotetracarbonyl, dihydroiron tetracarbonyl |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| Thuộc tính | |
| Công thức phân tử | H2Fe(CO)4 |
| Khối lượng mol | 169,90448 g/mol |
| Bề ngoài | Chất lỏng màu vàng nhạt (ở -20 ℃) |
| Điểm nóng chảy | −70 °C (203 K; −94 °F) |
| Điểm sôi | −20 °C (253 K; −4 °F) (phân hủy) |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
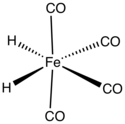
Sắt tetracarbonyl hydride còn gọi là tetracarbonyldihydroiron, sắt dihydrotetracarbonyl hay dihydroiron tetracarbonyl là một hợp chất cơ kim có công thức hóa học H2Fe(CO)4. Hợp chất này là hydride kim loại đầu tiên được phát hiện. Chất lỏng màu vàng nhạt này bền ở nhiệt độ thấp nhưng bị phân hủy nhanh chóng ở nhiệt độ trên −20 ℃.[1]
Cấu trúc và tính chất[sửa | sửa mã nguồn]
Sắt tetracarbonyl hydride có nhóm có đối xứng phân tử C2v với hình học trung gian giữa hình bát diện và hình tứ diện. Được xem như một phức chất bát diện, các phối tử hydride là cis. Được xem như một phức chất của nhóm dạng tứ diện, các hydride chiếm các mặt liền kề của tứ diện.[2] Mặc dù cấu trúc của tetracarbonyliron với các nguyên tử hydro liên kết như một phối tử đơn lẻ đã được đề xuất như một chất trung gian trong một số phản ứng sắp xếp lại[3], trạng thái bền của hợp chất có hai nguyên tử là phối tử độc lập.[4]
Một số phương pháp điều chế[sửa | sửa mã nguồn]
Phương pháp 1[sửa | sửa mã nguồn]
Cho bari hydroxide tác dụng với sắt pentacarbonyl:
+ + +
|
|---|
Phương pháp 2[sửa | sửa mã nguồn]
Cho sắt pentacarbonyl tác dụng với hydro:
![114x114px[liên kết hỏng]](http://upload.wikimedia.org/wikipedia/commons/thumb/0/08/Iron-pentacarbonyl-from-xtal-3D-vdW.png/109px-Iron-pentacarbonyl-from-xtal-3D-vdW.png) + +![97x97px[liên kết hỏng]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d4/Dihydrogen-3D-vdW.png/105px-Dihydrogen-3D-vdW.png) ![101x101px[liên kết hỏng]](http://upload.wikimedia.org/wikipedia/commons/thumb/1/17/Carbon_monoxide_3d_model_2.png/123px-Carbon_monoxide_3d_model_2.png) + +![132x132px[liên kết hỏng]](http://upload.wikimedia.org/wikipedia/commons/thumb/c/c3/Iron-tetracarbonyl-hydride-3D-vdW.png/109px-Iron-tetracarbonyl-hydride-3D-vdW.png)
|
Xem thêm[sửa | sửa mã nguồn]
Tham khảo[sửa | sửa mã nguồn]
- ^ Blanchard, Arthur A.; Coleman, George W. (1946). “Iron Tetracarbonyl Dihydride”. Inorganic Syntheses. 2: 243–244. doi:10.1002/9780470132333.ch77. ISBN 9780470132333.
- ^ McNeill, E. A.; Scholer, F. R. (1977). “Molecular structure of the gaseous metal carbonyl hydrides of manganese, iron, and cobalt”. J. Am. Chem. Soc. 99 (19): 6243. doi:10.1021/ja00461a011.
- ^ Soubra, C.; Oishi, Y.; Albright, T. A.; Fujimoto, H. (2001). “Intramolecular Rearrangements in Six-Coordinate Ruthenium and Iron Dihydrides”. Inorg. Chem. 40 (4): 620–627. doi:10.1021/ic0006089. PMID 11225102.
- ^ Drouin, B. J.; Kukolich, S. G. (1998). “Molecular Structure of Tetracarbonyldihydroiron: Microwave Measurements and Density Functional Theory Calculations”. J. Am. Chem. Soc. 120 (27): 6774–6780. doi:10.1021/ja9741584.





