Khác biệt giữa bản sửa đổi của “Ferrit (sắt)”
Không có tóm lược sửa đổi |
Không có tóm lược sửa đổi |
||
| Dòng 1: | Dòng 1: | ||
| ⚫ | |||
{{Chất lượng kém|ngày=14 |
|||
[[File:Steel pd.svg|thumb|right|300px| [[Sơ đồ pha]] sắt-cacbon, cho thấy các điều kiện dưới đó '''ferrite''' (α) ổn định.]] |
|||
|tháng=05 |
|||
|năm=2017 |
|||
|lý do=Quá ngắn, không nguồn.}} |
|||
{{chú thích trong bài}} |
|||
| ⚫ | |||
Nó có cường độ 280 N / mm2 và độ cứng khoảng 80 [[thang Brinell]]<ref>{{Citation | title = Structure of plain steel | url = http://www.keytometals.com/page.aspx?ID=CheckArticle&site=kts&NM=3 | accessdate = 2008-10-21}}.</ref>. |
|||
Dưới 910°C hợp chất lập thể trung tâm thân của sắt nguyên chất ổn định. Trên nhiệt độ này, allotrope khối sắt mặt tâm, austenit (gamma-iron) ổn định. Trên {{convert|1390|C|F|abbr=on}}, đến nhiệt độ nóng chảy {{convert|1539|C|F|abbr=on}}, cấu trúc tinh thể khối trung tâm cơ thể lại hình thành ổn định hơn, như là đồng vị-ferrite (δ-Fe). Ferrite vượt quá nhiệt độ tới hạn A2 (nhiệt độ Curie) ở 771 ° C (1.044 K, 1,420 ° F), ở đó nó mang tính paramagnetic chứ không phải ferromagnetic. Thuật ngữ là beta ferrite hoặc beta iron (β-Fe). Thuật ngữ beta sắt không còn được sử dụng vì nó là crystallographically giống hệt nhau, và lĩnh vực của nó lĩnh vực tiếp giáp với, α-sắt. |
|||
Chỉ có một lượng rất nhỏ carbon có thể bị hòa tan trong ferrite,<ref name=Alvarenga>{{cite journal |vauthors=Alvarenga HD, Van de Putte T, Van Steenberge N, Sietsma J, Terryn H |title=Influence of Carbide Morphology and Microstructure on the Kinetics of Superficial Decarburization of C-Mn Steels |journal=Metal Mater Trans A. |date=Apr 2009 |doi=10.1007/s11661-014-2600-y }}</ref> độ tan tối đa khoảng 0,02% trọng lượng ở 723 ° C và 0,001% Cacbon ở {{convert|0|C}}.<ref>{{harvnb|Smith|Hashemi|2006|p=363}}.</ref>. Nguyên nhân là do carbon hòa tan trong sắt, với các nguyên tử cacbon gấp đôi đường kính của các "lỗ hổng" kẽ hở, do đó mỗi nguyên tử cacbon được bao quanh bởi một trường địa phương mạnh. Vì enthalpy của hỗn hợp là dương (không thuận lợi), nhưng sự đóng góp của entropy vào năng lượng tự do của dung dịch ổn định cấu trúc ở hàm lượng cacbon thấp. 723 ° C (1,333 ° F) cũng là nhiệt độ tối thiểu mà sắt-carbon austenit (0,8% trọng lượng C) ổn định; Ở nhiệt độ này có một phản ứng eutectoid giữa ferrite, austenite và cementite. |
|||
Thép nhẹ (thép cacbon lên đến khoảng 0,2% trọng lượng C) chủ yếu là chất ferit và lượng cementite (sắt cacbua) ngày càng tăng trong cấu trúc hình ngọc trai gọi là pearlite. Vì bainite và pearlit có chứa ferrite như là một thành phần, bất kỳ hợp kim sắt-carbon nào sẽ chứa một số lượng ferrite nếu nó được phép đạt được sự cân bằng ở nhiệt độ phòng. Số lượng chính xác của chất ferrite sẽ phụ thuộc vào quá trình làm lạnh hợp kim sắt-cacbon chịu được khi nó nguội đi. |
|||
[[File:Iron-alpha-pV.svg|thumb|right|200px|Khối lượng mol so với áp lực cho α-ferrite ở nhiệt độ phòng.]] |
|||
Do ý nghĩa của nó đối với các lõi hành tinh, nên các tính chất vật lý của sắt ở áp suất và nhiệt độ cao cũng đã được nghiên cứu rộng rãi. Α-ferrite, là dạng sắt ổn định trong các điều kiện tiêu chuẩn, có thể chịu áp suất lên tới ca. 15 GPa trước khi biến thành một dạng áp suất cao gọi là ε-iron, kết tinh trong một cấu trúc đóng chặt lục giác (hcp). |
|||
[[Thể loại:Sắt]] |
[[Thể loại:Sắt]] |
||
Phiên bản lúc 06:05, ngày 15 tháng 5 năm 2017
Sắt non: chứa ít hơn 0,5% cacbon. Nó là sản phẩm dai, dễ uốn, không dễ nóng chảy như gang thô. Nó có rất ít cacbon. Nếu mài nó thành lưỡi sắc, nó đánh mất tính chất này rất nhanh.
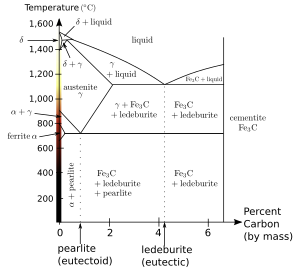
Nó có cường độ 280 N / mm2 và độ cứng khoảng 80 thang Brinell[1].
Dưới 910°C hợp chất lập thể trung tâm thân của sắt nguyên chất ổn định. Trên nhiệt độ này, allotrope khối sắt mặt tâm, austenit (gamma-iron) ổn định. Trên 1.390 °C (2.530 °F), đến nhiệt độ nóng chảy 1.539 °C (2.802 °F), cấu trúc tinh thể khối trung tâm cơ thể lại hình thành ổn định hơn, như là đồng vị-ferrite (δ-Fe). Ferrite vượt quá nhiệt độ tới hạn A2 (nhiệt độ Curie) ở 771 ° C (1.044 K, 1,420 ° F), ở đó nó mang tính paramagnetic chứ không phải ferromagnetic. Thuật ngữ là beta ferrite hoặc beta iron (β-Fe). Thuật ngữ beta sắt không còn được sử dụng vì nó là crystallographically giống hệt nhau, và lĩnh vực của nó lĩnh vực tiếp giáp với, α-sắt.
Chỉ có một lượng rất nhỏ carbon có thể bị hòa tan trong ferrite,[2] độ tan tối đa khoảng 0,02% trọng lượng ở 723 ° C và 0,001% Cacbon ở 0 °C (32 °F).[3]. Nguyên nhân là do carbon hòa tan trong sắt, với các nguyên tử cacbon gấp đôi đường kính của các "lỗ hổng" kẽ hở, do đó mỗi nguyên tử cacbon được bao quanh bởi một trường địa phương mạnh. Vì enthalpy của hỗn hợp là dương (không thuận lợi), nhưng sự đóng góp của entropy vào năng lượng tự do của dung dịch ổn định cấu trúc ở hàm lượng cacbon thấp. 723 ° C (1,333 ° F) cũng là nhiệt độ tối thiểu mà sắt-carbon austenit (0,8% trọng lượng C) ổn định; Ở nhiệt độ này có một phản ứng eutectoid giữa ferrite, austenite và cementite.
Thép nhẹ (thép cacbon lên đến khoảng 0,2% trọng lượng C) chủ yếu là chất ferit và lượng cementite (sắt cacbua) ngày càng tăng trong cấu trúc hình ngọc trai gọi là pearlite. Vì bainite và pearlit có chứa ferrite như là một thành phần, bất kỳ hợp kim sắt-carbon nào sẽ chứa một số lượng ferrite nếu nó được phép đạt được sự cân bằng ở nhiệt độ phòng. Số lượng chính xác của chất ferrite sẽ phụ thuộc vào quá trình làm lạnh hợp kim sắt-cacbon chịu được khi nó nguội đi.

Do ý nghĩa của nó đối với các lõi hành tinh, nên các tính chất vật lý của sắt ở áp suất và nhiệt độ cao cũng đã được nghiên cứu rộng rãi. Α-ferrite, là dạng sắt ổn định trong các điều kiện tiêu chuẩn, có thể chịu áp suất lên tới ca. 15 GPa trước khi biến thành một dạng áp suất cao gọi là ε-iron, kết tinh trong một cấu trúc đóng chặt lục giác (hcp).
- ^ Structure of plain steel, truy cập ngày 21 tháng 10 năm 2008.
- ^ Alvarenga HD, Van de Putte T, Van Steenberge N, Sietsma J, Terryn H (tháng 4 năm 2009). “Influence of Carbide Morphology and Microstructure on the Kinetics of Superficial Decarburization of C-Mn Steels”. Metal Mater Trans A. doi:10.1007/s11661-014-2600-y.
- ^ Smith & Hashemi 2006, tr. 363.
