Ledipasvir/sofosbuvir
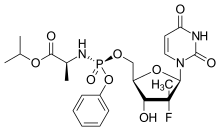
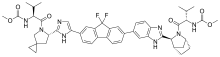 | |
 Ledipasvir | |
| Kết hợp của | |
|---|---|
| Ledipasvir | NS5A inhibitor |
| Sofosbuvir | NS5B (RNA polymerase) inhibitor |
| Dữ liệu lâm sàng | |
| Tên thương mại | Harvoni, Hepcinat-LP, others |
| AHFS/Drugs.com | Chuyên khảo |
| Giấy phép | |
| Danh mục cho thai kỳ |
|
| Dược đồ sử dụng | by mouth |
| Mã ATC | |
| Tình trạng pháp lý | |
| Tình trạng pháp lý |
|
| Các định danh | |
| PubChem CID | |
| KEGG | |
| Dữ liệu hóa lý | |
| Công thức hóa học | C71H83F3N11O15P |
| Khối lượng phân tử | 1418.476 g/mol |
| Điểm nóng chảy | 170–225 °C (338–437 °F) |
Ledipasvir/sofosbuvir, được bán dưới tên thương mại là Harvestoni trong số những loại khác, là một loại thuốc dùng để điều trị viêm gan C. [1] Nó là sự kết hợp của ledipasvir và sofosbuvir.[1] Tỷ lệ chữa khỏi là 94% đến 99% ở những người bị nhiễm virut viêm gan C (HCV) kiểu gen 1.[2] Một số bằng chứng cũng hỗ trợ sử dụng trong kiểu gen HCV 3 và 4.[2] Nó được uống hàng ngày trong 8-24 tuần.[1]
Nó thường được dung nạp tốt.[3] Các tác dụng phụ thường gặp bao gồm đau cơ, nhức đầu, buồn nôn, phát ban và ho.[1] Không rõ liệu sử dụng trong thai kỳ có an toàn cho em bé hay không.[1] Ledipasvir hoạt động bằng cách giảm hoạt động của NS5A và sofosbuvir hoạt động bằng cách giảm hoạt động của NS5B polymerase.[1]
Ledipasvir/sofosbuvir đã được chấp thuận cho sử dụng y tế tại Hoa Kỳ vào năm 2014.[1] Nó nằm trong Danh sách các loại thuốc thiết yếu của Tổ chức Y tế Thế giới, loại thuốc hiệu quả và an toàn nhất cần có trong hệ thống y tế.[4] Chi phí bán buôn ở Hoa Kỳ là khoảng US $ 91,589,40 trong 12 tuần kể từ năm 2016.[5] Ở Bangladesh, số tiền này có giá US $ 1,092.00.[6] Một số người đi du lịch đến Ấn Độ để được tiếp cận với thuốc giá thấp hơn.[7]
Sử dụng trong y tế[sửa | sửa mã nguồn]
Tỷ lệ chữa khỏi là 94% đến 99% ở những người bị nhiễm genotype 1 (46% trường hợp HCV).[8] Nó cũng đã được đánh giá để điều trị nhiễm trùng các kiểu gen viêm gan C khác, và đã cho thấy kết quả đầy hứa hẹn ở kiểu gen 3 và 4 (lần lượt chiếm 30% và ít hơn 22% trường hợp HCV).[2][8][9][10][11]
Kháng thuốc[sửa | sửa mã nguồn]
Đột biến NS5A[sửa | sửa mã nguồn]
Nhiều đột biến HCV replicons là cần thiết để gây ra một ảnh hưởng quan trọng trong kháng chiến do nhiều cơ chế hoạt động.[12] Nhìn chung, kiểu gen HCV 1a ít có khả năng chống đột biến hơn kiểu gen 1b.[13]
Đối với kiểu gen 1b, một sự thay thế amino acid duy nhất (ví dụ L31V) trong bản sao có sức đề kháng tăng ít hơn 100 lần so với ledipasvir ở Harvoni, trong khi sự thay thế hai amino acid có sức đề kháng tăng hơn 1000 lần.[13][14] Kiểu gen 1a có sự tăng sức đề kháng tương tự nhưng đáng kể hơn với mỗi lần tăng thay thế amino acid tương ứng với sự thay thế liên quan đến kháng thuốc ở K24R, M28T/V, Q30R/H/K/L, L31M và Y93H/N.[15]
Các đa hình NS5A cũng có ảnh hưởng đến tình trạng kháng virut với các thay thế amino acid liên quan đến kháng thuốc phổ biến nhất được phát hiện tại Q30R, Y93H hoặc N và L31M ở những bệnh nhân có đáp ứng virus nhanh (RVR).[15] Các đa hình liên quan đến kháng thuốc NS5A cơ bản cụ thể được quan sát trong các thử nghiệm lâm sàng là M28T/V, Q30H, Q30R, L31M, H58P, Y93H và Y93N ở kiểu gen 1a và L28M, A92T và Y93H ở kiểu gen 1b.[15] Bệnh nhân có nhiều đa hình NS5A cơ bản có xu hướng có tỷ lệ tái phát cao hơn khi sử dụng ledipasvir / sofosbuvir.[15] Sự khác biệt về tỷ lệ tái phát giữa các nhóm kinh nghiệm điều trị ngây thơ và điều trị với đa hình NS5A ban đầu dao động từ 1% sau chế độ 12 tuần và 0% sau chế độ điều trị 24 tuần.[13][15]
Đột biến NS5B[sửa | sửa mã nguồn]
Một thay thế amino acid duy nhất S282T góp phần kháng virut và làm giảm hoạt động của sofosbuvir trong ledipasvir/sofosbuvir khoảng 2 đến 18 lần.[13][16]
Kháng chiến chéo[sửa | sửa mã nguồn]
Không thấy kháng chéo trong sự kết hợp giữa ledipasvir và sofosbuvir trong ION giai đoạn 1,2 và, 3 thử nghiệm lâm sàng vì ledipasvir hoạt động hoàn toàn chống lại sự thay thế liên quan đến kháng thuốc của sofosbuvir và ngược lại.[15][17]
Tác dụng phụ[sửa | sửa mã nguồn]
Hơn 10% số người dùng ledipasvir/sofosbuvir bị đau đầu hoặc mệt mỏi; phát ban, buồn nôn, tiêu chảy và mất ngủ xảy ra ở khoảng 1% đến 10% số người dùng thuốc.[9][18]
Phản ứng nghiêm trọng hơn có liên quan đến phản ứng dị ứng với thuốc và các vấn đề về tim mạch. Tác dụng phụ của Harvestoni được coi là tương đối nhẹ so với điều trị dựa trên interferon cũ.
Tương tác thuốc[sửa | sửa mã nguồn]
Ledipasvir / sofosbuvir là chất nền cho các chất vận chuyển thuốc P-Glycoprotein (P-gp) và protein kháng ung thư vú (BCRP).[13] Sự hấp thu qua đường ruột của các chất vận chuyển thuốc này có thể bị giảm bởi các chất gây cảm ứng như rifampin và St. John's wort.[19]
Bệnh nhân cũng nên tránh xa thuốc đối kháng H2 Receptor (H2RA) và thuốc ức chế bơm Proton (PPI) vì chúng làm giảm nồng độ ledipasvir (độ hòa tan phụ thuộc pH và cao hơn trong điều kiện axit). Do đó, nên dùng PPI ít nhất hai giờ sau khi ledipasvir/sofosbuvir với liều nhỏ hơn hoặc bằng 20 mg mỗi ngày và H2RA với liều nhỏ hơn hoặc bằng 40 mg hai lần mỗi ngày.[13][20]
Ledipasvir/sofosbuvir cũng nên tránh khi dùng amiodarone hoặc các loại thuốc khác làm giảm nhịp tim; có nguy cơ nghiêm trọng làm tim đập chậm hoặc ngừng đập khi ledipasvir/sofosbuvir được sử dụng với các thuốc này.[9][18]
Xã hội và văn hoá[sửa | sửa mã nguồn]
Một nhà sản xuất là Gilead Sciences.[1]
Tham khảo[sửa | sửa mã nguồn]
- ^ a b c d e f g h “Ledipasvir and Sofosbuvir”. The American Society of Health-System Pharmacists. Lưu trữ bản gốc ngày 25 tháng 12 năm 2016. Truy cập ngày 8 tháng 12 năm 2016.
- ^ a b c Keating GM (2015). “Ledipasvir/Sofosbuvir: a review of its use in chronic hepatitis C”. Drugs. 75 (6): 675–85. doi:10.1007/s40265-015-0381-2. PMID 25837989.
- ^ The selection and use of essential medicines: Twentieth report of the WHO Expert Committee 2015 (including 19th WHO Model List of Essential Medicines and 5th WHO Model List of Essential Medicines for Children) (PDF). WHO. 2015. tr. 70. ISBN 9789240694941. Lưu trữ (PDF) bản gốc ngày 20 tháng 12 năm 2016. Truy cập ngày 8 tháng 12 năm 2016.
- ^ “WHO Model List of Essential Medicines (19th List)” (PDF). World Health Organization. tháng 4 năm 2015. Lưu trữ (PDF) bản gốc ngày 13 tháng 12 năm 2016. Truy cập ngày 8 tháng 12 năm 2016.
- ^ “NADAC as of 2016-12-21 | Data.Medicaid.gov”. Centers for Medicare and Medicaid Services. Lưu trữ bản gốc ngày 24 tháng 12 năm 2016. Truy cập ngày 25 tháng 12 năm 2016.
- ^ Azam, Monirul. “1”. Intellectual Property and Public Health in the Developing World (bằng tiếng Anh). Open Book Publishers. ISBN 9781783742318. Lưu trữ bản gốc ngày 26 tháng 12 năm 2016.
- ^ “Hep C drug tourism has begun as patients seek Harvoni, Sovaldi overseas”. FiercePharma. ngày 2 tháng 6 năm 2015. Lưu trữ bản gốc ngày 4 tháng 11 năm 2015. Truy cập ngày 25 tháng 10 năm 2015.
- ^ a b Messina, Jane P.; Humphreys, Isla; Flaxman, Abraham; Brown, Anthony; Cooke, Graham S.; Pybus, Oliver G.; Barnes, Eleanor (tháng 1 năm 2015). “Global distribution and prevalence of hepatitis C virus genotypes”. Hepatology. 61 (1): 77–87. doi:10.1002/hep.27259. ISSN 1527-3350. PMC 4303918. PMID 25069599.
- ^ a b c “US Label” (PDF). FDA. tháng 6 năm 2016. Lưu trữ (PDF) bản gốc ngày 5 tháng 2 năm 2017.. See FDA index page for NDA 205834 .
- ^ “Sofosbuvir/ledipasvir effective for relapsed hep C patients”. Family Practice News. Bản gốc lưu trữ ngày 1 tháng 5 năm 2020. Truy cập ngày 16 tháng 6 năm 2019.
- ^ Canadian Agency for Drugs and Technologies in Health (ngày 16 tháng 1 năm 2015). “Holkira (Ombitasvir/Paritaprevir/ Ritonavir with Dasabuvir) and Harvoni (Ledipasvir/Sofosbuvir) for Chronic Hepatitis C: A Review of the Clinical Evidence”. Rapid Response Service. Canadian Agency for Drugs and Technologies in Health. PMID 25674658. Lưu trữ bản gốc ngày 5 tháng 11 năm 2017.
- ^ Issur, Moheshwarnath; Götte, Matthias (ngày 6 tháng 11 năm 2014). “Resistance patterns associated with HCV NS5A inhibitors provide limited insight into drug binding”. Viruses. 6 (11): 4227–4241. doi:10.3390/v6114227. ISSN 1999-4915. PMC 4246218. PMID 25384189.
- ^ a b c d e f Gritsenko, Diana; Hughes, Gregory (tháng 4 năm 2015). “Ledipasvir/Sofosbuvir (Harvoni): Improving Options for Hepatitis C Virus Infection”. Pharmacy and Therapeutics. 40 (4): 256–276. ISSN 1052-1372. PMC 4378517. PMID 25859119.
- ^ Gao, Min (tháng 10 năm 2013). “Antiviral activity and resistance of HCV NS5A replication complex inhibitors”. Current Opinion in Virology. 3 (5): 514–520. doi:10.1016/j.coviro.2013.06.014. ISSN 1879-6265. PMID 23896281.
- ^ a b c d e f “HARVONI (ledipasvir and sofosbuvir)” (PDF). Truy cập ngày 22 tháng 2 năm 2018.
- ^ Vermehren, Johannes; Sarrazin, Christoph (tháng 8 năm 2012). “The role of resistance in HCV treatment”. Best Practice & Research. Clinical Gastroenterology. 26 (4): 487–503. doi:10.1016/j.bpg.2012.09.011. ISSN 1532-1916. PMID 23199507.
- ^ “harvoni_pi.pdf” (PDF). Truy cập ngày 21 tháng 2 năm 2018.
- ^ a b “Harvoni 90 mg/400 mg film-coated tablets - Summary of Product Characteristics” (bằng tiếng Anh). UK Electronic Medicines Compendium. tháng 12 năm 2016. Lưu trữ bản gốc ngày 27 tháng 10 năm 2016. Truy cập ngày 4 tháng 2 năm 2017.
- ^ “Drug Interactions Between Direct-Acting anti-HCV Antivirals Sofosbuvir and Ledipasvir and HIV Antiretrovirals”. www.natap.org. Truy cập ngày 22 tháng 2 năm 2018.
- ^ “Impact of Food and Antacids on Levels of Ledipasvir and Sofosbuvir”. www.natap.org. Truy cập ngày 22 tháng 2 năm 2018.
