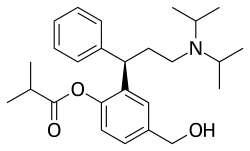
Fesoterodine
 | |
 | |
| Dữ liệu lâm sàng | |
|---|---|
| Tên thương mại | Toviaz |
| AHFS/Drugs.com | Chuyên khảo |
| MedlinePlus | a609021 |
| Giấy phép |
|
| Danh mục cho thai kỳ |
|
| Dược đồ sử dụng | Oral |
| Mã ATC | |
| Tình trạng pháp lý | |
| Tình trạng pháp lý |
|
| Dữ liệu dược động học | |
| Sinh khả dụng | 52% (active metabolite) |
| Liên kết protein huyết tương | 50% (active metabolite) |
| Chuyển hóa dược phẩm | Hepatic (CYP2D6- and 3A4-mediated) |
| Chu kỳ bán rã sinh học | 7–8 hours (active metabolite) |
| Bài tiết | Renal (70%) and fecal (7%) |
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| Định danh thành phần duy nhất | |
| KEGG | |
| ChEMBL | |
| ECHA InfoCard | 100.184.854 |
| Dữ liệu hóa lý | |
| Công thức hóa học | C26H37NO3 |
| Khối lượng phân tử | 411.278 g/mol |
| Mẫu 3D (Jmol) | |
SMILES
| |
Định danh hóa học quốc tế
| |
| (kiểm chứng) | |
Fesoterodine (INN, sử dụng như là fumarate dưới tên thương hiệu Toviaz) là một thuốc antimuscarinic được phát triển bởi Schwarz Pharma AG để điều trị hội chứng bàng quang hoạt động quá mức (OAB).[1] Nó đã được Cơ quan Dược phẩm Châu Âu phê duyệt vào tháng 4 năm 2007,[2] Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ vào ngày 31 tháng 10 năm 2008 [3] và Bộ Y tế Canada vào ngày 9 tháng 2 năm 2012.[4]
Fesoterodine là một tiền chất. Nó được chia thành các hoạt động chuyển hóa, nó desfesoterodine, bởi plasma esteraza.
Hiệu quả[sửa | sửa mã nguồn]
Fesoterodine có ưu điểm là cho phép dùng liều linh hoạt hơn các thuốc đối vận muscarinic khác.[5] Khả năng dung nạp và tác dụng phụ của nó tương tự như các thuốc đối kháng muscarinic khác và vì một loại thuốc mới dường như không thể tạo ra những thay đổi lớn trong thực hành điều trị cho bàng quang hoạt động quá mức.
Một nghiên cứu của Nhật Bản từ năm 2017 cho thấy sự khẩn cấp và thôi thúc được cải thiện sau 3 ngày dùng thuốc, với hiệu quả đầy đủ có thể được đánh giá sau 7 ngày dùng thuốc. Bàng quang hoạt động quá mức đã được tìm thấy sẽ được giải quyết ở 88% bệnh nhân sau 7 ngày sử dụng.[6]
Tham khảo[sửa | sửa mã nguồn]
- ^ “Fesoterodine, New Drug Candidate For Treatment For Overactive Bladder – Pfizer To Acquire Exclusive Worldwide Rights”. Medical News Today. ngày 17 tháng 4 năm 2006. Bản gốc lưu trữ ngày 16 tháng 5 năm 2011. Truy cập ngày 14 tháng 9 năm 2019.
- ^ “Toviaz: European Public Assessment Report, Revision 3 - Published 02/06/08”. European Medicines Agency. ngày 2 tháng 6 năm 2008. Bản gốc lưu trữ ngày 1 tháng 4 năm 2008.
- ^ “Pfizer's Toviaz (fesoterodine fumarate) Receives FDA Approval for the Treatment of Overactive Bladder” (Thông cáo báo chí). Pfizer Inc. ngày 31 tháng 10 năm 2008. Truy cập ngày 6 tháng 11 năm 2008.
- ^ “Notice of Decision for TOVIAZ”. Bản gốc lưu trữ ngày 23 tháng 4 năm 2012. Truy cập ngày 14 tháng 9 năm 2019.
- ^ Vella, M.; Cardozo, L. (2011). “Review of fesoterodine”. Expert Opinion on Drug Safety. 10 (5): 805–808. doi:10.1517/14740338.2011.591377. PMID 21639817.
- ^ "Sato, N.; Fuji, K.; Ogawa, Y. (2017). “Transactions of The Showa University Society: The 335th Meeting”. The Showa University Journal of Medical Sciences. 29 (2): 201–217. doi:10.15369/sujms.29.201. ISSN 2185-0968.
