Tautome keto–enol
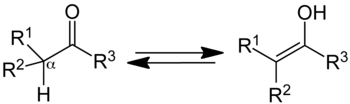
Keto form (left); enol form (right).
Trong hóa học hữu cơ, tautome keto-enol đề cập đến trạng thái cân bằng hóa học giữa dạng keto (ketone hoặc aldehyd) và enol (rượu). Các hình thức enol và keto được cho là tautome của nhau. Sự giao thoa của hai dạng liên quan đến sự chuyển động của một nguyên tử alpha hydro và sự sắp xếp lại các electron liên kết; do đó, đồng phân đủ điều kiện là tautome.
Một hợp chất chứa một nhóm carbonyl (C = O) thường ở trạng thái cân bằng nhanh với một tautome enol, chứa một cặp nguyên tử carbon liên kết đôi nằm cạnh nhóm hydroxyl (−OH), C = C - OH. Dạng keto chiếm ưu thế ở trạng thái cân bằng cho hầu hết các ketone. Tuy nhiên, dạng enol rất quan trọng đối với một số phản ứng. Chất trung gian khử liên kết trong sự xen kẽ của hai dạng, được gọi là anion enolate, rất quan trọng trong hóa học carbonyl, phần lớn vì nó là một nucleophile mạnh.
Thông thường, trạng thái cân bằng hóa học tautome hóa keto hung được điều khiển nhiệt động lực học cao, và ở nhiệt độ phòng, trạng thái cân bằng rất ủng hộ sự hình thành dạng keto. Một ví dụ kinh điển để ủng hộ dạng keto có thể được nhìn thấy ở trạng thái cân bằng giữa rượu vinyl và acetaldehyd (K = [enol] / [keto] 3 × 10−7). Tuy nhiên, theo báo cáo, trong trường hợp rượu vinyl, sự hình thành dạng enol ổn định có thể được thực hiện bằng cách kiểm soát nồng độ nước trong hệ thống và sử dụng sự thuận lợi động học của hiệu ứng đồng vị động học tạo ra deuterium (kH+/kD+ = 4.75, kH2O/kD2O = 12). Ổn định đơteri có thể được thực hiện thông qua quá trình thủy phân tiền chất ketene khi có sự dư thừa cân bằng hóa học của nước nặng (D 2 O). Các nghiên cứu cho thấy quá trình tautome hóa bị ức chế đáng kể ở nhiệt độ môi trường (kt ≈ 10−6 M/s), và thời gian bán hủy của dạng enol có thể dễ dàng tăng lên t1 / 2 = 42 phút đối với động học thủy phân bậc 1.[1]
Cơ chế[sửa | sửa mã nguồn]
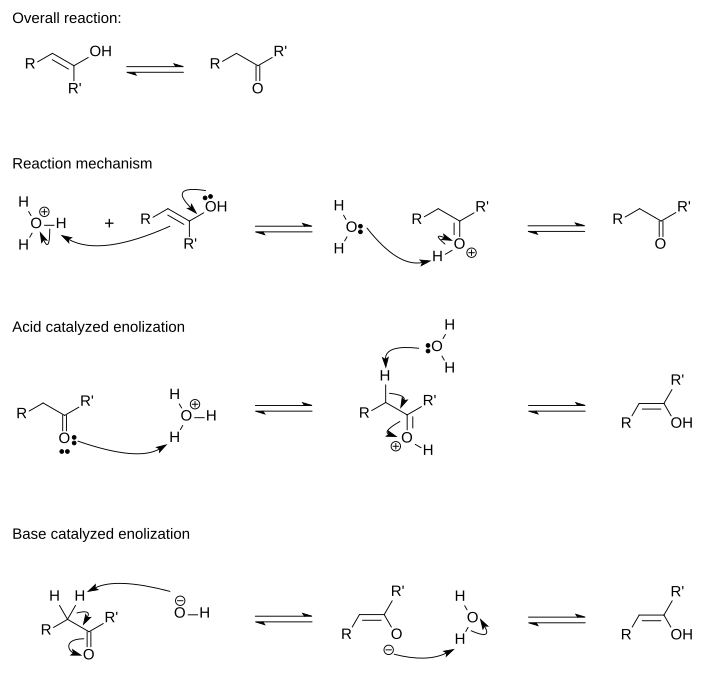
Axit xúc tác chuyển đổi enol thành dạng keto tiến hành theo hai bước cơ chế trong một dung dịch nước axit. Đối với điều này, điều cần thiết là nguyên tử alpha carbon (nguyên tử carbon gần nhóm chức năng nhất) có chứa ít nhất một nguyên tử hydro được gọi là nguyên tử hydro alpha. Nguyên tử alpha hydro này cũng phải được định vị sao cho nó có thể xếp hàng song song với quỹ đạo chống tăng của nhóm carbonyl. Hyperconjugation của liên kết này với liên kết C C H ở nguyên tử alpha carbon làm giảm mật độ electron của liên kết C phỏng H và làm suy yếu nó, làm cho nguyên tử hydro hydro có tính axit cao hơn. Khi nguyên tử alpha hydro không được liên kết với quỹ đạo pi, ví dụ như trong adamantanone hoặc các ketone đa vòng khác, quá trình enol hóa là không thể hoặc rất chậm.[2][3]
Trong bước đầu tiên của cơ chế, các electron tiếp xúc của liên kết đôi C = C của enol được tặng cho một ion hydronium (H3O+). Sự bổ sung này tuân theo quy tắc của Markovnikov, do đó, proton được thêm vào nguyên tử carbon với các nguyên tử hydro được gắn nhiều hơn. Đây là một bước phối hợp với nguyên tử oxy
trong nhóm hydroxyl tặng electron để tạo ra nhóm carbonyl cuối cùng.
Tham khảo[sửa | sửa mã nguồn]
- ^ Investigations into the Chemistry of Thermodynamically Unstable Species. The Direct Polymerization of Vinyl Alcohol, the Enolic Tautomer of Acetaldehyde. Anna K. Cederstav and Bruce M. Novak. Journal of the American Chemical Society, 1994, Volume 116, Pages 4073–74. [1]
- ^ Norlander, J.E.; Jindal, S.; Kitko, D. (1969). “Resistance of adamantanone to homoenolization”. Journal of the Chemical Society, Chemical Communications: 1136–1137. doi:10.1039/C29690001136.
- ^ Stothers, J.B.; Tan, C.T. (1974). “Adamantanone: stereochemistry of its homoenolization as shown by 2H nuclear magnetic resonance”. Journal of the Chemical Society, Chemical Communications (18): 378–379. doi:10.1039/C39740000738.
