Acid magic
| Acid magic | |
|---|---|
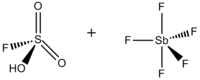 | |
 | |
| Danh pháp IUPAC | Acid sulfurofluoridic — pentafluorostiboran (1:1) |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| Thuộc tính | |
| Công thức phân tử | HSbF6SO3 |
| Khối lượng mol | 316,82 g/mol |
| Bề ngoài | Lỏng |
| Điểm nóng chảy | |
| Điểm sôi | |
| Các nguy hiểm | |
| Nguy hiểm chính | Ăn mòn mạnh, độc hại, thủy phân mạnh, oxy hóa. |
| NFPA 704 |
|
| Ký hiệu GHS |       |
| Báo hiệu GHS | DANGER |
| Chỉ dẫn nguy hiểm GHS | H240, H271, H290, H302, H314, H335, H350, H402, H410, H411, H441 |
| Chỉ dẫn phòng ngừa GHS | P234, P261, P264, P270, P271, P273, P280, P284, P301+P310, P301+P330+P331, P303+P361+P353, P304+P340+P310, P305+P351+P338+P310, P363, P390, P403+P233, P405, P501 |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Acid magic (FSO3H·SbF5) là một siêu acid bao gồm hỗn hợp, phổ biến nhất là theo tỷ lệ mol 1:1, của acid fluorosulfuric (HSO3F) và antimon pentafluoride (SbF5).[1] Hệ siêu acid kết hợp Brønsted–Lewis này được phát triển vào những năm 1960 bởi phòng thí nghiệm George Olah tại Đại học Case Western Reserve, và đã được sử dụng để ổn định các carbocation và các ion carboni siêu phối hợp trong môi trường chất lỏng. Acid magic và các siêu acid khác cũng được sử dụng để xúc tác quá trình đồng phân hóa của hydrocarbon bão hòa, và đã được chứng minh là có khả năng proton hóa ngay cả các base yếu, bao gồm methan, xenon, halogen và hydro phân tử.[2]
Lịch sử[sửa | sửa mã nguồn]
Thuật ngữ "siêu acid" được sử dụng lần đầu tiên vào năm 1927 khi James Bryant Conant phát hiện ra rằng acid perchloric có thể proton hóa keton và aldehyde để tạo thành muối trong dung dịch không chứa nước.[2] Bản thân thuật ngữ này được Ronald Gillespie đặt ra sau đó, sau khi Conant kết hợp acid sulfuric với acid fluorosulfuric, và tìm ra dung dịch có tính acid cao hơn vài triệu lần so với chỉ riêng acid sulfuric.[3] Gillespie cũng sử dụng hệ acid để tạo ra các cation vô cơ.
Hệ acid magic được phát triển vào những năm 1960 bởi George Andrew Olah và được sử dụng để nghiên cứu các carbocation ổn định. Tên của acid magic bắt nguồn từ một bữa tiệc Giáng Sinh năm 1966, khi một thành viên của phòng thí nghiệm Olah đặt một cây nến parafin vào acid và nhận thấy rằng nó hòa tan khá nhanh. Kiểm tra dung dịch với 1H-NMR cho thấy một cation tert-butyl, điều đó cho thấy chuỗi parafin tạo thành sáp đã bị tách ra, sau đó được đồng phân hóa thành carbocation bậc ba (tertiary carbocation) tương đối ổn định.[4] Cái tên này sau đó xuất hiện trong một bài báo do phòng thí nghiệm Olah xuất bản.
Tham khảo[sửa | sửa mã nguồn]
- ^ George A. Olah, Schlosberg RH (1968). “Chemistry in Super Acids. I. Hydrogen Exchange and Polycondensation of Methane and Alkanes in FSO3H–SbF5 ("Magic Acid") Solution. Protonation of Alkanes and the Intermediacy of CH5+ and Related Hydrocarbon Ions. The High Chemical Reactivity of "Paraffins" in Ionic Solution Reactions”. Journal of the American Chemical Society. 90 (10): 2726–7. doi:10.1021/ja01012a066.
- ^ a b Olah, G. A. (2005). “Crossing Conventional Boundaries in Half a Century of Research”. Journal of Organic Chemistry. 70 (7): 2413–2429. doi:10.1021/jo040285o. PMID 15787527.
- ^ Lesney, M. S. (tháng 3 năm 2003). “A Basic History of Acid—From Aristotle to Arnold” (PDF). Today's Chemist at Work: 47–48.
- ^ Olah, G. A.; Prakash, S.; Molnar, A.; Sommer, J. (2009). Superacid Chemistry (ấn bản 2). New York: John Wiley and Sons. tr. 49. ISBN 978-0-471-59668-4.

