Cadmi(II) hydroxide
| Cadmi(II) hydroxide | |
|---|---|
 Mẫu cadmi(II) hydroxide | |
 | |
| Danh pháp IUPAC | Cadmi(II) hydroxide |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| ChemSpider | |
| Thuộc tính | |
| Công thức phân tử | Cd(OH)2 |
| Khối lượng mol | 146,42568 g/mol |
| Bề ngoài | tinh thể trắng |
| Khối lượng riêng | 4,79 g/cm³ |
| Điểm nóng chảy | 130 °C (403 K; 266 °F) |
| Điểm sôi | 300 °C (573 K; 572 °F) (phân hủy) |
| Độ hòa tan trong nước | 26 mg/100 mL |
| Độ hòa tan | hòa tan trong acid loãng |
| MagSus | -41,0·10−6 cm³/mol |
| Cấu trúc | |
| Cấu trúc tinh thể | hexagonal |
| Nhiệt hóa học | |
| Enthalpy hình thành ΔfH | −561 kJ·mol−1[1] |
| Entropy mol tiêu chuẩn S | 96 J·mol−1·K−1[1] |
| Các nguy hiểm | |
| PEL | [1910.1027] TWA 0.005 mg/m³ (như Cd)[2] |
| REL | Ca[2] |
| IDLH | Ca [9 mg/m³ (như Cd)][2] |
| Các hợp chất liên quan | |
| Anion khác | Cadmi(II) chloride, Cadmi(II) iodide |
| Cation khác | Kẽm(II) hydroxide, Calci hydroxide, Magnesi hydroxide |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Cadmi(II) hydroxide là một hợp chất vô cơ có công thức hóa học Cd(OH)2. Đây là một hợp chất có tinh thể trắng, là thành phần chính của pin Ni–Cd.[3]
Cấu trúc, điều chế và phản ứng[sửa | sửa mã nguồn]
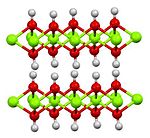
Cadmi(II) hydroxide có cấu trúc giống như Mg(OH)2, bao gồm các tấm kim loại hình bát diện được bao quanh bởi các hình khối bát diện của các phối tử hydroxide.[4]
Nó được sản xuất bằng cách xử lý cadmi(II) nitrat với natri hydroxide:
- Cd(NO3)2 + 2NaOH → Cd(OH)2↓ + 2NaNO3
Việc điều chế từ muối cadmi khác phức tạp hơn.[3]
Cd(OH)2 và CdO tương đương nhau. Cadmi(II) hydroxide là hydroxide cơ bản hơn kẽm(II) hydroxide. Nó tạo thành phức anionic Cd(OH)2−
4 khi xử lý với dung dịch soda ăn da. Nó tạo thành các phức hợp với ion cyanide, thiocyanat và amoni khi thêm vào các dung dịch của các ion này. Cadmi(II) hydroxide phân hủy khi bị nung, tạo ra cadmi(II) oxide. Sự phân hủy bắt đầu ở 130 ℃ và kết thúc ở 300 ℃. Phản ứng với acid khoáng (HX) tạo ra muối cadmi(II) tương ứng (CdX2). Với acid hydrochloric, acid sulfuric và acid nitric, các sản phẩm này là cadmi(II) chloride, cadmi(II) sulfat và cadmi(II) nitrat.
Ứng dụng[sửa | sửa mã nguồn]
Nó được dùng để sản xuất trong ắc quy lưu trữ, trong pin nickel-cadmi và bạc-cadmi trong khi xả:
Tham khảo[sửa | sửa mã nguồn]
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. tr. A21. ISBN 0-618-94690-X.
- ^ a b c “NIOSH Pocket Guide to Chemical Hazards #0087”. Viện An toàn và Sức khỏe Nghề nghiệp Quốc gia Hoa Kỳ (NIOSH).
- ^ a b Karl-Heinz Schulte-Schrepping, Magnus Piscator "Cadmium and Cadmium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2007 Wiley-VCH, Weinheim. doi:10.1002/14356007.a04_499.
- ^ Hemmingsen, L.; Bauer, R.; Bjerrum, M. J.; Schwarz, K.; Blaha, P.; Andersen, P., "Structure, Chemical Bonding, and Nuclear Quadrupole Interactions of β-Cd(OH)2: Experiment and First Principles Calculations", Inorganic Chemistry 1999, volume 38, 2860-2867. doi:10.1021/ic990018e
