Thù hình của phosphor

Phosphor đơn chất có thể tồn tại trong một số dạng thù hình, phổ biến nhất trong số đó là phosphor trắng và đỏ. Phosphor tím và đen cũng được biết đến. Phosphor khí tồn tại như diphosphor và phosphor nguyên tử.

Phosphor trắng[sửa | sửa mã nguồn]

Phosphor trắng, phosphor vàng hoặc đơn giản là tetraphosphor (P4) tồn tại dưới dạng các phân tử được tạo thành từ bốn nguyên tử trong cấu trúc tứ diện. Sự sắp xếp tứ diện dẫn đến sự căng vòng và mất ổn định. Phân tử được mô tả là bao gồm sáu liên kết P-P đơn. Hai dạng tinh thể khác nhau được biết đến. Dạng α được định nghĩa là điều kiện tiêu chuẩn của phần tử, nhưng thực sự có thể biến đổi ở điều kiện tiêu chuẩn.[1] Nó có cấu trúc tinh thể lập phương tập trung vào tâm và biến đổi ngược lại thành dạng β ở 195.2 K. Dạng β được cho là có cấu trúc tinh thể hình lục giác.[2]
Phosphor trắng là một loại sáp rắn trong suốt nhanh chóng chuyển sang màu vàng khi tiếp xúc với ánh sáng. Vì lý do này, nó còn được gọi là phosphor vàng. Nó phát sáng màu xanh lục trong bóng tối (khi tiếp xúc với oxy) và rất dễ cháy khi tiếp xúc với không khí. Nó độc hại, gây tổn thương gan nghiêm trọng khi ăn và quai hàm do nuốt phải hoặc hít phải. Mùi cháy của phosphor vàng này có mùi tỏi đặc trưng và các mẫu thường được phủ bằng phosphor pentoxide màu trắng, bao gồm tứ diện P4O10 với oxy được chèn giữa các nguyên tử phosphor và ở các đỉnh của chúng. Phosphor trắng tan ít trong nước và có thể được cất ở dưới nước. Thật vậy, phosphor trắng chỉ tự cháy an toàn khi chìm trong nước. Nó hòa tan trong benzen, dầu, cacbon disulfua và disulfua dichlorid.
Sản xuất và ứng dụng[sửa | sửa mã nguồn]
Phosphor trắng có thể được sản xuất bằng nhiều phương pháp khác nhau. Trong quy trình công nghiệp, đá phosphat được nung nóng trong lò đốt bằng điện hoặc nhiên liệu với sự có mặt của cacbon và silic dioxide.[3] Phosphor đơn chất sau đó được giải phóng dưới dạng hơi và có thể được thu thập dưới acid phótphoric. Một phương trình lý tưởng hóa cho phản ứng nhiệt hóa này được hiển thị cho calci phosphat (mặc dù đá phosphat chứa một lượng lớn fluoroapatite):
- 2 Ca3(PO4)2 + 6 SiO2 + 10 C → 6 CaSiO3 + 10 CO + P4

Phosphor trắng có áp suất hơi đáng kể ở nhiệt độ thường. Khối lượng riêng hơi cho thấy hơi bao gồm các phân tử P4 có nhiệt độ lên tới khoảng 800 °C. Ở nhiệt độ đó, sự phân ly thành các phân tử P2 xảy ra.
Nó tự bốc cháy trong không khí ở khoảng 50 °C (122 °F) và ở nhiệt độ thấp hơn nếu được chia nhỏ. Quá trình đốt cháy này mang lại oxide phosphor (V):
- P
4 + 5 O
2 → P
4O
10
Vì tính chất này, phosphor trắng được sử dụng làm vũ khí.
Sự tồn tại của P8[sửa | sửa mã nguồn]
Mặc dù phosphor trắng chuyển thành phosphor đỏ ổn định nhiệt động hơn, sự hình thành của phân tử P8 khối không được quan sát thấy trong pha ngưng tụ. Các chất tương tự của phân tử giả thuyết này đã được điều chế từ phosphaalkynes.[4]
Phosphor đỏ[sửa | sửa mã nguồn]


Phosphor đỏ có thể được hình thành bằng cách đốt nóng phosphor trắng đến 300 °C (572 °F) khi không có không khí hoặc bằng cách phơi phosphor trắng với ánh sáng mặt trời. Phosphor đỏ tồn tại như một chất rắn vô định hình. Khi đun nóng hơn, phosphor đỏ rắn vô định hình kết tinh. phótpho đỏ không bốc cháy trong không khí ở nhiệt độ dưới 240 °C (464 °F), trong khi các mảnh phosphor trắng bốc cháy ở khoảng 30 °C (86 °F). Phosphor đỏ tự phát cháy ở nhiệt độ phòng với vật liệu được chia nhỏ.
Trong điều kiện tiêu chuẩn, nó ổn định hơn phosphor trắng, nhưng kém bền hơn phosphor đen ổn định nhiệt động. Entanpi tiêu chuẩn của sự hình thành phosphor đỏ là -17,6 kJ / mol.[1] phótpho đỏ ổn định nhất về mặt động học.
Các ứng dụng[sửa | sửa mã nguồn]
Phosphor đỏ có thể được sử dụng như một chất chống cháy rất hiệu quả, đặc biệt là trong nhựa nhiệt dẻo (ví dụ polyamit) và nhựa nhiệt rắn (ví dụ như nhựa epoxy hoặc polyurethan). Hiệu ứng làm chậm ngọn lửa dựa trên sự hình thành acid polyphosphoric. Cùng với vật liệu polymer hữu cơ, acid này tạo ra than ngăn cản sự lan truyền của ngọn lửa. Các rủi ro an toàn liên quan đến việc tạo ra phốtphin và độ nhạy ma sát của phosphor đỏ có thể được giảm một cách hiệu quả bằng cách ổn định và đóng gói vi mô. Để xử lý dễ dàng hơn, phosphor đỏ thường được sử dụng dưới dạng phân tán hoặc masterbatch trong các hệ thống chất mang khác nhau. Tuy nhiên, đối với các hệ thống điện tử / điện, chất chống cháy. Phosphor đỏ đã bị cấm Lưu trữ 2018-01-02 tại Wayback Machine bởi các OEM lớn do xu hướng sớm gây ra các hỏng hóc. Có hai vấn đề trong những năm qua: thứ nhất là phosphor đỏ trong các hợp chất đúc epoxy tạo ra dòng rò cao trong các thiết bị bán dẫn [5] và thứ hai là gia tốc các phản ứng thủy phân trong vật liệu cách điện PBT.[6]
Phosphor đỏ cũng có thể được sử dụng trong sản xuất ma túy bất hợp pháp, bao gồm một số công thức cho ma túy đá..
Phosphor đỏ có thể được sử dụng làm chất xúc tác quang nguyên tố để hình thành hydro từ nước [7]. Chúng hiển thị tốc độ tiến hóa hydro ổn định 633ℳmol / (h • g) bằng cách hình thành phosphor sợi kích thước nhỏ [8].
Phosphor tím của Hittorf[sửa | sửa mã nguồn]



Phosphor monoclinic, hay phosphor tím, còn được gọi là phosphor kim loại của Hittorf.[9][10] Năm 1865, Johann Wilhelm Hittorf đun nóng phosphor đỏ trong một ống kín ở 530 °C. Phần trên của ống được giữ ở mức 444 °C. Kết quả là hệ tinh thể đơn nghiêng mờ đục, hoặc hình thoi, kết tinh thăng hoa như là kết quả. Phosphor tím cũng có thể được điều chế bằng cách hòa tan phosphor trắng trong chì nóng chảy trong một ống kín ở 500 °C trong 18 giờ. Khi làm lạnh chậm, thù hình của Hittorf kết tinh. Các tinh thể có thể được tạo ra bằng cách hòa tan chì trong acid nitric loãng sau đó đun sôi trong acid clohydric đậm đặc.[11] Ngoài ra, một dạng sợi tồn tại với các lồng phosphor tương tự.
Phản ứng của phosphor tím[sửa | sửa mã nguồn]
Nó không bốc cháy trong không khí cho đến khi nóng lên 300 °C và không hòa tan trong tất cả các dung môi. Nó không phản ứng với kiềm và chỉ phản ứng chậm với các halogen. Nó có thể bị oxy hóa bởi acid nitric thành acid phosphorric.
Nếu nó được nung nóng trong bầu khí quyển của khí trơ, ví dụ như nitơ hoặc cacbon dioxide, nó sẽ thăng hoa và hơi ngưng tụ dưới dạng phosphor trắng. Nếu nó được nung nóng trong chân không và hơi nước ngưng tụ nhanh, thu được phótpho tím. Dường như phosphor tím là một polymer có khối lượng phân tử tương đối cao, khi đun nóng phân hủy thành các phân tử P2. Khi làm mát, chúng thường thu nhỏ lại để tạo ra các phân tử P4 (tức là phosphor trắng), nhưng trong chân không, chúng liên kết lại với nhau để tạo thành thù hình polymer tím.
Phosphor đen[sửa | sửa mã nguồn]


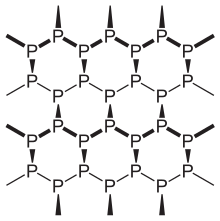
Phosphor đen là dạng phosphor ổn định nhiệt động ở nhiệt độ và áp suất phòng, với nhiệt hình thành -39,3 kJ / mol (so với phosphor trắng được định nghĩa là trạng thái tiêu chuẩn).[1] Nó thu được bằng cách nung nóng phosphor trắng dưới áp suất cao (12.000 atm). Về ngoại hình, tính chất và cấu trúc, phosphor đen rất giống than chì với cả hai màu đen và dễ bong, một chất dẫn điện và có các tấm nguyên tử liên kết với nhau.[12] Phonon, photon và electron trong cấu trúc phótpho đen phân lớp hoạt động theo phương pháp dị hướng cao trong mặt phẳng của các lớp, thể hiện tiềm năng mạnh mẽ cho các ứng dụng cho điện tử màng mỏng và quang điện tử hồng ngoại.[13]
phótpho đen có cấu trúc hệ tinh thể trực thoi và là loại đồng vị ít phản ứng nhất, là kết quả của mạng các vòng sáu thành viên liên kết với nhau, trong đó mỗi nguyên tử được liên kết với ba nguyên tử khác.[14][15] phótpho đen và đỏ cũng có thể có cấu trúc mạng tinh thể lập phương.[16] Sự tổng hợp áp suất cao đầu tiên của tinh thể phosphor đen được thực hiện bởi nhà vật lý Percy Williams Bridgman vào năm 1914.[17] Một tổng hợp gần đây của phosphor đen sử dụng muối kim loại làm chất xúc tác đã được báo cáo.[18]
Phosphor đen[sửa | sửa mã nguồn]
Những điểm tương đồng với than chì cũng bao gồm khả năng phân tách băng dính (tẩy da chết), dẫn đến phosphorene, một vật liệu 2D giống như graphen với tính chất truyền nhiệt và điện tích tuyệt vời. Độ dẫn nhiệt bất đẳng hướng cao đã được đo lường theo ba hướng tinh thể chính.[19][20] Sublime đen tẩy tế bào chết ở 400 °C trong chân không.[21] Nó dần dần bị oxy hóa khi tiếp xúc với nước với sự hiện diện của oxy, đó là một mối quan tâm khi xem nó như một vật liệu để sản xuất bóng bán dẫn, ví dụ.[22][23]
Phosphor xanh[sửa | sửa mã nguồn]
Phosphor xanh một lớp được sản xuất lần đầu tiên vào năm 2016 bằng phương pháp epitaxy chùm phân tử từ phosphor đen làm tiền chất.[24]
Diphosphor[sửa | sửa mã nguồn]


Thù hình diphosphor (P2) thường có thể thu được chỉ dưới điều kiện khắc nghiệt (ví dụ, nung nóng P4 gần 827 ⁰C). Năm 2006, phân tử diatomic được tạo ra trong dung dịch đồng nhất trong điều kiện bình thường với việc sử dụng các phức kim loại chuyển tiếp (ví dụ, wolfram và niobi).[25]
Diphosphor là dạng phosphor dạng khí và dạng ổn định nhiệt động giữa 1200 °C và 2000 °C. Sự phân ly của tetraphosphor(P
4) bắt đầu ở nhiệt độ thấp hơn: phần trăm của P
2 lúc 800 °C là ≈ 1%. Ở nhiệt độ trên 2000 °C, phân tử lưỡng cực bắt đầu phân ly thành phosphor nguyên tử.
Phosphor nano[sửa | sửa mã nguồn]
Polyme nano P12 được phân lập từ các phức CuI-P bằng cách xử lý nhiệt độ thấp.[26]
Phosphor đỏ / nâu được chứng minh là ổn định trong không khí trong vài tuần và có các tính chất khác biệt đáng kể so với phosphor đỏ. Kính hiển vi điện tử cho thấy phosphor đỏ / nâu tạo thành các nanorod dài, song song có đường kính trong khoảng 3,4 Å đến 4,7.[26]
Tính chất[sửa | sửa mã nguồn]
| Hình thức | trắng (α) | trắng (β) | màu tím | đen |
|---|---|---|---|---|
| Đối xứng | Khối cơ thể tập trung | Triclinic | Monoclinic | Chỉnh hình |
| Biểu tượng Pearson | aP24 | mP84 | oS8 | |
| Nhóm không gian | Tôi 4 m | P 1 số 2 | P2 / c số 13 | Cmca số 64 |
| Mật độ (g / cm 3) | 1.828 | 1,88 | 2,36 | 2,69 |
| Bandgap (eV) | 2.1 | 1,5 | 0,34 | |
| Chỉ số khúc xạ | 1.8244 | 2.6 | 2.4 |
Xem thêm[sửa | sửa mã nguồn]
- Hàm hóa thạch
Tham khảo[sửa | sửa mã nguồn]
- ^ a b c Housecroft, C. E.; Sharpe, A. G. (2004). Inorganic Chemistry (ấn bản 2). Prentice Hall. tr. 392. ISBN 978-0130399137.
- ^ Durif, M.-T. Averbuch-Pouchot; A. (1996). Topics in phosphate chemistry. Singapore [u.a.]: World Scientific. tr. 3. ISBN 978-981-02-2634-3.
- ^ Threlfall, R.E., (1951). 100 years of Phosphorus Making: 1851–1951. Oldbury: Albright and Wilson Ltd
- ^ Streubel, Rainer (1995). “Phosphaalkyne Cyclooligomers: From Dimers to Hexamers—First Steps on the Way to Phosphorus–Carbon Cage Compounds”. Angewandte Chemie International Edition in English. 34 (4): 436–438. doi:10.1002/anie.199504361.
- ^ Craig Hillman, Red Phosphorus Induced Failures in Encapsulated Circuits, https://www.dfrsolutions.com/hubfs/Resources/services/Red-Phosphorus-Induced-Failures-in-Encapsulated-Circuits.pdf?t=1513022462214
- ^ Dock Brown, The Return of the Red Retardant, SMTAI 2015, https://www.dfrsolutions.com/hubfs/Resources/services/The-Return-of-the-Red-Retardant.pdf?t=1513022462214
- ^ Applied Catalysis B: Environmental, 2012, 111-112, 409-414.
- ^ Angewandte Chemie International Edition, 2016, 55, 9580-9585.
- ^ Curry, Roger (ngày 8 tháng 7 năm 2012). “Hittorf's Metallic Phosphorus of 1865”. LATERAL SCIENCE. Truy cập ngày 16 tháng 11 năm 2014.
- ^ Monoclinic phosphorus formed from vapor in the presence of an alkali metal Bằng sáng chế Hoa Kỳ số 4.620.968
- ^ Hittorf, W. (1865). “Zur Kenntniss des Phosphors”. Annalen der Physik. 202 (10): 193–228. Bibcode:1865AnP...202..193H. doi:10.1002/andp.18652021002.
- ^ Korolkov, Vladimir V.; Timokhin, Ivan G.; Haubrichs, Rolf; Smith, Emily F.; Yang, Lixu; Yang, Sihai; Champness, Neil R.; Schröder, Martin; Beton, Peter H. (ngày 9 tháng 11 năm 2017). “Supramolecular networks stabilise and functionalise black phosphorus”. Nature Communications (bằng tiếng Anh). 8 (1): 1385. Bibcode:2017NatCo...8.1385K. doi:10.1038/s41467-017-01797-6. ISSN 2041-1723. PMC 5680224. PMID 29123112.
- ^ Allain, A.; Kang, J.; Banerjee, K.; Kis, A., Electrical contacts to two-dimensional semiconductors. Nat. Mater. 2015, volume 14, pp. 1195-1205. doi:10.1038/nmat4452
- ^ Brown, A.; Rundqvist, S. (1965). “Refinement of the crystal structure of black phosphorus”. Acta Crystallographica. 19 (4): 684–685. doi:10.1107/S0365110X65004140.
- ^ Cartz, L.; Srinivasa, S. R.; Riedner, R. J.; Jorgensen, J. D.; Worlton, T. G. (1979). “Effect of pressure on bonding in black phosphorus”. The Journal of Chemical Physics. 71 (4): 1718. Bibcode:1979JChPh..71.1718C. doi:10.1063/1.438523.
- ^ Ahuja, Rajeev (2003). “Calculated high pressure crystal structure transformations for phosphorus”. Physica Status Solidi B. 235 (2): 282–287. Bibcode:2003PSSBR.235..282A. doi:10.1002/pssb.200301569.
- ^ Bridgman, P. W. (ngày 1 tháng 7 năm 1914). “TWO NEW MODIFICATIONS OF PHOSPHORUS”. Journal of the American Chemical Society. 36 (7): 1344–1363. doi:10.1021/ja02184a002. ISSN 0002-7863.
- ^ Lange, Stefan; Schmidt, Peer; Nilges, Tom (2007). “Au3SnP7@Black Phosphorus: An Easy Access to Black Phosphorus”. Inorganic Chemistry. 46 (10): 4028–35. doi:10.1021/ic062192q. PMID 17439206.
- ^ Kang, J.; Ke, M.; Hu, Y. (2017). “Ionic Intercalation in Two-Dimensional van der Waals Materials: In Situ Characterization and Electrochemical Control of the Anisotropic Thermal Conductivity of Black Phosphorus”. Nano Letters. 17 (3): 1431–1438. Bibcode:2017NanoL..17.1431K. doi:10.1021/acs.nanolett.6b04385. PMID 28231004.
- ^ Smith, B.; Vermeersch, B.; Carrete, J.; Ou, E.; Kim, J.; Li, S. “Temperature and Thickness Dependences of the Anisotropic In-Plane Thermal Conductivity of Black Phosphorus”. Adv Mater. 29: 1603756.
- ^ Liu, Xiaolong D.; Wood, Joshua D.; Chen, Kan-Sheng; Cho, EunKyung; Hersam, Mark C. (ngày 9 tháng 2 năm 2015). “In Situ Thermal Decomposition of Exfoliated Two-Dimensional Black Phosphorus”. Journal of Physical Chemistry Letters. 6 (5): 773–778. arXiv:1502.02644. doi:10.1021/acs.jpclett.5b00043. PMID 26262651.
- ^ Wood, Joshua D.; Wells, Spencer A.; Jariwala, Deep; Chen, Kan-Sheng; Cho, EunKyung; Sangwan, Vinod K.; Liu, Xiaolong; Lauhon, Lincoln J.; Marks, Tobin J. (ngày 7 tháng 11 năm 2014). “Effective Passivation of Exfoliated Black Phosphorus Transistors against Ambient Degradation”. Nano Letters. 14 (12): 6964–6970. arXiv:1411.2055. Bibcode:2014NanoL..14.6964W. doi:10.1021/nl5032293. PMID 25380142.
- ^ Wu, Ryan J.; Topsakal, Mehmet; Low, Tony; Robbins, Matthew C.; Haratipour, Nazila; Jeong, Jong Seok; Wentzcovitch, Renata M.; Koester, Steven J.; Mkhoyan, K. Andre (ngày 1 tháng 11 năm 2015). “Atomic and electronic structure of exfoliated black phosphorus”. Journal of Vacuum Science & Technology A. 33 (6): 060604. doi:10.1116/1.4926753. ISSN 0734-2101.
- ^ Zhang, Jia Lin; Zhao, Songtao and 10 others (ngày 30 tháng 6 năm 2016). “Epitaxial Growth of Single Layer Blue Phosphorus: A New Phase of Two-Dimensional Phosphorus”. Nano Letters. 16 (8): 4903–4908. Bibcode:2016NanoL..16.4903Z. doi:10.1021/acs.nanolett.6b01459. PMID 27359041.
- ^ Piro, Na; Figueroa, Js; Mckellar, Jt; Cummins, Cc (2006). “Triple-bond reactivity of diphosphorus molecules”. Science. 313 (5791): 1276–9. Bibcode:2006Sci...313.1276P. doi:10.1126/science.1129630. PMID 16946068.
- ^ a b Pfitzner, A; Bräu, Mf; Zweck, J; Brunklaus, G; Eckert, H (tháng 8 năm 2004). “Phosphorus nanorods – two allotropic modifications of a long-known element”. Angewandte Chemie International Edition in English. 43 (32): 4228–31. doi:10.1002/anie.200460244. PMID 15307095.
- ^ A. Holleman; N. Wiberg (1985). “XV 2.1.3”. Lehrbuch der Anorganischen Chemie (ấn bản 33). de Gruyter. ISBN 978-3-11-012641-9.
- ^ Berger, L. I. (1996). Semiconductor materials. CRC Press. tr. 84. ISBN 978-0-8493-8912-2.
Liên kết ngoài[sửa | sửa mã nguồn]
- Phosphor trắng
- Phophorus trắng tại Bảng video định kỳ (Đại học Nottingham)
- Thông tin thêm về phosphor trắng (và phosphor pentoxide) tại Bảng video định kỳ (Đại học Nottingham)
