Khác biệt giữa bản sửa đổi của “Điện thế hoạt động”
←Trang mới: “{{Đang dịch 2|Action potential|en|fr}} Tập tin:Action_Potential.gif|nhỏ| Khi điện thế hoạt động (xung thần kinh) đi xuống một [[Sợi tr…” Thẻ: Trình soạn thảo mã nguồn 2017 |
(Không có sự khác biệt)
|
Phiên bản lúc 07:03, ngày 29 tháng 3 năm 2020
Bài viết này là công việc biên dịch đang được tiến hành từ bài viết Action potential từ tiếng Anh sang tiếng Việt. Bạn có thể giúp Wikipedia bằng cách hỗ trợ dịch và trau chuốt lối hành văn tiếng Việt theo cẩm nang của Wikipedia. |

Trong sinh lý học, điện thế hoạt động xảy ra khi điện thế màng của một vị trí tế bào cụ thể tăng nhanh và giảm: [1] quá trình khử cực này sau đó làm cho các vị trí lân cận khử cực tương tự. Điện thế hoạt động xảy ra ở một số loại tế bào động vật, được gọi là tế bào kích thích, bao gồm neuron, tế bào cơ, tế bào nội tiết, tế bào cuộn mạch và trong một số tế bào thực vật .
Trong neuron, các điện thế hoạt động đóng vai trò trung tâm trong giao tiếp giữa các tế bào bằng cách cung cấp cho giáo dục hoặc liên quan đến dẫn truyền nhảy vọt, hỗ trợ cho việc truyền tín hiệu dọc theo sợi trục thần kinh tới synapse nằm ở hai đầu sợi trục; những tín hiệu này sau đó có thể kết nối với các neuron khác tại synapse, hoặc với các tế bào tuyến hoặc tế abfo vận động. Trong các loại tế bào khác, chức năng chính của chúng là kích hoạt các quá trình nội bào. Trong tế bào cơ, ví dụ, điện thế hoạt động là bước đầu tiên trong chuỗi các sự kiện dẫn đến sự co lại. Trong tế bào beta của tuyến tụy, chúng kích thích giải phóng insulin . [a] Điện thế hoạt động trong các neuron còn được gọi là " xung thần kinh " hoặc " gai " và chuỗi thời gian của các điện thế hoạt động được tạo ra bởi một neuron được gọi là " thời gian điện thế hoạt động ". Một neuron phát ra điện thế hoạt động, hoặc xung thần kinh, thường được gọi là "phóng".
điện thế hoạt động được tạo ra bởi các loại kênh ion điện thế đặc biệt được xuyên trong màng sinh chất của tế bào . [b] Các kênh này bị đóng khi điện thế màng gần điện thế nghỉ (âm) của tế bào, nhưng chúng nhanh chóng mở ra nếu điện thế màng tăng đến điện thế ngưỡng được xác định chính xác, khử cực điện thế màng. Khi kênh mở, chúng cho phép dòng ion natri đi vào bên trong, làm thay đổi độ dốc điện hóa, từ đó tạo ra sự gia tăng hơn nữa trong điện thế màng. Điều này sau đó gây ra nhiều kênh hơn để mở, tạo ra một dòng điện lớn hơn trên màng tế bào và như vậy. Quá trình tiến hành bùng nổ cho đến khi tất cả kênh ion có sẵn được mở, dẫn đến sự tăng vọt lớn trong điện thế màng. Dòng ion natri nhanh chóng làm cho sự phân cực của màng sinh chất đảo ngược và kênh ion sau đó nhanh chóng bất hoạt. Khi kênh natri đóng lại, ion natri không còn có thể xâm nhập vào neuron, và sau đó chúng được vận chuyển tích cực ra khỏi màng sinh chất. Các kênh kali sau đó được kích hoạt và có dòng ion kali đi ra ngoài, đưa độ dốc điện hóa trở về trạng thái nghỉ. Sau khi điện thế hoạt động đã xảy ra, có một sự thay đổi tiêu cực thoáng qua, được gọi là quá trình khử cực .
Trong tế bào động vật, có hai loại điện thế hoạt động chính. Một loại được tạo ra bởi kênh natri điện thế, loại kia là kênh calci điện thế. Điện thế hoạt động dựa trên natri thường kéo dài dưới một phần nghìn giây, nhưng điện thế hoạt động dựa trên calci có thể kéo dài trong 100 mili giây hoặc lâu hơn. [2] Trong một số loại neuron, gai calci chậm cung cấp động lực cho một đợt dài các gai natri phát ra nhanh chóng. Mặt khác, trong tế bào cơ tim, một đột biến natri nhanh ban đầu cung cấp một "mồi" để kích thích sự khởi phát nhanh chóng của một mũi nhọn calci, sau đó tạo ra sự co cơ.
Tổng quat

Gần như tất cả các màng tế bào ở động vật, thực vật và nấm duy trì sự chênh lệch điện thế giữa bên ngoài và bên trong tế bào, được gọi là điện thế màng . Một điện thế điển hình trên màng tế bào động vật là −70 mV. Điều này có nghĩa là bên trong của tế bào có điện thế âm so với bên ngoài. Trong hầu hết các loại tế bào, điện thế màng thường không đổi. Tuy nhiên, một số loại tế bào hoạt động bằng điện theo nghĩa là điện thế của chúng dao động theo thời gian. Trong một số loại tế bào hoạt động bằng điện, bao gồm neuron và tế bào cơ, sự dao động điện thế thường có dạng tăng vọt nhanh chóng sau đó là sự sụt giảm nhanh chóng. Các chu kỳ lên xuống này được gọi là điện thế hoạt động . Trong một số loại neuron, toàn bộ chu kỳ lên xuống diễn ra trong vài phần nghìn giây. Trong tế bào cơ, điện thế hoạt động điển hình kéo dài khoảng một phần năm của một giây. Trong một số loại tế bào khác, và cả ở thực vật, điện thế hoạt động có thể kéo dài ba giây trở lên. [cần dẫn nguồn] [ <span title="This claim needs references to reliable sources. (December 2019)">cần dẫn nguồn</span> ] Các tính chất điện của tế bào được xác định bởi cấu trúc của màng bao quanh nó. Một màng tế bào bao gồm một lớp kép lipid của các phân tử trong đó các phân tử protein lớn hơn được xuyên vào. Lớp kép lipid có khả năng chống chuyển động của ion tích điện cao, do đó nó hoạt động như một chất cách điện. Các protein xuyên màng lớn, ngược lại, cung cấp kênh mà qua đó ion có thể đi qua màng. Điện thế hoạt động được điều khiển bởi các protein kênh có cấu hình chuyển đổi giữa trạng thái đóng và mở như là một hàm của sự chênh lệch điện thế giữa bên trong và bên ngoài của tế bào. Những protein nhạy cảm với điện thế này được gọi là kênh ion điện thế .
Quá trình trong một neuron điển hình

Tất cả tế bào trong các mô cơ thể động vật đều bị phân cực - nói cách khác, chúng duy trì sự chênh lệch điện thế trên màng sinh chất của tế bào, được gọi là điện thế màng . Sự phân cực điện này là kết quả của sự tương tác phức tạp giữa các cấu trúc protein được xuyên trong màng gọi là bơm ion và kênh ion . Trong neuron, các loại kênh ion trong màng thường khác nhau giữa các phần khác nhau của tế bào, tạo ra các sợi nhánh, sợi trục và thân tế bào có các tính chất điện khác nhau. Kết quả là, một số phần của màng neuron có thể dễ bị kích thích (có khả năng tạo ra điện thế hoạt động), trong khi những phần khác thì không. Những nghiên cứu gần đây [cần dẫn nguồn] đã chỉ ra rằng phần dễ bị kích thích nhất của neuron là phần sau sợi trục sợi trục (điểm mà sợi trục rời khỏi thân tế bào), được gọi là đoạn ban đầu, nhưng sợi trục và thân tế bào cũng dễ bị kích thích hầu hết các trường hợp.
Mỗi miếng vá dễ bị kích thích có hai mức điện thế màng quan trọng: điện thế nghỉ, là giá trị mà điện thế màng duy trì miễn là không có gì làm nhiễu tế bào và giá trị cao hơn gọi là điện thế ngưỡng . Ở đỉnh của một neuron điển hình, điện thế nghỉ là khoảng –70 millivolts (mV) và điện thế ngưỡng là khoảng xung –55 mV. Đầu vào synap đến một neuron làm cho màng khử cực hoặc tăng phân cực ; nghĩa là, chúng làm cho điện thế màng tăng hoặc giảm. Điện thế hoạt động được kích hoạt khi đủ khử cực tích lũy để đưa điện thế màng lên đến ngưỡng. Khi điện thế hoạt động được kích hoạt, điện thế màng đột ngột phóng lên trên và sau đó đột ngột phóng ngược xuống dưới, thường kết thúc dưới mức nghỉ, trong một khoảng thời gian. Hình dạng của điện thế hoạt động được rập khuôn; điều này có nghĩa là sự tăng giảm thường có cùng biên độ và thời gian diễn ra cho tất cả các điện thế hoạt động trong một ô đã cho. (Ngoại lệ được thảo luận sau trong bài viết). Trong hầu hết các neuron, toàn bộ quá trình diễn ra trong khoảng một phần nghìn giây. Nhiều loại neuron phát ra điện thế hoạt động liên tục với tốc độ lên tới 10–100 mỗi giây. Tuy nhiên, một số loại yên tĩnh hơn nhiều, và có thể diễn ra trong vài phút hoặc lâu hơn mà không phát ra bất kỳ điện thế hoạt động nào.
Cơ sở sinh lý
điện thế hoạt động là kết quả của sự hiện diện trong màng tế bào của các loại kênh ion điện thế đặc biệt. [3] Kênh ion bị kiểm soát điện thế là một nhóm các protein được xuyên trong màng có ba thuộc tính chính:
- Nó có khả năng giả định nhiều hơn một hình dạng.
- Ít nhất một trong những sự phù hợp tạo ra một kênh thông qua màng có thể thấm qua các loại ion cụ thể.
- Sự chuyển đổi giữa sự phù hợp bị ảnh hưởng bởi điện thế màng.
Do đó, một kênh ion điện thế có xu hướng mở cho một số giá trị của điện thế màng và đóng cho kênh khác. Tuy nhiên, trong hầu hết các trường hợp, mối quan hệ giữa điện thế màng và trạng thái kênh là xác suất và liên quan đến thời gian trễ. Các kênh ion chuyển đổi giữa sự phù hợp tại thời điểm không thể đoán trước: Điện thế màng xác định tốc độ chuyển tiếp và xác suất trên mỗi đơn vị thời gian của từng loại chuyển đổi.

kênh ion điện thế có khả năng tạo ra các điện thế hoạt động vì chúng có thể tạo ra các vòng điều hòa ngược dương tính : Điện thế màng kiểm soát trạng thái của kênh ion, nhưng trạng thái của kênh ion kiểm soát điện thế màng. Do đó, trong một số tình huống, sự gia tăng điện thế màng có thể khiến kênh ion mở ra, do đó gây ra sự gia tăng hơn nữa trong điện thế màng. Một điện thế hoạt động xảy ra khi chu kỳ điều hòa ngược dương tính này ( chu kỳ Hodgkin ) tiến hành bùng nổ. Quỹ đạo thời gian và biên độ của điện thế hoạt động được xác định bởi các tính chất sinh lý của kênh ion điện thế tạo ra nó. Một số loại kênh có khả năng tạo ra điều hòa ngược dương tính cần thiết để tạo ra điện thế hoạt động tồn tại. Các kênh natri điện thế chịu trách nhiệm cho các điện thế hoạt động nhanh liên quan đến dẫn truyền thần kinh. Điện thế hoạt động chậm hơn trong tế bào cơ và một số loại neuron được tạo ra bởi kênh calci điện thế. Mỗi loại này có nhiều biến thể, với độ nhạy điện thế khác nhau và động lực thời gian khác nhau.
Loại kênh ion phụ thuộc vào điện thế được nghiên cứu nhiều nhất bao gồm kênh natri liên quan đến dẫn truyền thần kinh nhanh. Chúng đôi khi được gọi là kênh natri Hodgkin-Huxley vì chúng được đặc trưng đầu tiên bởi Alan Hodgkin và Andrew Huxley trong các nghiên cứu giành giải thưởng Nobel về sinh lý học của điện thế hoạt động, nhưng có thể được gọi một cách thuận tiện hơn là kênh Na V. (Chữ "V" là viết tắt của "điện thế". ) Một kênh Na V có ba trạng thái có thể, được gọi là vô hiệu hóa, kích hoạt và bất hoạt . Kênh chỉ thấm vào ion natri khi nó ở trạng thái kích hoạt . Khi điện thế màng thấp, kênh dành phần lớn thời gian ở trạng thái tắt (đóng). Nếu điện thế màng được nâng lên trên một mức nhất định, kênh sẽ hiển thị xác suất tăng chuyển sang trạng thái kích hoạt (mở). Điện thế màng càng cao thì xác suất kích hoạt càng lớn. Khi một kênh đã được kích hoạt, cuối cùng nó sẽ chuyển sang trạng thái bất hoạt (đóng). Sau đó, nó có xu hướng bị bất hoạt trong một thời gian, nhưng, nếu điện thế màng trở lại thấp, kênh cuối cùng sẽ chuyển trở lại trạng thái ngừng hoạt động . Trong điện thế hoạt động, hầu hết kênh thuộc loại này trải qua chu kỳ bị vô hiệu hóa → được kích hoạt → bị bất hoạt → bị vô hiệu hóa . Tuy nhiên, đây chỉ là hành vi trung bình dân số - về cơ bản, một kênh riêng lẻ có thể thực hiện bất kỳ chuyển đổi nào. Tuy nhiên, khả năng chuyển kênh từ trạng thái bất hoạt trực tiếp sang trạng thái kích hoạt là rất thấp: Một kênh ở trạng thái bất hoạt là vật liệu trơ cho đến khi nó chuyển trở lại trạng thái ngừng hoạt động .
Kết quả của tất cả những điều này là động học của kênh Na V bị chi phối bởi một ma trận chuyển tiếp có tốc độ phụ thuộc vào điện thế một cách phức tạp. Vì chính kênh này đóng vai trò chính trong việc xác định điện thế, nên các động lực toàn cầu của hệ thống có thể khá khó để xử lý. Hodgkin và Huxley đã tiếp cận vấn đề bằng cách phát triển một bộ phương trình vi phân cho các tham số chi phối các trạng thái kênh ion, được gọi là phương trình Hodgkin-Huxley . Những phương trình này đã được sửa đổi rộng rãi bởi nghiên cứu sau này, nhưng tạo thành điểm khởi đầu cho hầu hết các nghiên cứu lý thuyết về vật lý sinh học điện thế hoạt động.

Chú thích: a) Ion natri (Na + ). b) Ion kali (K + ). c) Kênh natri. d) Kênh kali. e) Bơm natri-kali.
Trong các pha của điện thế hoạt động, tính thấm của màng neuron thay đổi. Ở trạng thái nghỉ (1), ion natri và kali có khả năng hạn chế đi qua màng và neuron có điện tích âm bên trong. Khi điện thế hoạt động được kích hoạt, quá trình khử cực (2) của neuron sẽ kích hoạt kênh natri, cho phép ion natri đi qua màng tế bào vào tế bào, dẫn đến điện tích dương trong neuron so với dịch ngoại bào. Sau khi đạt đến đỉnh điện thế hoạt động, neuron bắt đầu tái phân cực (3), trong đó kênh natri đóng và kênh kali mở ra, cho phép ion kali đi qua màng vào dịch ngoại bào, đưa điện thế màng trở về giá trị âm. Cuối cùng, có một pha trơ (4), trong đó kênh ion phụ thuộc điện thế bị bất hoạt trong khi ion Na + và K + trở lại phân bố trạng thái nghỉ của chúng trên màng (1), và neuron đã sẵn sàng lặp lại quá trình cho điện thế hoạt động tiếp theo.
Khi điện thế màng tăng lên, kênh ion natri mở ra, cho phép sự xâm nhập của ion natri vào trong tế bào. Tiếp theo là việc mở kênh ion kali cho phép thoát ion kali ra khỏi tế bào. Dòng ion natri đi vào bên trong làm tăng nồng độ của các cation tích điện dương trong tế bào và gây khử cực, trong đó điện thế của tế bào cao hơn điện thế nghỉ của tế bào. Các kênh natri đóng ở đỉnh của điện thế hoạt động, trong khi kali tiếp tục rời khỏi tế bào. Dòng đi của ion kali làm giảm điện thế màng hoặc tăng phân cực tế bào. Đối với sự tăng điện thế nhỏ từ phần còn lại, dòng kali vượt quá dòng natri và điện thế trở về giá trị nghỉ bình thường của nó, thường là −70 mV. [4] [5] [6] Tuy nhiên, nếu điện thế tăng vượt ngưỡng quan trọng, thường là 15 mV cao hơn giá trị nghỉ, dòng natri chiếm ưu thế. Điều này dẫn đến tình trạng không ổn định, theo đó điều hòa ngược dương tính từ dòng natri kích hoạt nhiều kênh natri hơn. Do đó, tế bào cháy, tạo ra điện thế hoạt động. [4] [7] [7] [note 1] Tần số tại đó neuron gợi ra điện thế hoạt động thường được gọi là tốc độ phóng hoặc tốc độ phóng thần kinh .
Dòng điện được tạo ra bằng cách mở kênh có điện thế trong quá trình điện thế hoạt động thường lớn hơn đáng kể so với dòng kích thích ban đầu. Do đó, biên độ, thời gian và hình dạng của điện thế hoạt động được xác định chủ yếu bởi các tính chất của màng kích thích chứ không phải biên độ hoặc thời gian của kích thích. Tính chất hoàn toàn hoặc không có gì của điện thế hoạt động này làm cho nó khác biệt với các điện thế được phân loại như điện thế thụ thể, điện thế điện, dao động điện thế màng dưới và điện thế synap, có quy mô với cường độ của kích thích. Một loạt các loại điện thế hoạt động tồn tại trong nhiều loại tế bào và khoang tế bào được xác định bởi các loại kênh điện thế, kênh rò rỉ, phân phối kênh, nồng độ ion, điện dung màng, nhiệt độ và các yếu tố khác.
Các ion chính liên quan đến điện thế hoạt động là các cation natri và kali; Các ion natri đi vào tế bào và ion kali rời đi, khôi phục trạng thái cân bằng. Một số ion tương đối cần phải xuyên qua màng để điện thế màng thay đổi mạnh mẽ. Các ion trao đổi trong điện thế hoạt động, do đó, tạo ra một sự thay đổi không đáng kể về nồng độ ion bên trong và bên ngoài. Một vài ion làm chéo được bơm ra một lần nữa bởi tác động liên tục của bơm kali natri, mà với các chất vận chuyển ion khác, duy trì tỷ lệ bình thường của nồng độ ion trên màng. Các cation calci và anion clorua có liên quan đến một số loại điện thế hoạt động, chẳng hạn như điện thế hoạt động của tim và điện thế hoạt động trong tảo Acetabularia đơn bào tương ứng.
Mặc dù điện thế hoạt động được tạo ra cục bộ trên các mảng của màng dễ bị kích thích, dòng điện kết quả có thể kích hoạt điện thế hoạt động trên các dải màng lân cận, tạo ra sự lan truyền giống như domino. Trái ngược với sự lan truyền thụ động của điện thế (thế điện âm ), điện thế hoạt động được tạo ra một lần nữa dọc theo các đoạn màng dễ bị kích thích và lan truyền mà không bị phân rã. [8] Các phần myelelin của sợi trục không dễ bị kích thích và không tạo ra điện thế hoạt động và tín hiệu được truyền đi một cách thụ động như điện thế điện . Thường xuyên cách nhau các bản vá không myelin hóa, được gọi là các eo Ranvier, tạo ra các điện thế hoạt động để tăng tín hiệu. Được gọi là dẫn truyền nhảy vọt, loại truyền tín hiệu này cung cấp một sự đánh đổi thuận lợi của tốc độ tín hiệu và đường kính sợi trục. Sự khử cực của các đầu sợi trục, nói chung, kích hoạt sự giải phóng chất dẫn truyền thần kinh vào khe hở tiếp hợp . Ngoài ra, điện thế hoạt động lan truyền ngược đã được ghi nhận trong các sợi nhánh của các tế bào chóp, có mặt khắp nơi trong vùng tân vỏ não. [c] Chúng được cho là có vai trò trong độ dẻo phụ thuộc vào thời gian tăng đột biến .
Trong mô hình điện dung màng Hodgkin–Huxley, tốc độ truyền của điện thế hoạt động không được xác định và người ta cho rằng các khu vực lân cận bị khử cực do nhiễu ion được giải phóng với kênh lân cận. Các phép đo khuếch tán ion và bán kính đã cho thấy điều này là không thể. [cần dẫn nguồn] Hơn nữa, các phép đo mâu thuẫn về thay đổi entropy và thời gian tranh chấp mô hình điện dung là hành động một mình. [cần dẫn nguồn] Ngoài ra, giả thuyết hấp phụ của Gilbert Ling, cho rằng điện thế màng và điện thế hoạt động của tế bào sống là do sự hấp phụ của ion di động lên các vị trí hấp phụ của tế bào. [9]
Sự trưởng thành của các tính chất điện của điện thế hoạt động
Khả năng của một neuron để tạo ra và truyền bá điện thế hoạt động thay đổi trong quá trình phát triển . Sự thay đổi điện thế màng của một neuron (do kết quả của một dòng xung) là chức năng của điện trở đầu vào màng. Khi tế bào phát triển, nhiều kênh được thêm vào màng, làm giảm điện trở đầu vào. Một neuron trưởng thành cũng trải qua những thay đổi ngắn hơn trong điện thế màng để đáp ứng với dòng synap. Các neuron từ một hạt nhân phát sinh bên chồn có thời gian dài hơn và độ lệch điện thế lớn hơn ở P0 so với tại P30. [10] Một hậu quả của thời gian điện thế hoạt động giảm là độ trung thực của tín hiệu có thể được bảo toàn để đáp ứng với kích thích tần số cao. Các neuron chưa trưởng thành dễ bị trầm cảm synapse hơn là điện thế sau khi kích thích tần số cao.
Trong sự phát triển ban đầu của nhiều sinh vật, điện thế hoạt động thực sự ban đầu được mang theo bởi dòng calci chứ không phải dòng natri . Động lực mở và đóng của kênh calci trong quá trình phát triển chậm hơn so với kênh natri có điện thế sẽ mang điện thế hoạt động trong các neuron trưởng thành. Thời gian mở dài hơn cho kênh calci có thể dẫn đến điện thế hoạt động chậm hơn đáng kể so với các neuron trưởng thành. [10] Các neuron Xenopus ban đầu có điện thế hoạt động mất 60-90 ms. Trong quá trình phát triển, thời gian này giảm xuống 1 ms. Có hai lý do cho sự giảm mạnh này. Đầu tiên, dòng vào bên trong chủ yếu được mang theo kênh natri. [11] Thứ hai, bộ chỉnh lưu trễ, dòng kênh kali, tăng tới 3,5 lần cường độ ban đầu.
Để chuyển từ điện thế hoạt động phụ thuộc calci sang điện thế hoạt động phụ thuộc natri để tiến hành kênh mới phải được thêm vào màng. Nếu neuron Xenopus được phát triển trong môi trường có tổng hợp RNA hoặc chất ức chế tổng hợp protein thì quá trình chuyển đổi bị ngăn chặn. [12] Ngay cả hoạt động điện của chính tế bào cũng có thể đóng một vai trò trong biểu hiện kênh. Nếu điện thế hoạt động trong tế bào cơ Xenopus bị chặn, sự gia tăng điển hình của mật độ dòng natri và kali sẽ bị ngăn chặn hoặc trì hoãn. [13]
Sự trưởng thành của các tính chất điện được nhìn thấy trên các loài. Dòng Xenopus natri và kali tăng mạnh sau khi neuron trải qua pha nguyên phân cuối cùng. Mật độ dòng natri của neuron vỏ não tăng 600% trong hai tuần đầu sau sinh. [10]
Truyền dẫn thần kinh
Cấu tạo của một neuron
| Neuron |
|---|
Một số loại tế bào hỗ trợ điện thế hoạt động, chẳng hạn như tế bào thực vật, tế bào cơ và tế bào chuyên biệt của tim (trong đó xảy ra điện thế hoạt động của tim ). Tuy nhiên, tế bào dễ bị kích thích chính là neuron, cũng có cơ chế đơn giản nhất cho điện thế hoạt động.
Các neuron là tế bào kích thích điện được cấu tạo, nói chung, của một hoặc nhiều sợi nhánh, một soma, một sợi trục và một hoặc nhiều đầu sợi trục . Sợi nhánh là các sợi chiếu, chức năng chính là nhận tín hiệu synap. Các phần lồi ra của chúng, được gọi là gai sợi nhánh, được thiết kế để bắt giữ các chất dẫn truyền thần kinh được giải phóng bởi neuron tiền synap. Chúng có nồng độ cao của kênh ion phối tử . Những chiếc gai này có một cái cổ mỏng nối một phần nhô ra với sợi nhánh. Điều này đảm bảo rằng những thay đổi xảy ra bên trong cột sống ít có khả năng ảnh hưởng đến các gai lân cận. Cột sống sợi nhánh có thể, ngoại trừ hiếm (xem điện thế hóa dài hạn ), hoạt động như một đơn vị độc lập. Các sợi nhánh kéo dài từ soma, nơi chứa nhân và nhiều bào quan sinh vật nhân chuẩn "bình thường". Không giống như các gai, bề mặt của soma được tạo ra bởi kênh ion kích hoạt điện thế. Các kênh này giúp truyền các tín hiệu được tạo ra bởi các sợi nhánh. Nổi lên từ soma là ngọn đồi sợi trục . Vùng này được đặc trưng bởi có nồng độ kênh natri kích hoạt điện thế rất cao. Nói chung, nó được coi là khu vực khởi đầu tăng đột biến cho điện thế hoạt động, [14] tức là khu vực kích hoạt . Nhiều tín hiệu được tạo ra ở các gai và được truyền bởi soma đều hội tụ ở đây. Ngay sau ngọn đồi là sợi trục. Đây là một phần nhô ra hình ống mỏng đi từ soma. Các sợi trục được cách điện bởi vỏ bọc myelin . Myelin bao gồm tế bào Schwann (trong hệ thần kinh ngoại biên) hoặc oligodendrocyte (tế bào thần kinh đệm ít gai) (trong hệ thần kinh trung ương), cả hai đều là loại neuron đệm . Mặc dù các neuron đệm không liên quan đến việc truyền tín hiệu điện, chúng giao tiếp và cung cấp hỗ trợ sinh hóa quan trọng cho neuron. [15] Cụ thể, myelin quấn nhiều lần quanh đoạn sợi trục, tạo thành một lớp mỡ dày ngăn cản ion xâm nhập hoặc thoát ra khỏi sợi trục. Cách điện này ngăn ngừa sự suy giảm tín hiệu đáng kể cũng như đảm bảo tốc độ tín hiệu nhanh hơn. Cách nhiệt này, tuy nhiên, có một hạn chế là không có kênh nào có thể có mặt trên bề mặt sợi trục. Do đó, có những mảng thường xuyên cách nhau của màng, không có lớp cách nhiệt. Các eo này của Ranvier có thể được coi là "các sợi trục nhỏ", vì mục đích của chúng là tăng tín hiệu nhằm ngăn chặn sự suy giảm tín hiệu đáng kể. Ở đầu xa nhất, sợi trục mất đi lớp cách điện và bắt đầu phân nhánh thành một số đầu sợi trục . Các thiết bị đầu cuối trước synap, hay synapse synap, là một khu vực chuyên biệt trong sợi trục của tế bào tiền sản có chứa chất dẫn truyền thần kinh được bao bọc trong các quả cầu nhỏ có màng gọi là túi synap .
Bắt đầu
Trước khi xem xét sự lan truyền của các điện thế hoạt động dọc theo sợi trục và sự chấm dứt của chúng tại các cúc synapse, rất hữu ích để xem xét các phương pháp mà điện thế hoạt động có thể được bắt đầu tại đỉnh sợi trục . Yêu cầu cơ bản là điện thế màng ở đỉnh được nâng lên trên ngưỡng để phóng. [4] [5] [17] [16] Có một số cách mà quá trình khử cực này có thể xảy ra.

Động lực học
Điện thế hoạt động thường được bắt đầu nhiều nhất bởi các điện thế sau synap kích thích từ một neuron tiền synap. [19] Thông thường, các phân tử dẫn truyền thần kinh được giải phóng bởi neuron tiền synap . Những chất dẫn truyền thần kinh này sau đó liên kết với các thụ thể trên tế bào sau synap. Liên kết này mở ra nhiều loại kênh ion . Sự mở này có tác dụng hơn nữa là thay đổi tính thấm cục bộ của màng tế bào và do đó, điện thế của màng. Nếu liên kết làm tăng điện thế (khử cực màng), synapse bị kích thích. Tuy nhiên, nếu liên kết làm giảm điện thế (tăng phân cực màng), đó là sự ức chế. Cho dù điện thế được tăng hay giảm, sự thay đổi sẽ truyền thụ động đến các vùng lân cận của màng (như được mô tả bởi phương trình cáp và các sàng lọc của nó). Thông thường, kích thích điện thế phân rã theo cấp số nhân với khoảng cách từ synapse và với thời gian từ sự ràng buộc của chất dẫn truyền thần kinh. Một phần điện thế kích thích có thể chạm tới đỉnh sợi trục và có thể (trong trường hợp hiếm hoi) khử cực màng đủ để kích thích điện thế hoạt động mới. Thông thường hơn, các điện thế kích thích từ một số synapse phải phối hợp với nhau gần như cùng một lúc để kích thích điện thế hoạt động mới. Tuy nhiên, những nỗ lực chung của họ có thể bị cản trở bởi các điện thế sau phẫu thuật ức chế phản tác dụng.
Truyền dẫn thần kinh cũng có thể xảy ra thông qua synapse điện . [20] Do kết nối trực tiếp giữa các ô dễ bị kích thích dưới dạng các mối nối khoảng cách, điện thế hoạt động có thể được truyền trực tiếp từ một ô sang ô tiếp theo theo một trong hai hướng. Dòng ion tự do giữa các tế bào cho phép truyền nhanh không qua hóa chất. Các kênh chỉnh lưu đảm bảo rằng các điện thế hoạt động chỉ di chuyển theo một hướng thông qua synapse điện. synapse điện được tìm thấy trong tất cả các hệ thống thần kinh, bao gồm cả não con người, mặc dù chúng là một thiểu số riêng biệt. [17]
Nguyên tắc "tất cả hoặc không"
Biên độ của điện thế hoạt động không phụ thuộc vào lượng dòng điện tạo ra nó. Nói cách khác, dòng điện lớn hơn không tạo ra điện thế hoạt động lớn hơn. Do đó, điện thế hoạt động được cho là tín hiệu tất cả hoặc không, vì chúng xảy ra hoàn toàn hoặc chúng không xảy ra. [d] [e] [f] Điều này trái ngược với điện thế thụ thể, có biên độ phụ thuộc vào cường độ của một kích thích. [18] Trong cả hai trường hợp, tần số của các điện thế hoạt động có tương quan với cường độ của một kích thích.
neuron cảm giác
Trong các neuron cảm giác, một tín hiệu bên ngoài như áp suất, nhiệt độ, ánh sáng hoặc âm thanh được kết hợp với việc mở và đóng kênh ion, từ đó làm thay đổi tính thấm ion của màng và điện thế của nó. [23] Những thay đổi điện thế này một lần nữa có thể bị kích thích (khử cực) hoặc ức chế (tăng phân cực) và, trong một số neuron cảm giác, các hiệu ứng kết hợp của chúng có thể khử cực cho ngọn đồi sợi trục đủ để kích thích điện thế hoạt động. Một số ví dụ ở người bao gồm neuron thụ thể khứu giác và tiểu thể của Meissner, vốn rất quan trọng đối với khứu giác và xúc giác, tương ứng. Tuy nhiên, không phải tất cả các neuron cảm giác đều chuyển đổi tín hiệu bên ngoài của chúng thành điện thế hoạt động; một số thậm chí không có sợi trục. [24] Thay vào đó, họ có thể chuyển đổi tín hiệu thành giải phóng chất dẫn truyền thần kinh hoặc thành các điện thế được phân loại liên tục, một trong hai có thể kích thích (các) neuron tiếp theo thành điện thế hoạt động. Để minh họa, trong tai người, tế bào lông chuyển đổi âm thanh đến thành mở và đóng kênh ion cơ học, có thể khiến các phân tử dẫn truyền thần kinh được giải phóng. Theo cách tương tự, ở võng mạc của con người, tế bào cảm quang ban đầu và lớp tế bào tiếp theo (bao gồm tế bào lưỡng cực và tế bào nằm ngang ) không tạo ra điện thế hoạt động; chỉ một số tế bào đuôi ngắn và lớp thứ ba, tế bào hạch, tạo ra điện thế hoạt động, sau đó đi lên thần kinh thị giác .
Điện thế tạo nhịp
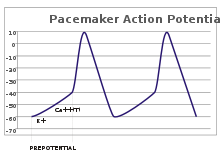
Trong các neuron cảm giác, điện thế hoạt động là kết quả của một kích thích bên ngoài. Tuy nhiên, một số tế bào dễ bị kích thích không cần kích thích như vậy để phóng: Chúng tự khử cực tự nhiên trên ngọn đồi sợi trục của chúng và điện thế hoạt động phóng ở tốc độ thường xuyên, như đồng hồ bên trong. [19] Dấu vết điện thế của tế bào như vậy được gọi là điện thế tạo nhịp . [20] Các tế bào tạo nhịp tim của nút trung tâm trong tim là một ví dụ điển hình. [g] Mặc dù điện thế tạo nhịp như vậy có nhịp tự nhiên, nó có thể được điều chỉnh bằng các kích thích bên ngoài; ví dụ, nhịp tim có thể được thay đổi bởi dược phẩm cũng như các tín hiệu từ các cảm và phó giao cảm thần kinh. [21] Các kích thích bên ngoài không gây ra sự phóng lặp đi lặp lại của tế bào, mà chỉ làm thay đổi thời gian của nó. [20] Trong một số trường hợp, việc điều chỉnh tần số có thể phức tạp hơn, dẫn đến mô hình của các điện thế hoạt động, chẳng hạn như bùng nổ .
Các pha
Quá trình của điện thế hoạt động có thể được chia thành năm phần: pha mất phân cực, pha cực đại (đảo cực), pha tái phân cực, pha ưu phân cực và pha trơ. Trong pha mất phân cực, điện thế màng khử cực (trở nên dương điện hơn). Điểm dừng khử cực được gọi là pha cực đại. Ở pha này, điện thế màng đạt đến mức tối đa. Sau đó, có một pha tái phân cực xuống. Trong pha này, điện thế màng trở nên tiêu cực hơn, trở lại điện thế nghỉ. pha dưới, hay sau quá trình phân cực, là pha mà điện thế màng tạm thời trở nên tích điện âm hơn so với khi nghỉ (tăng phân cực). Cuối cùng, thời gian mà điện thế hoạt động tiếp theo là không thể hoặc khó phóng được gọi là thời kỳ trơ, có thể trùng lặp với các pha khác. [22]
Quá trình của điện thế hoạt động được xác định bởi hai hiệu ứng kết hợp. [23] Đầu tiên, kênh ion nhạy cảm với điện thế mở và đóng để đáp ứng với những thay đổi trong điện thế màng V m . Điều này thay đổi tính thấm của màng đối với ion đó. [24] Thứ hai, theo phương trình Goldman, sự thay đổi tính thấm này làm thay đổi thế năng cân bằng E m, và do đó, điện thế màng V m . [h] Do đó, điện thế màng ảnh hưởng đến tính thấm, sau đó ảnh hưởng đến điện thế màng. Điều này thiết lập khả năng cho điều hòa ngược dương tính, là một phần quan trọng trong pha mất phân cực của điện thế hoạt động. [4] [7] Một yếu tố phức tạp là một kênh ion đơn lẻ có thể có nhiều "cổng" bên trong phản ứng với những thay đổi trong V m theo cách ngược lại hoặc ở các tốc độ khác nhau. [31] [i] Ví dụ, mặc dù tăng V m sẽ mở hầu hết các cổng trong kênh natri nhạy với điện thế, nó cũng đóng "cổng bất hoạt" của kênh, mặc dù chậm hơn. [32] Do đó, khi V m được tăng đột ngột, kênh natri mở ra ban đầu, nhưng sau đó đóng lại do quá trình khử hoạt động chậm hơn.
Điện thế ngưỡng và dòng điện của điện thế hoạt động trong tất cả các pha của nó được mô phỏng chính xác bởi Alan Lloyd Hodgkin và Andrew Huxley vào năm 1952, [i] mà họ đã được trao giải thưởng Nobel về sinh lý học hoặc y học năm 1963. [β] Tuy nhiên, mô hình của họ chỉ xem xét hai loại kênh ion nhạy với điện thế và đưa ra một số giả định về chúng, ví dụ, các cổng bên trong của chúng mở và đóng độc lập với nhau. Trong thực tế, có nhiều loại kênh ion, [25] và chúng không phải lúc nào cũng mở và đóng độc lập. [j]
pha kích thích và tăng
Một điện thế hoạt động điển hình bắt đầu từ ngọn đồi sợi trục [26] với sự khử cực đủ mạnh, ví dụ, một kích thích làm tăng V m . Sự khử cực này thường được gây ra bởi việc tiêm thêm cation natri vào tế bào; những cation này có thể đến từ nhiều nguồn khác nhau, chẳng hạn như synapse hóa học, neuron cảm giác hoặc điện thế tạo nhịp .
Đối với một neuron khi nghỉ, có một nồng độ ion natri và clorua cao trong dịch ngoại bào so với dịch nội bào, trong khi có nồng độ ion kali trong dịch nội bào cao so với dịch ngoại bào. Sự khác biệt về nồng độ, khiến ion chuyển từ nồng độ cao sang nồng độ thấp và hiệu ứng tĩnh điện (thu hút các điện tích trái dấu) là nguyên nhân dẫn đến sự di chuyển của ion trong và ngoài neuron. Bên trong neuron có điện tích âm, liên quan đến bên ngoài tế bào, từ sự di chuyển của K + ra khỏi tế bào. Màng neuron dễ thấm K + hơn ion khác, cho phép ion này di chuyển có chọn lọc ra khỏi tế bào, giảm độ dốc nồng độ của nó. Độ dốc nồng độ này cùng với kênh rò rỉ kali có trên màng neuron gây ra dòng ion kali làm cho điện thế nghỉ gần với E K ≈ Cỗ máy75 mV. [35] Vì ion Na + ở nồng độ cao hơn bên ngoài tế bào, nên sự khác biệt về nồng độ và điện thế sẽ đẩy chúng vào trong tế bào khi kênh Na + mở. Sự khử cực mở ra cả hai kênh natri và kali trong màng, cho phép ion đi vào và ra khỏi sợi trục, tương ứng. Nếu khử cực nhỏ (giả sử, tăng V m từ −70 mV đến −60 mV), dòng kali bên ngoài lấn át dòng natri bên trong và màng tái phân cực trở lại điện thế nghỉ bình thường của nó khoảng −70 mV. [4] [5] [6] Tuy nhiên, nếu quá trình khử cực đủ lớn, dòng natri vào bên trong tăng nhiều hơn so với dòng kali bên ngoài và điều kiện không ổn định ( điều hòa ngược dương tính ): càng có nhiều dòng vào bên trong, càng có nhiều V m tăng, mà lần lượt tăng thêm dòng vào. [4] [7] Sự khử cực đủ mạnh (tăng V m ) làm cho kênh natri nhạy cảm với điện thế mở ra; tính thấm ngày càng tăng đối với natri khiến V m gần với điện thế cân bằng natri E Na ≈ +55 mV. Lần lượt điện thế tăng làm cho kênh natri thậm chí còn mở ra nhiều hơn, điều này đẩy V m vẫn tiếp tục tiến về phía E Na . Điều hòa ngược dương tính này tiếp tục cho đến khi kênh natri được mở hoàn toàn và V m gần với E Na . [4] [5] [36] [27] Độ tăng mạnh của V m và độ thấm natri tương ứng với pha tăng của điện thế hoạt động. [4] [5] [36] [27]
Điện thế ngưỡng ngưỡng tới hạn cho điều kiện không ổn định này thường là khoảng −45 mV, nhưng nó phụ thuộc vào hoạt động gần đây của sợi trục. Một tế bào vừa phóng ra điện thế hoạt động không thể phóng ra tế bào khác ngay lập tức, vì kênh Na + chưa được phục hồi từ trạng thái bất hoạt. Khoảng thời gian không có điện thế hoạt động mới có thể bị sa thải được gọi là thời kỳ trơ tuyệt đối . [28] [29] [40] Ở thời gian dài hơn, sau khi một số nhưng không phải tất cả kênh ion đã phục hồi, sợi trục có thể được kích thích để tạo ra điện thế hoạt động khác, nhưng với ngưỡng cao hơn, đòi hỏi khử cực mạnh hơn nhiều, ví dụ, đến −30 mV. Khoảng thời gian mà các điện thế hoạt động khó gợi lên một cách bất thường được gọi là thời kỳ trơ tương đối . [28] [29] [40]
Pha đỉnh
Điều hòa ngược dương tính của pha tăng trở nên chậm và dừng lại khi kênh ion natri trở nên mở tối đa. Ở cực đại của điện thế hoạt động, độ thấm natri được tối đa hóa và điện thế màng V m gần bằng điện thế cân bằng natri E Na . Tuy nhiên, điện thế tăng tương tự đã mở kênh natri ban đầu cũng từ từ tắt chúng, bằng cách đóng lỗ chân lông của chúng; kênh natri trở nên bất hoạt . [32] Điều này làm giảm tính thấm của màng so với natri so với kali, đẩy điện thế màng trở lại giá trị nghỉ. Đồng thời, điện thế tăng sẽ mở kênh kali nhạy cảm với điện thế; sự gia tăng tính thấm kali của màng dẫn động V m về phía E K. [32] Kết hợp lại, những thay đổi về tính thấm natri và kali làm cho V m giảm xuống nhanh chóng, tái phân cực màng và tạo ra "pha rơi" của điện thế hoạt động. [28] [30] [27] [42]
Quá trình tái phân cực
Điện thế ngưỡng khử cực mở ra kênh kali phụ thuộc vào điện thế bổ sung, và một số trong số này không đóng lại ngay khi màng trở về điện thế nghỉ bình thường. Ngoài ra, kênh kali tiếp tục mở để đáp ứng với dòng ion calci trong quá trình hoạt động. Nồng độ nội bào của ion kali thấp thoáng qua một cách bất thường, làm cho điện thế màng V m thậm chí gần với điện thế cân bằng kali E K. Điện thế màng đi dưới điện thế màng nghỉ. Do đó, có một quá trình khử cực hoặc tăng phân cực, được gọi là quá trình phân cực hóa, tồn tại cho đến khi tính thấm kali màng trở về giá trị thông thường, khôi phục điện thế màng về trạng thái nghỉ. [31] [30]
Thời kỳ trơ
Mỗi điện thế hoạt động được theo sau bởi một pha trơ, có thể được chia thành một pha trơ tuyệt đối, trong đó không thể gợi lên điện thế hoạt động khác, và sau đó là một pha trơ tương đối, trong đó cần phải có một kích thích mạnh hơn bình thường. [28] [29] [40] Hai thời kỳ trơ này là do sự thay đổi trạng thái của các phân tử kênh natri và kali. Khi đóng cửa sau điện thế hoạt động, kênh natri đi vào trạng thái "bất hoạt", trong đó chúng không thể được thực hiện để mở bất kể điện thế màng tế bào này sẽ dẫn đến thời kỳ trơ tuyệt đối. Ngay cả sau khi đủ số lượng kênh natri đã trở lại trạng thái nghỉ, vẫn thường xảy ra tình trạng một phần kênh kali vẫn mở, gây khó khăn cho màng tế bào khử cực, và do đó làm tăng thời gian trơ tương đối. Do mật độ và phân nhóm của kênh kali có thể khác nhau rất lớn giữa các loại neuron khác nhau, thời gian của pha trơ tương đối rất khác nhau.
Thời kỳ trơ tuyệt đối chịu trách nhiệm phần lớn cho sự lan truyền một chiều của các điện thế hoạt động dọc theo sợi trục. [32] Tại bất kỳ thời điểm nào, các bản vá của sợi trục phía sau phần đỉnh cực là pha tr, nhưng các miếng vá ở phía trước, không có được kích hoạt thời gian gần đây, có khả năng được kích thích bởi sự khử cực từ điện thế hoạt động.
Lan truyền
điện thế hoạt động được tạo ra ở ngọn đồi sợi trục truyền đi như một làn sóng dọc theo sợi trục. [33] Dòng điện đi vào tại một điểm trên sợi trục trong một thế năng tác động lan ra dọc theo sợi trục và khử cực các phần liền kề của màng của nó. Nếu đủ mạnh, sự khử cực này gây ra điện thế hoạt động tương tự ở các mảng màng lân cận. Cơ chế cơ bản này đã được Alan Lloyd Hodgkin chứng minh vào năm 1937. Sau khi nghiền nát hoặc làm mát các phân đoạn thần kinh và do đó ngăn chặn các điện thế hoạt động, ông đã chỉ ra rằng điện thế hoạt động đến từ một phía của khối có thể gây ra điện thế hoạt động khác ở phía bên kia, với điều kiện là phân đoạn bị chặn là đủ ngắn. [k]
Khi điện thế hoạt động đã xảy ra ở một mảng màng, miếng vá màng cần có thời gian để phục hồi trước khi nó có thể phóng lại. Ở cấp độ phân tử, thời gian trơ tuyệt đối này tương ứng với thời gian cần thiết để kênh natri được kích hoạt điện thế phục hồi sau khi ngừng hoạt động, tức là trở về trạng thái đóng. [29] Có nhiều loại kênh kali kích hoạt điện thế trong neuron. Một số trong số chúng bất hoạt nhanh (dòng điện loại A) và một số trong số chúng bất hoạt chậm hoặc không hoạt động; sự thay đổi này đảm bảo rằng sẽ luôn có một nguồn dòng có sẵn để tái phân cực, ngay cả khi một số kênh kali bị bất hoạt do khử cực trước. Mặt khác, tất cả kênh natri kích hoạt điện thế neuron bất hoạt trong vài mili giây trong quá trình khử cực mạnh, do đó không thể khử cực cho đến khi một phần đáng kể kênh natri trở lại trạng thái đóng. Mặc dù nó giới hạn tần suất phóng, [34] thời gian trơ tuyệt đối đảm bảo rằng điện thế hoạt động chỉ di chuyển theo một hướng dọc theo sợi trục. [32] Dòng điện đi vào do điện thế hoạt động lan ra theo cả hai hướng dọc theo sợi trục. [35] Tuy nhiên, chỉ có phần chưa hết của sợi trục có thể đáp ứng với điện thế hoạt động; phần vừa bị phóng là không phản hồi cho đến khi điện thế hoạt động nằm ngoài phạm vi an toàn và không thể mô phỏng lại phần đó. Trong sự dẫn thuận chiều thông thường, điện thế hoạt động lan truyền từ ngọn đồi sợi trục về phía các cúc synapse (tận cùng sợi trục); lan truyền theo hướng ngược lại, được biết đến như là sự dẫn truyền antidromic rất hiếm. [36] Tuy nhiên, nếu một sợi trục trong phòng thí nghiệm được kích thích ở giữa, cả hai nửa sợi trục đều "tươi", tức là đã hết phóng điện; sau đó hai điện thế hoạt động sẽ được tạo ra, một điện thế đi về phía ngọn đồi sợi trục và cái còn lại di chuyển về phía synapse.
Myelin và dẫn truyền nhảy vọt

Để cho phép truyền tín hiệu điện nhanh và hiệu quả trong hệ thống thần kinh, một số sợi trục thần kinh nhất định được bọc bằng vỏ myelin . Myelin là một màng đa lớp bao bọc sợi trục trong các phân đoạn được phân tách bằng các khoảng được gọi là eo Ranvier . Nó được sản xuất bởi tế bào chuyên biệt: tế bào Schwann dành riêng cho hệ thần kinh ngoại biên và oligodendrocyte (tế bào thần kinh đệm ít gai) dành riêng cho hệ thần kinh trung ương . Vỏ myelin làm giảm điện dung màng và tăng điện trở màng trong các khoảng thời gian giữa các nút, do đó cho phép chuyển động nhanh, dẫn truyền nhảy vọt của các điện thế hoạt động từ nút này sang nút khác. [l] [m] [n]Myelin hóa được tìm thấy chủ yếu ở động vật có xương sống, nhưng một hệ thống tương tự đã được phát hiện ở một số động vật không xương sống, chẳng hạn như một số loài tôm . [o] Không phải tất cả các neuron ở động vật có xương sống đều bị myelin hóa; ví dụ, các sợi trục của các neuron bao gồm hệ thần kinh tự chủ nói chung không bị myelin hóa.
Myelin ngăn ion xâm nhập hoặc rời khỏi sợi trục dọc theo các đoạn myelin. Theo nguyên tắc chung, myelin hóa làm tăng tốc độ dẫn truyền thần kinh của các điện thế hoạt động và làm cho chúng tiết kiệm năng lượng hơn. Dù có dẫn truyền nhảy vọt hay không, tốc độ dẫn trung bình của điện thế hoạt động nằm trong khoảng từ 1 mét trên giây (m / s) đến hơn 100 m / s, và, nói chung, tăng theo đường kính sợi trục. [p]
Điện thế hoạt động không thể lan truyền qua màng trong các phân đoạn của sợi trục. Tuy nhiên, dòng điện được mang bởi tế bào chất, đủ để khử cực nút đầu tiên hoặc thứ hai của Ranvier . Thay vào đó, dòng ion từ điện thế hoạt động tại một eo Ranvier kích thích điện thế hoạt động khác ở nút tiếp theo; "nhảy" rõ ràng này của điện thế hoạt động từ nút này sang nút khác được gọi là dẫn truyền nhảy vọt . Mặc dù cơ chế dẫn truyền nhảy vọt được đề xuất vào năm 1925 bởi Ralph Lillie, [q] [r] bằng chứng thực nghiệm đầu tiên về dẫn truyền nhảy vọt do Ichiji Tasaki [s] [s], Taiji Takeuchi [t] [t] [37] , Andrew Huxley, Robert Stämpfli thực hiện. [u] Ngược lại, trong các sợi trục không myelin hóa, điện thế hoạt động kích thích một sợi khác trong màng ngay lập tức liền kề và di chuyển liên tục xuống sợi trục như một làn sóng.

Myelin có hai ưu điểm quan trọng: tốc độ dẫn nhanh và hiệu quả năng lượng. Đối với các sợi trục lớn hơn đường kính tối thiểu (khoảng 1 micromet ), quá trình myel hóa làm tăng tốc độ dẫn của một thế năng hành động, thường là gấp mười lần. Ngược lại, với tốc độ dẫn truyền nhất định, các sợi myelin nhỏ hơn so với các đối tác không myelin hóa của chúng. Ví dụ, điện thế hoạt động di chuyển với tốc độ gần như nhau (25 m / s) trong một sợi trục ếch bị myelin hóa và một sợi trục khổng lồ mực không myelin, nhưng sợi trục ếch có đường kính nhỏ hơn khoảng 30 lần và diện tích mặt cắt nhỏ hơn 1000 lần. Ngoài ra, do các dòng ion bị giới hạn trong các eo Ranvier, nên ion "rò rỉ" trên màng ít hơn rất nhiều, tiết kiệm năng lượng trao đổi chất. Tiết kiệm này là một lợi thế chọn lọc đáng kể, vì hệ thống thần kinh của con người sử dụng khoảng 20% năng lượng trao đổi chất của cơ thể. [w]
Độ dài của các đoạn myelin hóa của sợi trục rất quan trọng đối với sự thành công của dẫn truyền nhảy vọt. Chúng phải dài nhất có thể để tối đa hóa tốc độ dẫn, nhưng không lâu đến mức tín hiệu đến quá yếu để kích thích điện thế hoạt động ở nút tiếp theo của Ranvier. Về bản chất, các phân đoạn myelin thường đủ dài để tín hiệu được truyền thụ động truyền cho ít nhất hai nút trong khi vẫn giữ đủ biên độ để phóng điện thế hoạt động ở nút thứ hai hoặc thứ ba. Do đó, hệ số an toàn của dẫn truyền nhảy vọt là cao, cho phép truyền qua các nút trong trường hợp chấn thương. Tuy nhiên, điện thế hoạt động có thể kết thúc sớm ở một số nơi mà hệ số an toàn thấp, ngay cả ở các neuron không myelin; một ví dụ phổ biến là điểm nhánh của một sợi trục, nơi nó chia thành hai sợi trục. [39]
Một số bệnh làm suy giảm myelin và làm suy giảm dẫn truyền nhảy vọt, làm giảm tốc độ dẫn của các điện thế hoạt động. [x] Nổi tiếng nhất trong số này là bệnh đa xơ cứng, trong đó sự phá vỡ của myelin làm suy yếu sự phối hợp vận động. [40]
Lý thuyết cáp

Dòng đi trong một sợi trục có thể được mô tả một cách định lượng bằng lý thuyết cáp và các chi tiết của nó, chẳng hạn như mô hình ngăn. [41] Lý thuyết cáp được Lord Kelvin phát triển vào năm 1855 để mô hình hóa cáp điện báo xuyên Đại Tây Dương [y] và được chứng minh là có liên quan đến neuron của Hodgkin và Rushton vào năm 1946. [z] Trong lý thuyết cáp đơn giản, neuron được coi là một cáp truyền hình trụ hoàn toàn thụ động, có thể được mô tả bằng một phương trình vi phân từng phần
Trong đó V ( x, t ) là điện thế trên màng tại thời điểm t và vị trí x dọc theo chiều dài của nơron, và trong đó λ và τ là chiều dài và thang đo thời gian đặc trưng mà các điện thế đó phân rã để đáp ứng với kích thích . Đề cập đến sơ đồ mạch bên phải, các thang đo này có thể được xác định từ các điện trở và công suất trên mỗi đơn vị chiều dài. [42]
Những thang đo thời gian và chiều dài này có thể được sử dụng để hiểu sự phụ thuộc của tốc độ dẫn truyền vào đường kính của neuron trong các sợi không myelin. Ví dụ, thang thời gian tăng với cả điện trở màng r m và điện dung c m . Khi điện dung tăng, phải truyền thêm điện tích để tạo ra điện thế màng cho trước (theo phương trình Q = = CV ); khi điện trở tăng, điện tích được truyền ít hơn trên mỗi đơn vị thời gian, làm cho sự cân bằng chậm hơn. Theo cách tương tự, nếu điện trở trong mỗi đơn vị chiều dài r i thấp hơn ở một sợi trục so với sợi trục khác (ví dụ, vì bán kính của cái trước lớn hơn), chiều dài phân rã không gian λ trở nên dài hơn và tốc độ dẫn của điện thế hoạt động tăng. Nếu điện trở xuyên màng r m tăng lên, điều đó làm giảm dòng "rò rỉ" trung bình trên màng, tương tự làm cho λ trở nên dài hơn, làm tăng tốc độ dẫn.
Chấm dứt
Synapse
Nói chung, các điện thế hoạt động chạm tới các cúc synapse làm cho một chất dẫn truyền thần kinh được giải phóng vào khe hở tiếp hợp. [aa] Chất dẫn truyền thần kinh là các phân tử nhỏ có thể mở kênh ion trong tế bào sau synap; hầu hết các sợi trục đều có cùng chất dẫn truyền thần kinh ở tất cả các tận cùng của chúng. Sự xuất hiện của điện thế hoạt động sẽ mở ra kênh calci nhạy cảm với điện thế trong màng trước sinh; dòng calci làm cho các túi chứa đầy chất dẫn truyền thần kinh di chuyển đến bề mặt tế bào và giải phóng nội dung của chúng vào khe hở tiếp hợp . [ab] Quá trình phức tạp này bị ức chế bởi độc tố thần kinh tetanospasmin và độc tố botulinum, chịu trách nhiệm cho bệnh uốn ván và ngộ độc, tương ứng. [ac]

synapse điện
Một số synapse phân tán với "người trung gian" của chất dẫn truyền thần kinh, và kết nối tế bào tiền sản và sau synap với nhau. [ad] Khi điện thế hoạt động đạt đến một synapse như vậy, các dòng ion đi vào tế bào tiền synap có thể vượt qua hàng rào của hai màng tế bào và đi vào tế bào sau synap thông qua các lỗ chân lông được gọi là con trỏ . [ae] Do đó, các dòng ion của điện thế hoạt động tiền synap có thể kích thích trực tiếp tế bào sau synap. Các synapse điện cho phép truyền nhanh hơn vì chúng không đòi hỏi sự khuếch tán chậm của các chất dẫn truyền thần kinh qua khe hở tiếp hợp. Do đó, synapse điện được sử dụng bất cứ khi nào phản ứng nhanh và phối hợp thời gian là rất quan trọng, như trong phản xạ thoát hiểm, võng mạc của động vật có xương sống và tim .
Nút thần kinh cơ
Một trường hợp đặc biệt của synapse hóa học là khớp nối thần kinh cơ, trong đó sợi trục của nơron vận động chấm dứt trên một sợi cơ . [af] Trong những trường hợp như vậy, chất dẫn truyền thần kinh được giải phóng là acetylcholine, liên kết với thụ thể acetylcholine, một protein màng tích hợp trong màng ( sarcolemma ) của sợi cơ. [ag] Tuy nhiên, acetylcholine không bị ràng buộc; thay vào đó, nó phân ly và bị thủy phân bởi enzyme, acetylcholinesterase, nằm trong synapse. Enzyme này nhanh chóng làm giảm kích thích đến cơ, cho phép mức độ và thời gian của sự co cơ được điều chỉnh một cách tinh tế. Một số chất độc làm bất hoạt acetylcholinesterase để ngăn chặn sự kiểm soát này, chẳng hạn như các tác nhân thần kinh sarin và tabun, [ah] low [ah] và thuốc trừ sâu diazinon và malathion . [ai]
Các loại tế bào khác
điện thế hoạt động của tim

Điện thế hoạt động của tim khác với điện thế hoạt động của neuron bằng cách có một cao nguyên mở rộng, trong đó màng được giữ ở điện thế cao trong vài trăm mili giây trước khi được tái phân cực bởi dòng kali như bình thường. [aj] Cao nguyên này là do hoạt động của kênh calci mở chậm hơn và giữ điện thế màng gần điện thế cân bằng của chúng ngay cả sau khi kênh natri đã bất hoạt.
điện thế hoạt động của tim đóng vai trò quan trọng trong việc điều phối sự co bóp của tim. [aj] Các tế bào tim của nút trung tâm cung cấp điện thế tạo nhịp tim đồng bộ hóa tim. Điện thế hoạt động của tế bào này truyền đến và thông qua nút nhĩ thất (nút AV), thường là con đường dẫn truyền duy nhất giữa tâm nhĩ và tâm thất . Điện thế hoạt động từ nút AV truyền qua bó His và từ đó đến các sợi Purkinje . [note 2] Ngược lại, sự bất thường trong điện thế hoạt động của tim, dù là do đột biến bẩm sinh hay chấn thương, có thể dẫn đến bệnh lý ở người, đặc biệt là rối loạn nhịp tim . Một số loại thuốc chống rối loạn nhịp tim tác động đến điện thế hoạt động của tim, chẳng hạn như quinidine, lidocaine, thuốc chẹn beta và verapamil . [ak]
điện thế hoạt động cơ
điện thế hoạt động trong tế bào cơ xương bình thường tương tự như điện thế hoạt động trong các neuron. [43] điện thế hoạt động là kết quả của quá trình khử cực của màng tế bào ( sarcolemma ), mở ra kênh natri nhạy cảm với điện thế; chúng trở nên bất hoạt và màng được tái phân cực thông qua dòng ion kali bên ngoài. Điện thế nghỉ trước điện thế hoạt động thường là −90mV, hơi âm tính hơn các neuron điển hình. Điện thế hoạt động cơ kéo dài khoảng 2 trận4 ms, thời gian trơ tuyệt đối là khoảng 1 trận3 ms và tốc độ dẫn truyền dọc theo cơ là khoảng 5 Cô. Điện thế hoạt động giải phóng ion calci giải phóng chất nhiệt đới và cho phép cơ co lại. Điện thế hoạt động cơ được kích thích bởi sự xuất hiện của điện thế hoạt động thần kinh tiền synap tại chỗ nối thần kinh cơ, là mục tiêu phổ biến của các độc tố thần kinh . [ah]
điện thế hoạt động của thực vật
Tế bào thực vật và nấm [al] cũng dễ bị kích thích điện. Sự khác biệt cơ bản từ điện thế hoạt động của động vật là sự khử cực trong tế bào thực vật không được thực hiện bằng sự hấp thu ion natri dương, mà bằng cách giải phóng ion clorua âm tính. [am] [an] [ao] Một số thực vật (ví dụ Dionaea muscipula ) sử dụng kênh có natri để vận hành các chuyển động, tuy nhiên, hiếm khi thực vật sử dụng kênh natri như là sự hấp thu chính của chúng để tạo ra điện thế hoạt động. [44] Cùng với sự giải phóng tiếp theo ion kali dương, vốn phổ biến đối với điện thế hoạt động của thực vật và động vật, điện thế hoạt động ở thực vật liên quan đến sự mất thẩm thấu của muối (KCl), trong khi điện thế hoạt động của động vật là trung tính về mặt thẩm thấu, khi lượng natri vào bằng nhau và để lại kali triệt tiêu lẫn nhau. Sự tương tác giữa các mối quan hệ điện và thẩm thấu trong tế bào thực vật [ap] dường như phát sinh từ chức năng thẩm thấu của tính dễ bị kích thích điện trong tổ tiên chung, đơn bào của thực vật và động vật trong điều kiện thay đổi độ mặn, trong khi chức năng hiện tại là truyền tín hiệu nhanh được xem như là một thành tựu trẻ hơn của tế bào metazoan trong một môi trường thẩm thấu ổn định hơn. [45] Có khả năng là chức năng báo hiệu quen thuộc của điện thế hoạt động trong một số thực vật có mạch (ví dụ Mimosa pudica ) phát sinh độc lập từ đó trong tế bào kích thích metazoan.
Phân phối phân loại và lợi thế tiến hóa
điện thế hoạt động được tìm thấy trên khắp các sinh vật đa bào, bao gồm thực vật, động vật không xương sống như côn trùng và động vật có xương sống như bò sát và động vật có vú . [aq] Động vật thân lỗ dường như là ngành của sinh vật nhân thực đa bào chủ yếu không truyền điện thế hoạt động, mặc dù một số nghiên cứu cho rằng những sinh vật này cũng có dạng tín hiệu điện. [ar] Điện thế nghỉ, cũng như kích thước và thời gian của điện thế hoạt động, không thay đổi nhiều so với tiến hóa, mặc dù tốc độ dẫn truyền thay đổi đáng kể theo đường kính sợi trục và sự my hóa.
Với sự bảo tồn của nó trong suốt quá trình tiến hóa, điện thế hoạt động dường như mang lại lợi thế tiến hóa. Một chức năng của điện thế hoạt động là tín hiệu nhanh, tầm xa trong cơ thể sinh vật; vận tốc dẫn có thể vượt quá 110 m / s, một phần ba tốc độ âm thanh . Để so sánh, một phân tử hormone mang trong máu di chuyển vào khoảng 8 m / s trong các động mạch lớn. Một phần của chức năng này là sự phối hợp chặt chẽ của các sự kiện cơ học, chẳng hạn như sự co bóp của tim. Hàm thứ hai là tính toán liên quan đến thế hệ của nó. Là tín hiệu tất cả hoặc không phân rã với khoảng cách truyền, điện thế hoạt động có lợi thế tương tự như thiết bị điện tử số . Sự tích hợp các tín hiệu sợi nhánh khác nhau ở đỉnh sợi trục và ngưỡng của nó để tạo thành chuỗi các điện thế hoạt động phức tạp là một hình thức tính toán khác, được khai thác về mặt sinh học để tạo thành các máy tạo mô hình trung tâm và mô phỏng trong các mạng thần kinh nhân tạo .
Tổ tiên sinh vật nhân thực / sinh vật nhân sơ sống cách đây bốn tỷ năm được cho là có kênh điện thế. Chức năng này có khả năng, tại một số điểm nào đó, được sử dụng để cung cấp cơ chế giao tiếp. Ngay cả các vi khuẩn đơn bào hiện đại cũng có thể sử dụng các điện thế hoạt động để giao tiếp với các vi khuẩn khác trong cùng một màng sinh học. [46]
Phương pháp thí nghiệm

Nghiên cứu về điện thế hoạt động đã yêu cầu phát triển các phương pháp thử nghiệm mới. Công việc ban đầu, trước năm 1955, được thực hiện chủ yếu bởi Alan Lloyd Hodgkin và Andrew Fielding Huxley, người cùng với John Carew Ecère, đã trao giải thưởng Nobel về sinh lý học hoặc y học năm 1963 vì những đóng góp của họ cho sự mô tả về cơ sở ion của dây thần kinh dẫn. Nó tập trung vào ba mục tiêu: cô lập tín hiệu từ neuron đơn hoặc sợi trục thần kinh, phát triển nhanh chóng, điện tử nhạy cảm, và co lại điện cực đủ mà điện thế bên trong tế bào đơn có thể được ghi lại.
Vấn đề đầu tiên được giải quyết bằng cách nghiên cứu các sợi trục khổng lồ được tìm thấy trong các neuron mực ( Loligo forbesii và Doryteuthis pealeii, tại thời điểm được phân loại là Loligo pealeii ). [as] Những sợi trục này có đường kính rất lớn (khoảng 1 mm, hoặc lớn hơn 100 lần so với một neuron thông thường) mà chúng có thể nhìn thấy bằng mắt thường, khiến chúng dễ dàng trích xuất và thao tác. [i] [at] Tuy nhiên, chúng không đại diện cho tất cả tế bào dễ bị kích thích và nhiều hệ thống khác có điện thế hoạt động đã được nghiên cứu.
Vấn đề thứ hai được giải quyết với sự phát triển quan trọng của kẹp điện thế, [au] cho phép các nhà thí nghiệm nghiên cứu dòng ion ẩn điện thế hoạt động trong sự cô lập và loại bỏ nguồn nhiễu điện tử quan trọng, dòng điện I C liên quan đến điện dung C của màng. [48] Vì dòng điện bằng C nhân với tốc độ thay đổi của điện thế màng V m, nên giải pháp là thiết kế mạch giữ V m cố định (tốc độ thay đổi bằng 0) bất kể dòng điện chạy qua màng. Do đó, dòng điện cần thiết để giữ V m ở một giá trị cố định là sự phản xạ trực tiếp của dòng điện chạy qua màng. Những tiến bộ điện tử khác bao gồm việc sử dụng lồng Faraday và thiết bị điện tử có trở kháng đầu vào cao, do đó bản thân phép đo không ảnh hưởng đến điện thế được đo. [49]
Vấn đề thứ ba, đó là thu được các điện cực đủ nhỏ để ghi lại điện thế trong một sợi trục mà không làm nhiễu nó, đã được giải quyết vào năm 1949 với việc phát minh ra điện cực micropipette thủy tinh, [av] nhanh chóng được các nhà nghiên cứu khác áp dụng. [aw] [ax] Bộ lọc của phương pháp này có thể sản xuất các mẹo điện cực được như tốt như 100 Å (10 nm ), mà cũng trao trở kháng đầu vào cao. [50] điện thế hoạt động cũng có thể được ghi với điện cực kim loại nhỏ được đặt ngay bên cạnh một neuron, với neurochips chứa EOSFETs, hoặc quang học với thuốc nhuộm đó là nhạy cảm với <sup id="mwBDg">Ca2 +</sup> hoặc để điện thế. [ay]

Trong khi các điện cực micropipette thủy tinh đo tổng dòng điện đi qua nhiều kênh ion, việc nghiên cứu tính chất điện của một kênh ion duy nhất có thể xảy ra vào những năm 1970 với sự phát triển của kẹp vá bởi Erwin Neher và Bert Sakmann . Đối với khám phá này, họ đã được trao giải thưởng Nobel về sinh lý học hoặc y học vào năm 1991. [γ] Kẹp vá đã xác minh rằng kênh ion có trạng thái dẫn điện riêng biệt, chẳng hạn như mở, đóng và bất hoạt.
Các công nghệ hình ảnh quang học đã được phát triển trong những năm gần đây để đo lường điện thế hoạt động, thông qua các bản ghi đa điểm đồng thời hoặc với độ phân giải siêu không gian. Sử dụng thuốc nhuộm nhạy cảm với điện thế, điện thế hoạt động đã được ghi nhận về mặt quang học từ một mảng nhỏ của màng tế bào cơ tim . [az]
Độc tố thần kinh

Một số độc tố thần kinh, cả tự nhiên và tổng hợp, được thiết kế để ngăn chặn điện thế hoạt động. Tetrodotoxin từ cá nóc và saxitoxin từ Gonyaulax (chi dinoflagellate chịu trách nhiệm cho " thủy triều đỏ ") ngăn chặn điện thế hoạt động bằng cách ức chế kênh natri nhạy cảm với điện thế; [ba] tương tự, dendrotoxin từ rắn mamba đen ức chế kênh kali nhạy cảm với điện thế. Các chất ức chế như vậy của kênh ion phục vụ mục đích nghiên cứu quan trọng, bằng cách cho phép các nhà khoa học "tắt" kênh cụ thể theo ý muốn, do đó cô lập các đóng góp của kênh khác; chúng cũng có thể hữu ích trong việc làm sạch kênh ion bằng sắc ký ái lực hoặc trong việc phân tích nồng độ của chúng. Tuy nhiên, các chất ức chế như vậy cũng tạo ra độc tố thần kinh hiệu quả, và đã được xem xét để sử dụng làm vũ khí hóa học . Các độc tố thần kinh nhắm vào kênh ion của côn trùng đã là thuốc trừ sâu hiệu quả; một ví dụ là permethrin tổng hợp, giúp kéo dài quá trình kích hoạt kênh natri liên quan đến điện thế hoạt động. Các kênh ion của côn trùng đủ khác biệt so với các đối tác của con người rằng có rất ít tác dụng phụ ở người.
Lịch sử

Vai trò của điện trong hệ thần kinh của động vật lần đầu tiên được quan sát thấy ở những con ếch bị mổ xẻ bởi Luigi Galvani, người đã nghiên cứu nó từ năm 1791 đến 1797. [bb] low [bb] Kết quả của Galvani đã kích thích Alessandro Volta phát triển cọc Voltaic Pinthe, loại pin điện được biết đến sớm nhất mà ông nghiên cứu về điện động vật (như lươn điện ) và các phản ứng sinh lý đối với điện thế dòng điện thế dụng . [bc]
Các nhà khoa học của thế kỷ 19 đã nghiên cứu tuyên truyền các tín hiệu điện trong toàn bộ dây thần kinh (ví dụ, bó của neuron ) và chứng minh rằng mô thần kinh được tạo thành từ tế bào, thay vì một mạng lưới kết nối của ống (một lưới). [65] Carlo Matteucci theo dõi các nghiên cứu của Galvani và chứng minh rằng màng tế bào có điện thế trên chúng và có thể tạo ra dòng điện trực tiếp . Công trình của Matteucci đã truyền cảm hứng cho nhà sinh lý học người Đức, Emil du Bois-Reymond, người đã phát hiện ra điện thế hoạt động vào năm 1843. [51] Vận tốc dẫn truyền của các điện thế hoạt động được đo lường lần đầu tiên vào năm 1850 bởi người bạn của du Bois-Reymond, Hermann von Helmholtz . [52] Để thiết lập mô thần kinh được tạo thành từ tế bào rời rạc, bác sĩ người Tây Ban Nha, ông Santiago Ramón y Cajal và các sinh viên của mình đã sử dụng một vết bẩn do Camillo Golgi phát triển để tiết lộ vô số hình dạng của các neuron mà chúng tạo ra một cách khó khăn. Vì những khám phá của họ, Golgi và Ramón y Cajal đã được trao giải thưởng Nobel về sinh lý học năm 1906. [δ] Công việc của họ đã giải quyết một cuộc tranh cãi lâu dài trong phẫu thuật thần kinh thế kỷ 19; Chính Golgi đã tranh luận về mô hình mạng của hệ thần kinh.

Thế kỷ 20 là một kỷ nguyên quan trọng đối với điện sinh lý học. Năm 1902 và một lần nữa vào năm 1912, Julius Bernstein đã đưa ra giả thuyết rằng điện thế hoạt động là kết quả của sự thay đổi tính thấm của màng sợi trục đối với ion. [bd] [53] Giả thuyết của Bernstein đã được xác nhận bởi Ken Cole và Howard Curtis, người đã chỉ ra rằng độ dẫn của màng tăng lên trong điện thế hoạt động. [be] Vào năm 1907, Louis Lapicque đã gợi ý rằng điện thế hoạt động được tạo ra khi ngưỡng được vượt qua, [bf] sau này sẽ được coi là một sản phẩm của hệ thống động lực của các chất dẫn ion. Năm 1949, Alan Hodgkin và Bernard Katz đã cải tiến giả thuyết của Bernstein bằng cách xem xét rằng màng sợi trục có thể có tính thấm khác nhau đối với ion khác nhau; đặc biệt, họ đã chứng minh vai trò quan trọng của tính thấm natri đối với điện thế hoạt động. [bg] Họ đã thực hiện bản ghi thực tế đầu tiên về những thay đổi điện trên màng neuron làm trung gian cho điện thế hoạt động. [ε] Dòng nghiên cứu này lên đến đỉnh điểm trong năm 1952 bài báo của Hodgkin, Katz và Andrew Huxley, trong đó họ áp dụng kỹ thuật kẹp điện thế để xác định sự phụ thuộc của tính thấm của màng sợi trục vào ion natri và kali vào điện thế và thời gian, từ đó họ có thể để tái cấu trúc điện thế hoạt động một cách định lượng. [i] Hodgkin và Huxley tương quan các tính chất của mô hình toán học của họ với kênh ion rời rạc có thể tồn tại ở một số trạng thái khác nhau, bao gồm "mở", "đóng" và "bất hoạt". Giả thuyết của họ đã được xác nhận vào giữa những năm 1970 và 1980 bởi Erwin Neher và Bert Sakmann, người đã phát triển kỹ thuật kẹp vá để kiểm tra trạng thái độ dẫn của kênh ion riêng lẻ. [bh] Trong thế kỷ 21, các nhà nghiên cứu bắt đầu hiểu cơ sở cấu trúc của các trạng thái độ dẫn này và tính chọn lọc của kênh đối với loài ion của chúng, [bi] thông qua các cấu trúc tinh thể phân giải nguyên tử, [bj] huỳnh quang [bj] đo khoảng cách [bk] và nghiên cứu kính hiển vi điện tử cryo . [bl]
Julius Bernstein cũng là người đầu tiên đưa ra phương trình Nernst cho khả năng nghỉ trên màng; điều này đã được David E. Goldman khái quát thành phương trình Goldman cùng tên vào năm 1943. [h] Bơm kali natri, được xác định vào năm 1957 [bm] [ζ] và các đặc tính của nó dần dần được làm sáng tỏ, [bn] [bo] [bp] lên đến đỉnh điểm trong việc xác định cấu trúc phân giải nguyên tử của nó bằng tinh thể học tia X. [bq] Các cấu trúc tinh thể của máy bơm ion liên quan cũng đã được giải quyết, cho một cái nhìn rộng hơn về cách thức các máy phân tử này hoạt động. [br]
Mô hình định lượng

Các mô hình toán học và tính toán là rất cần thiết để hiểu điện thế hoạt động và đưa ra dự đoán có thể được kiểm tra dựa trên dữ liệu thực nghiệm, cung cấp một bài kiểm tra nghiêm ngặt về lý thuyết. Điều quan trọng và chính xác nhất của các mô hình thần kinh ban đầu là mô hình HodgkinTHER Huxley, mô tả điện thế hoạt động bằng một bộ bốn phương trình vi phân thông thường (ODE). [i] Mặc dù mô hình HodgkinTHER Huxley có thể đơn giản hóa với một vài hạn chế [54] so với màng thần kinh thực tế tồn tại trong tự nhiên, sự phức tạp của nó đã truyền cảm hứng cho một số mô hình thậm chí đơn giản hơn, [55] [bs] như mô hình của MorrisTHER Lecar [bt] low [bt] và mô hình FitzHughTHER Nagumo, [bu] cả hai chỉ có hai ODE được ghép nối. Các tính chất của các mô hình Hodgkin, Huxley và FitzHughát Nagumo và họ hàng của họ, chẳng hạn như mô hình Bonhoefferiêu van der Pol, [bv] đã được nghiên cứu kỹ trong toán học, [56] [bw] tính toán [bx] và điện tử. [by] Tuy nhiên, các mô hình đơn giản về điện thế máy phát điện và điện thế hoạt động không thể tái tạo chính xác tốc độ tăng đột biến thần kinh gần ngưỡng và hình dạng tăng đột biến, đặc biệt đối với các cơ chế cơ học như tiểu thể Pacinian . [57] Nghiên cứu hiện đại hơn đã tập trung vào các hệ thống lớn hơn và tích hợp hơn; bằng cách tham gia các mô hình điện thế hoạt động với các mô hình của các bộ phận khác của hệ thần kinh (như sợi nhánh và synapse), các nhà nghiên cứu có thể nghiên cứu tính toán thần kinh [74] và các phản xạ đơn giản, như phản xạ thoát hiểm và các phản xạ khác được điều khiển bởi các bộ tạo mô hình trung tâm . [58] [bz]
Xem thêm
- Anode phá vỡ kích thích
- Điện sinh học
- Mô hình nơ ron sinh học
- Bùng nổ
- Máy phát mẫu trung tâm
- Chronaxie
- Ếch pin
- Chỗ ở thần kinh
- Ghi âm đơn chiếc
- Mô hình Soliton trong khoa học thần kinh
Ghi chú
- ^ In general, while this simple description of action potential initiation is accurate, it does not explain phenomena such as excitation block (the ability to prevent neurons from eliciting action potentials by stimulating them with large current steps) and the ability to elicit action potentials by briefly hyperpolarizing the membrane. By analyzing the dynamics of a system of sodium and potassium channels in a membrane patch using computational models, however, these phenomena are readily explained.[α]
- ^ Note that these Purkinje fibers are muscle fibers and not related to the Purkinje cells, which are neurons found in the cerebellum.
Chú thích
- ^ Hodgkin AL, Huxley AF (1952). “A quantitative description of membrane current and its application to conduction and excitation in nerve”. The Journal of Physiology. 117 (4): 500–544. doi:10.1113/jphysiol.1952.sp004764. PMC 1392413. PMID 12991237.
- ^ . tr. 24 https://books.google.com.au/books?id=ZYxuAAAAQBAJ&pg=PT599&dq=Sodium-based+action+potentials+usually+last+for+under+one+millisecond#v=onepage&q=Sodium-based%20action%20potentials%20usually%20last%20for%20under%20one%20millisecond.
|title=trống hay bị thiếu (trợ giúp) - ^ Purves D, Augustine GJ, Fitzpatrick D, et al., editors. Neuroscience. 2nd edition. Sunderland (MA): Sinauer Associates; 2001. Voltage-Gated Ion Channels. Available from: “Archived copy”. Bản gốc lưu trữ ngày 5 tháng 6 năm 2018. Truy cập ngày 29 tháng 8 năm 2017.Quản lý CS1: bản lưu trữ là tiêu đề (liên kết)
- ^ a b c d e f g h Bullock, Orkand & Grinnell 1977, tr. 150–151.
- ^ a b c d e Junge 1981, tr. 89–90.
- ^ a b Schmidt-Nielsen 1997, tr. 484.
- ^ Stevens 1966, tr. 127.
- ^ Schmidt-Nielsen, p. 484.
- ^ Tamagawa, H; Funatani, M; Ikeda, K (2016). “Ling's Adsorption Theory as a Mechanism of Membrane Potential Generation Observed in Both Living and Nonliving Systems”. Membranes. 6 (1): 11. doi:10.3390/membranes6010011. PMC 4812417. PMID 26821050.
- ^ a b c Sanes, Dan H.; Reh, Thomas A (1 tháng 1 năm 2012). Development of the nervous system (Third Edition). Elsevier Academic Press. tr. 211–214. ISBN 9780080923208. OCLC 762720374.
- ^ Partridge, Donald (1991). Calcium Channels: Their Properties, Functions, Regulation, and Clinical relevance. CRC Press. tr. 138–142. ISBN 9780849388071.
- ^ Black, Ira (1984). Cellular and Molecular Biology of Neuronal Development | Ira Black | Springer (bằng tiếng Anh). Springer. tr. 103. ISBN 978-1-4613-2717-2. Bản gốc lưu trữ 17 tháng Bảy năm 2017.
- ^ Pedersen, Roger (1998). Current Topics in Developmental Biology, Volume 39. Elsevier Academic Press. ISBN 9780080584621.
- ^ Bullock, Orkand & Grinnell 1977, tr. 11.
- ^ Silverthorn 2010, tr. 253.
- ^ Schmidt-Nielsen 1997, tr. 483-484.
- ^ Purves và đồng nghiệp 2001.
- ^ Purves và đồng nghiệp 2008, tr. 26–28.
- ^ Junge 1981, tr. 115–132.
- ^ a b Bullock, Orkand & Grinnell 1977, tr. 152–153.
- ^ Bullock, Orkand & Grinnell 1977, tr. 444–445.
- ^ Purves và đồng nghiệp 2008, tr. 38.
- ^ Stevens 1966, tr. 127–128.
- ^ Purves và đồng nghiệp 2008, tr. 61–65.
- ^ Goldin, AL in Waxman 2007
- ^ Stevens 1966, tr. 49.
- ^ a b c Schmidt-Nielsen 1997, tr. 483–484.
- ^ a b c d Purves và đồng nghiệp 2008, tr. 49.
- ^ a b c d Stevens 1966, tr. 19–20.
- ^ a b Bullock, Orkand & Grinnell 1977, tr. 152.
- ^ Purves và đồng nghiệp 2008, tr. 37.
- ^ a b Purves và đồng nghiệp 2008, tr. 56.
- ^ Bullock, Orkand & Grinnell 1977, tr. 160–164.
- ^ Stevens 1966, tr. 21–23.
- ^ Bullock, Orkand & Grinnell 1977, tr. 161–164.
- ^ Bullock, Orkand & Grinnell 1977, tr. 509.
- ^ Tasaki, I in Field 1959
- ^ Schmidt-Nielsen 1997, Figure 12.13.
- ^ Bullock, Orkand & Grinnell 1977, tr. 163.
- ^ Waxman, SG in Waxman 2007
- ^ Segev, I; Fleshman, JW; Burke, RE in Koch & Segev 1989
- ^ Purves và đồng nghiệp 2008, tr. 52–53.
- ^ Ganong 1991, tr. 59–60.
- ^ Bohm, Jenifer; Scherzer, Sonke; Krol, Elzbita; Kreuzer, Ines; Meyer, Katharina von; Lorey, Christian; Mueller, Thomas D.; Shabala, Lana; Monte, Isabel (16 tháng 2 năm 2016). “The Venus Flytrap Dionaea muscipula Counts Prey-Induced Action Potentials to Induce Sodium Uptake”. Current Biology. 26 (3): 286–295. doi:10.1016/j.cub.2015.11.057. PMC 4751343. PMID 26804557.
- ^ Gradmann, D; Mummert, H in Spanswick, Lucas & Dainty 1980
- ^ Kristan, William B. (tháng 10 năm 2016). “Early evolution of neurons”. Current Biology. 26 (20): R949–R954. doi:10.1016/j.cub.2016.05.030. PMID 27780067.
- ^ Hellier, Jennifer L. (2014). The Brain, the Nervous System, and Their Diseases. ABC-Clio. tr. 532. ISBN 9781610693387.
- ^ Junge 1981, tr. 63–82.
- ^ Kettenmann & Grantyn 1992.
- ^ Snell, FM in Lavallee, Schanne & Hebert 1969
- ^ Finkelstein, Gabriel Ward. (2013). Emil du Bois-Reymond : neuroscience, self, and society in nineteenth-century Germany. Cambridge, Massachusetts. ISBN 9781461950325. OCLC 864592470.
- ^ Olesko, Kathryn M., and Frederic L. Holmes. "Experiment, Quantification and Discovery: Helmholtz’s Early Physiological Researches, 1843-50". In Hermann von Helmholtz and the Foundations of Nineteenth Century Science, ed. David Cahan, 50-108. Berkeley; Los Angeles; London: University of California, 1994.
- ^ Bernstein 1912.
- ^ Baranauskas, G.; Martina, M. (2006). “Sodium Currents Activate without a Hodgkin and Huxley-Type Delay in Central Mammalian Neurons”. J. Neurosci. 26 (2): 671–684. doi:10.1523/jneurosci.2283-05.2006. PMC 6674426. PMID 16407565.
- ^ Hoppensteadt 1986.
- ^ Sato, S; Fukai, H; Nomura, T; Doi, S in Reeke và đồng nghiệp 2005
* FitzHugh, R in Schwann 1969
* Guckenheimer & Holmes 1986 - ^ Biswas, Abhijit; Manivannan, M.; Srinivasan, Mandyam A. (2015). “Vibrotactile Sensitivity Threshold: Nonlinear Stochastic Mechanotransduction Model of the Pacinian Corpuscle”. IEEE Transactions on Haptics. 8 (1): 102–113. doi:10.1109/TOH.2014.2369422. PMID 25398183.
- ^ Getting, PA in Koch & Segev 1989
Tham khảo
Sách
Tạp chí bài báo
- ^ MacDonald PE, Rorsman P (tháng 2 năm 2006). “Oscillations, intercellular coupling, and insulin secretion in pancreatic beta cells”. PLOS Biol. 4 (2): e49. doi:10.1371/journal.pbio.0040049. PMC 1363709. PMID 16464129.

- ^ Barnett MW; Larkman PM (tháng 6 năm 2007). “The action potential”. Pract Neurol. 7 (3): 192–7. PMID 17515599. Bản gốc lưu trữ ngày 8 tháng 7 năm 2011.
- ^ Golding NL, Kath WL, Spruston N (tháng 12 năm 2001). “Dichotomy of action-potential backpropagation in CA1 pyramidal neuron dendrites”. J. Neurophysiol. 86 (6): 2998–3010. doi:10.1152/jn.2001.86.6.2998. PMID 11731556.
- ^ Sasaki, T., Matsuki, N., Ikegaya, Y. 2011 Action-potential modulation during axonal conduction Science 331 (6017), pp. 599–601
- ^ Aur, D.; Connolly, C.I.; Jog, M.S. (2005). “Computing spike directivity with tetrodes”. Journal of Neuroscience Methods. 149 (1): 57–63. doi:10.1016/j.jneumeth.2005.05.006. PMID 15978667.
- ^ Aur D., Jog, MS., 2010 Neuroelectrodynamics: Understanding the brain language, IOS Press, 2010. doi:10.3233/978-1-60750-473-3-i
- ^ Noble D (1960). “Cardiac action and pacemaker potentials based on the Hodgkin-Huxley equations”. Nature. 188 (4749): 495–497. Bibcode:1960Natur.188..495N. doi:10.1038/188495b0. PMID 13729365.
- ^ a b Goldman DE (1943). “Potential, impedance and rectification in membranes”. J. Gen. Physiol. 27 (1): 37–60. doi:10.1085/jgp.27.1.37. PMC 2142582. PMID 19873371.
- ^ a b c d e Hodgkin AL; Huxley AF; Katz B (1952). “Measurements of current-voltage relations in the membrane of the giant axon of Loligo”. Journal of Physiology. 116 (4): 424–448. doi:10.1113/jphysiol.1952.sp004716. PMC 1392219. PMID 14946712.
* Hodgkin AL (1952). “Currents carried by sodium and potassium ions through the membrane of the giant axon of Loligo”. Journal of Physiology. 116 (4): 449–472. doi:10.1113/jphysiol.1952.sp004717. PMC 1392213. PMID 14946713.
* Hodgkin AL (1952). “The components of membrane conductance in the giant axon of Loligo”. J Physiol. 116 (4): 473–496. doi:10.1113/jphysiol.1952.sp004718. PMC 1392209. PMID 14946714.
* Hodgkin AL; Huxley (1952). “The dual effect of membrane potential on sodium conductance in the giant axon of Loligo”. J Physiol. 116 (4): 497–506. doi:10.1113/jphysiol.1952.sp004719. PMC 1392212. PMID 14946715.
* Hodgkin AL; Huxley (1952). “A quantitative description of membrane current and its application to conduction and excitation in nerve”. J Physiol. 117 (4): 500–544. doi:10.1113/jphysiol.1952.sp004764. PMC 1392413. PMID 12991237. - ^ Naundorf B, Wolf F, Volgushev M (tháng 4 năm 2006). “Unique features of action potential initiation in cortical neurons” (PDF). Nature. 440 (7087): 1060–1063. Bibcode:2006Natur.440.1060N. doi:10.1038/nature04610. PMID 16625198.
- ^ Hodgkin AL (1937). “Evidence for electrical transmission in nerve, Part I”. Journal of Physiology. 90 (2): 183–210. doi:10.1113/jphysiol.1937.sp003507. PMC 1395060. PMID 16994885.
* Hodgkin AL (1937). “Evidence for electrical transmission in nerve, Part II”. Journal of Physiology. 90 (2): 211–32. doi:10.1113/jphysiol.1937.sp003508. PMC 1395062. PMID 16994886. - ^ Zalc B (2006). “The acquisition of myelin: a success story”. Novartis Found. Symp. Novartis Foundation Symposia. 276: 15–21, discussion 21–5, 54–7, 275–81. doi:10.1002/9780470032244.ch3. ISBN 978-0-470-03224-4. PMID 16805421.
- ^ S. Poliak; E. Peles (2006). “The local differentiation of myelinated axons at nodes of Ranvier”. Nature Reviews Neuroscience. 4 (12): 968–80. doi:10.1038/nrn1253. PMID 14682359.
- ^ Simons M, Trotter J (tháng 10 năm 2007). “Wrapping it up: the cell biology of myelination”. Curr. Opin. Neurobiol. 17 (5): 533–40. doi:10.1016/j.conb.2007.08.003. PMID 17923405.
- ^ Xu K, Terakawa S (1 tháng 8 năm 1999). “Fenestration nodes and the wide submyelinic space form the basis for the unusually fast impulse conduction of shrimp myelinated axons”. J. Exp. Biol. 202 (Pt 15): 1979–89. PMID 10395528.
- ^ a b Hursh JB (1939). “Conduction velocity and diameter of nerve fibers”. American Journal of Physiology. 127: 131–39. doi:10.1152/ajplegacy.1939.127.1.131.
- ^ Lillie RS (1925). “Factors affecting transmission and recovery in passive iron nerve model”. J. Gen. Physiol. 7 (4): 473–507. doi:10.1085/jgp.7.4.473. PMC 2140733. PMID 19872151. See also Keynes and Aidley, p. 78.
- ^ Lillie RS (1925). “Factors affecting transmission and recovery in passive iron nerve model”. J. Gen. Physiol. 7 (4): 473–507. doi:10.1085/jgp.7.4.473. PMC 2140733. PMID 19872151. See also Keynes and Aidley, p. 78.
- ^ a b Tasaki I (1939). “Electro-saltatory transmission of nerve impulse and effect of narcosis upon nerve fiber”. Am. J. Physiol. 127: 211–27. doi:10.1152/ajplegacy.1939.127.2.211.
- ^ a b Tasaki I, Takeuchi T (1941). “Der am Ranvierschen Knoten entstehende Aktionsstrom und seine Bedeutung für die Erregungsleitung”. Pflügers Archiv für die gesamte Physiologie. 244 (6): 696–711. doi:10.1007/BF01755414.
* Tasaki I, Takeuchi T (1942). “Weitere Studien über den Aktionsstrom der markhaltigen Nervenfaser und über die elektrosaltatorische Übertragung des nervenimpulses”. Pflügers Archiv für die gesamte Physiologie. 245 (5): 764–82. doi:10.1007/BF01755237. - ^ Huxley A (1949). “Evidence for saltatory conduction in peripheral myelinated nerve-fibers”. Journal of Physiology. 108 (3): 315–39. doi:10.1113/jphysiol.1949.sp004335. PMC 1392492. PMID 16991863.
* Huxley A (1949). “Direct determination of membrane resting potential and action potential in single myelinated nerve fibers”. Journal of Physiology. 112 (3–4): 476–95. doi:10.1113/jphysiol.1951.sp004545. PMC 1393015. PMID 14825228. - ^ Rushton WAH (1951). “A theory of the effects of fibre size in the medullated nerve”. Journal of Physiology. 115 (1): 101–22. doi:10.1113/jphysiol.1951.sp004655. PMC 1392008. PMID 14889433.
- ^ Hartline DK, Colman DR (2007). “Rapid conduction and the evolution of giant axons and myelinated fibers”. Curr. Biol. 17 (1): R29–R35. doi:10.1016/j.cub.2006.11.042. PMID 17208176.
- ^ Miller RH, Mi S (2007). “Dissecting demyelination”. Nat. Neurosci. 10 (11): 1351–54. doi:10.1038/nn1995. PMID 17965654.
- ^ Kelvin WT (1855). “On the theory of the electric telegraph”. Proceedings of the Royal Society. 7: 382–99. doi:10.1098/rspl.1854.0093.
- ^ Hodgkin AL (1946). “The electrical constants of a crustacean nerve fibre”. Proceedings of the Royal Society B. 133 (873): 444–79. Bibcode:1946RSPSB.133..444H. doi:10.1098/rspb.1946.0024. PMID 20281590.
- ^ Süudhof TC (2008). “Neurotransmitter release”. Handb Exp Pharmacol. Handbook of Experimental Pharmacology. 184 (184): 1–21. doi:10.1007/978-3-540-74805-2_1. ISBN 978-3-540-74804-5. PMID 18064409.
- ^ Rusakov DA (tháng 8 năm 2006). “Ca2+-dependent mechanisms of presynaptic control at central synapses”. Neuroscientist. 12 (4): 317–26. doi:10.1177/1073858405284672. PMC 2684670. PMID 16840708.
- ^ Humeau Y, Doussau F, Grant NJ, Poulain B (tháng 5 năm 2000). “How botulinum and tetanus neurotoxins block neurotransmitter release”. Biochimie. 82 (5): 427–46. doi:10.1016/S0300-9084(00)00216-9. PMID 10865130.
- ^ Zoidl G, Dermietzel R (2002). “On the search for the electrical synapse: a glimpse at the future”. Cell Tissue Res. 310 (2): 137–42. doi:10.1007/s00441-002-0632-x. PMID 12397368.
- ^ Brink PR, Cronin K, Ramanan SV (1996). “Gap junctions in excitable cells”. J. Bioenerg. Biomembr. 28 (4): 351–8. doi:10.1007/BF02110111. PMID 8844332.
- ^ Hirsch NP (tháng 7 năm 2007). “Neuromuscular junction in health and disease”. Br J Anaesth. 99 (1): 132–8. doi:10.1093/bja/aem144. PMID 17573397. Bản gốc lưu trữ ngày 16 tháng 7 năm 2012.
- ^ Hughes BW, Kusner LL, Kaminski HJ (tháng 4 năm 2006). “Molecular architecture of the neuromuscular junction”. Muscle Nerve. 33 (4): 445–61. doi:10.1002/mus.20440. PMID 16228970.
- ^ a b c Newmark J (2007). “Nerve agents”. Neurologist. 13 (1): 20–32. doi:10.1097/01.nrl.0000252923.04894.53. PMID 17215724.
- ^ Costa LG (2006). “Current issues in organophosphate toxicology”. Clin. Chim. Acta. 366 (1–2): 1–13. doi:10.1016/j.cca.2005.10.008. PMID 16337171.
- ^ a b Kléber AG, Rudy Y (tháng 4 năm 2004). “Basic mechanisms of cardiac impulse propagation and associated arrhythmias”. Physiol. Rev. 84 (2): 431–88. doi:10.1152/physrev.00025.2003. PMID 15044680.
- ^ Tamargo J, Caballero R, Delpón E (tháng 1 năm 2004). “Pharmacological approaches in the treatment of atrial fibrillation”. Curr. Med. Chem. 11 (1): 13–28. doi:10.2174/0929867043456241. PMID 14754423.
- ^ Slayman CL, Long WS, Gradmann D (1976). “Action potentials in Neurospora crassa, a mycelial fungus”. Biochimica et Biophysica Acta. 426 (4): 737–744. doi:10.1016/0005-2736(76)90138-3. PMID 130926.
- ^ Mummert H, Gradmann D (1991). “Action potentials in Acetabularia: measurement and simulation of voltage-gated fluxes”. Journal of Membrane Biology. 124 (3): 265–273. doi:10.1007/BF01994359. PMID 1664861.
- ^ Gradmann D (2001). “Models for oscillations in plants”. Aust. J. Plant Physiol. 28 (7): 577–590. doi:10.1071/pp01017.
- ^ Beilby MJ (2007). “Action potentials in charophytes”. Int. Rev. Cytol. International Review of Cytology. 257: 43–82. doi:10.1016/S0074-7696(07)57002-6. ISBN 978-0-12-373701-4. PMID 17280895.
- ^ Gradmann D, Hoffstadt J (1998). “Electrocoupling of ion transporters in plants: Interaction with internal ion concentrations”. Journal of Membrane Biology. 166 (1): 51–59. doi:10.1007/s002329900446. PMID 9784585.
- ^ Fromm J, Lautner S (2007). “Electrical signals and their physiological significance in plants”. Plant Cell Environ. 30 (3): 249–257. doi:10.1111/j.1365-3040.2006.01614.x. PMID 17263772.
- ^ Leys SP, Mackie GO, Meech RW (1 tháng 5 năm 1999). “Impulse conduction in a sponge”. J. Exp. Biol. 202 (9): 1139–50. PMID 10101111.
- ^ Keynes RD (1989). “The role of giant axons in studies of the nerve impulse”. BioEssays. 10 (2–3): 90–93. doi:10.1002/bies.950100213. PMID 2541698.
- ^ Meunier C, Segev I (2002). “Playing the devil's advocate: is the Hodgkin-Huxley model useful?”. Trends Neurosci. 25 (11): 558–63. doi:10.1016/S0166-2236(02)02278-6. PMID 12392930.
- ^ Cole KS (1949). “Dynamic electrical characteristics of the squid axon membrane”. Arch. Sci. Physiol. 3: 253–8.
- ^ Ling G, Gerard RW (1949). “The normal membrane potential of frog sartorius fibers”. J. Cell. Comp. Physiol. 34 (3): 383–396. doi:10.1002/jcp.1030340304. PMID 15410483.
- ^ Nastuk WL (1950). “The electrical activity of single muscle fibers”. J. Cell. Comp. Physiol. 35: 39–73. doi:10.1002/jcp.1030350105.
- ^ Brock LG, Coombs JS, Eccles JC (1952). “The recording of potentials from motoneurones with an intracellular electrode”. J. Physiol. 117 (4): 431–460. doi:10.1113/jphysiol.1952.sp004759. PMC 1392415. PMID 12991232.
- ^ Ross WN, Salzberg BM, Cohen LB, Davila HV (1974). “A large change in dye absorption during the action potential”. Biophysical Journal. 14 (12): 983–986. Bibcode:1974BpJ....14..983R. doi:10.1016/S0006-3495(74)85963-1. PMC 1334592. PMID 4429774.
* Grynkiewicz G, Poenie M, Tsien RY (1985). “A new generation of Ca2+ indicators with greatly improved fluorescence properties”. J. Biol. Chem. 260 (6): 3440–3450. PMID 3838314. - ^ Bu G, Adams H, Berbari EJ, Rubart M (tháng 3 năm 2009). “Uniform action potential repolarization within the sarcolemma of in situ ventricular cardiomyocytes”. Biophys. J. 96 (6): 2532–46. Bibcode:2009BpJ....96.2532B. doi:10.1016/j.bpj.2008.12.3896. PMC 2907679. PMID 19289075.
- ^ Nakamura Y, Nakajima S, Grundfest H (1965). “The effect of tetrodotoxin on electrogenic components of squid giant axons”. J. Gen. Physiol. 48 (6): 985–996. doi:10.1085/jgp.48.6.975. PMC 2195447. PMID 5855511.
* Ritchie JM, Rogart RB (1977). “The binding of saxitoxin and tetrodotoxin to excitable tissue”. Rev. Physiol. Biochem. Pharmacol. Reviews of Physiology, Biochemistry and Pharmacology. 79: 1–50. doi:10.1007/BFb0037088. ISBN 0-387-08326-X. PMID 335473.
* Keynes RD, Ritchie JM (1984). “On the binding of labelled saxitoxin to the squid giant axon”. Proc. R. Soc. Lond. 239 (1227): 393–434. Bibcode:1984RSPSB.222..147K. doi:10.1098/rspb.1984.0055. PMID 6148754. - ^ a b Piccolino M (1997). “Luigi Galvani and animal electricity: two centuries after the foundation of electrophysiology”. Trends in Neurosciences. 20 (10): 443–448. doi:10.1016/S0166-2236(97)01101-6. PMID 9347609.
- ^ Piccolino M (2000). “The bicentennial of the Voltaic battery (1800–2000): the artificial electric organ”. Trends in Neurosciences. 23 (4): 147–151. doi:10.1016/S0166-2236(99)01544-1. PMID 10717671.
- ^ Bernstein J (1902). “Untersuchungen zur Thermodynamik der bioelektrischen Ströme”. Pflügers Archiv für die gesamte Physiologie. 92 (10–12): 521–562. doi:10.1007/BF01790181.
- ^ Cole KS (1939). “Electrical impedance of the squid giant axon during activity”. J. Gen. Physiol. 22 (5): 649–670. doi:10.1085/jgp.22.5.649. PMC 2142006. PMID 19873125.
- ^ Lapicque L (1907). “Recherches quantitatives sur l'excitationelectrique des nerfs traitee comme une polarisation”. J. Physiol. Pathol. Gen. 9: 620–635.
- ^ Hodgkin AL; Katz B (1949). “The effect of sodium ions on the electrical activity of the giant axon of the squid”. Journal of Physiology. 108 (1): 37–77. doi:10.1113/jphysiol.1949.sp004310. PMC 1392331. PMID 18128147.
- ^ Neher E; Sakmann (1976). “Single-channel currents recorded from membrane of denervated frog muscle fibres”. Nature. 260 (5554): 779–802. Bibcode:1976Natur.260..799N. doi:10.1038/260799a0. PMID 1083489.
* Hamill OP (1981). “Improved patch-clamp techniques for high-resolution current recording from cells and cell-free membrane patches”. Pflügers Arch. 391 (2): 85–100. doi:10.1007/BF00656997. PMID 6270629.
* Neher E (1992). “The patch clamp technique”. Scientific American. 266 (3): 44–51. Bibcode:1992SciAm.266c..44N. doi:10.1038/scientificamerican0392-44. PMID 1374932. - ^ Yellen G (2002). “The voltage-gated potassium channels and their relatives”. Nature. 419 (6902): 35–42. Bibcode:2002Natur.419...35Y. doi:10.1038/nature00978. PMID 12214225.
- ^ a b Doyle DA; Morais Cabral J; Pfuetzner RA; Kuo A; Gulbis JM; Cohen SL; Chait, BT; MacKinnon, R (1998). “The structure of the potassium channel, molecular basis of K+ conduction and selectivity”. Science. 280 (5360): 69–77. Bibcode:1998Sci...280...69D. doi:10.1126/science.280.5360.69. PMID 9525859. Đã bỏ qua tham số không rõ
|displayauthors=(gợi ý|display-authors=) (trợ giúp)
* Zhou Y, Morias-Cabrak JH, Kaufman A, MacKinnon R (2001). “Chemistry of ion coordination and hydration revealed by a K+-Fab complex at 2.0 A resolution”. Nature. 414 (6859): 43–48. Bibcode:2001Natur.414...43Z. doi:10.1038/35102009. PMID 11689936.
* Jiang Y, Lee A, Chen J, Ruta V, Cadene M, Chait BT, MacKinnon R (2003). “X-ray structure of a voltage-dependent K+ channel”. Nature. 423 (6935): 33–41. Bibcode:2003Natur.423...33J. doi:10.1038/nature01580. PMID 12721618. - ^ Cha A, Snyder GE, Selvin PR, Bezanilla F (1999). “Atomic-scale movement of the voltage-sensing region in a potassium channel measured via spectroscopy”. Nature. 402 (6763): 809–813. Bibcode:1999Natur.402..809C. doi:10.1038/45552. PMID 10617201.
* Glauner KS, Mannuzzu LM, Gandhi CS, Isacoff E (1999). “Spectroscopic mapping of voltage sensor movement in the Shaker potassium channel”. Nature. 402 (6763): 813–817. Bibcode:1999Natur.402..813G. doi:10.1038/45561. PMID 10617202.
* Bezanilla F (2000). “The voltage sensor in voltage-dependent ion channels”. Physiol. Rev. 80 (2): 555–592. doi:10.1152/physrev.2000.80.2.555. PMID 10747201. - ^ Catterall WA (2001). “A 3D view of sodium channels”. Nature. 409 (6823): 988–999. Bibcode:2001Natur.409..988C. doi:10.1038/35059188. PMID 11234048.
* Sato C; Ueno Y; Asai K; Takahashi K; Sato M; Engel A; Fujiyoshi, Yoshinori (2001). “The voltage-sensitive sodium channel is a bell-shaped molecule with several cavities”. Nature. 409 (6823): 1047–1051. Bibcode:2001Natur.409.1047S. doi:10.1038/35059098. PMID 11234014. Đã bỏ qua tham số không rõ|displayauthors=(gợi ý|display-authors=) (trợ giúp) - ^ Skou J (1957). “The influence of some cations on an adenosine triphosphatase from peripheral nerves”. Biochim Biophys Acta. 23 (2): 394–401. doi:10.1016/0006-3002(57)90343-8. PMID 13412736.
- ^ Hodgkin AL; Keynes (1955). “Active transport of cations in giant axons from Sepia and Loligo”. J. Physiol. 128 (1): 28–60. doi:10.1113/jphysiol.1955.sp005290. PMC 1365754. PMID 14368574.
- ^ Caldwell PC; Hodgkin; Keynes; Shaw (1960). “The effects of injecting energy-rich phosphate compounds on the active transport of ions in the giant axons of Loligo”. J. Physiol. 152 (3): 561–90. doi:10.1113/jphysiol.1960.sp006509. PMC 1363339. PMID 13806926.
- ^ Caldwell PC, Keynes RD (1957). “The utilization of phosphate bond energy for sodium extrusion from giant axons”. J. Physiol. 137 (1): 12–13P. doi:10.1113/jphysiol.1957.sp005830. PMID 13439598.
- ^ Morth JP, Pedersen PB, Toustrup-Jensen MS, Soerensen TL, Petersen J, Andersen JP, Vilsen B, Nissen P (2007). “Crystal structure of the sodium–potassium pump”. Nature. 450 (7172): 1043–1049. Bibcode:2007Natur.450.1043M. doi:10.1038/nature06419. PMID 18075585.
- ^ Lee AG, East JM (2001). “What the structure of a calcium pump tells us about its mechanism”. Biochemical Journal. 356 (Pt 3): 665–683. doi:10.1042/0264-6021:3560665. PMC 1221895. PMID 11389676.
- ^ FitzHugh R (1960). “Thresholds and plateaus in the Hodgkin-Huxley nerve equations”. J. Gen. Physiol. 43 (5): 867–896. doi:10.1085/jgp.43.5.867. PMC 2195039. PMID 13823315.
* Kepler TB, Abbott LF, Marder E (1992). “Reduction of conductance-based neuron models”. Biological Cybernetics. 66 (5): 381–387. doi:10.1007/BF00197717. PMID 1562643. - ^ a b Morris C, Lecar H (1981). “Voltage oscillations in the barnacle giant muscle fiber”. Biophysical Journal. 35 (1): 193–213. Bibcode:1981BpJ....35..193M. doi:10.1016/S0006-3495(81)84782-0. PMC 1327511. PMID 7260316.
- ^ FitzHugh R (1961). “Impulses and physiological states in theoretical models of nerve membrane”. Biophysical Journal. 1 (6): 445–466. Bibcode:1961BpJ.....1..445F. doi:10.1016/S0006-3495(61)86902-6. PMC 1366333. PMID 19431309.
* Nagumo J, Arimoto S, Yoshizawa S (1962). “An active pulse transmission line simulating nerve axon”. Proceedings of the IRE. 50 (10): 2061–2070. doi:10.1109/JRPROC.1962.288235. - ^ Bonhoeffer KF (1948). “Activation of Passive Iron as a Model for the Excitation of Nerve”. J. Gen. Physiol. 32 (1): 69–91. doi:10.1085/jgp.32.1.69. PMC 2213747. PMID 18885679.
* Bonhoeffer KF (1953). “Modelle der Nervenerregung”. Naturwissenschaften. 40 (11): 301–311. Bibcode:1953NW.....40..301B. doi:10.1007/BF00632438.
* van der Pol B (1926). “On relaxation-oscillations”. Philosophical Magazine. 2: 977–992.
* van der Pol B; van der Mark J (1928). “The heartbeat considered as a relaxation oscillation, and an electrical model of the heart”. Philosophical Magazine. 6: 763–775. doi:10.1080/14786441108564652.
* van der Pol B; van der Mark J (1929). “The heartbeat considered as a relaxation oscillation, and an electrical model of the heart”. Arch. Neerl. Physiol. 14: 418–443. - ^ Evans JW (1972). “Nerve axon equations. I. Linear approximations”. Indiana Univ. Math. J. 21 (9): 877–885. doi:10.1512/iumj.1972.21.21071.
* Evans JW, Feroe J (1977). “Local stability theory of the nerve impulse”. Math. Biosci. 37: 23–50. doi:10.1016/0025-5564(77)90076-1. - ^ Evans JW (1972). “Nerve axon equations. I. Linear approximations”. Indiana Univ. Math. J. 21 (9): 877–885. doi:10.1512/iumj.1972.21.21071.
* Evans JW, Feroe J (1977). “Local stability theory of the nerve impulse”. Math. Biosci. 37: 23–50. doi:10.1016/0025-5564(77)90076-1. - ^ Keener JP (1983). “Analogue circuitry for the van der Pol and FitzHugh-Nagumo equations”. IEEE Transactions on Systems, Man and Cybernetics. 13 (5): 1010–1014. doi:10.1109/TSMC.1983.6313098.
- ^ Hooper SL (tháng 3 năm 2000). “Central pattern generators”. Curr. Biol. 10 (5): R176–R179. CiteSeerX 10.1.1.133.3378. doi:10.1016/S0960-9822(00)00367-5. PMID 10713861.
trang web
- ^ Fitzhugh, Richard; Izhikevich, Eugene (2006). “FitzHugh-Nagumo model”. Scholarpedia. 1 (9): 1349. Bibcode:2006SchpJ...1.1349I. doi:10.4249/scholarpedia.1349.
- ^ “The Nobel Prize in Physiology or Medicine 1963” (Thông cáo báo chí). The Royal Swedish Academy of Science. Bản gốc lưu trữ ngày 16 tháng 7 năm 2007. Truy cập ngày 21 tháng 2 năm 2010.
- ^ “The Nobel Prize in Physiology or Medicine 1991” (Thông cáo báo chí). The Royal Swedish Academy of Science. Bản gốc lưu trữ ngày 24 tháng 3 năm 2010. Truy cập ngày 21 tháng 2 năm 2010.
- ^ “The Nobel Prize in Physiology or Medicine 1906” (Thông cáo báo chí). The Royal Swedish Academy of Science. Bản gốc lưu trữ ngày 4 tháng 12 năm 2008. Truy cập ngày 21 tháng 2 năm 2010.
- ^ Warlow, Charles (tháng 6 năm 2007). “The Recent Evolution of a Symbiotic Ion Channel in the Legume Family Altered Ion Conductance and Improved Functionality in Calcium Signaling”. Practical Neurology. BMJ Publishing Group. 7 (3): 192–197. Bản gốc lưu trữ ngày 14 tháng 3 năm 2012. Truy cập ngày 23 tháng 3 năm 2013.
- ^ “The Nobel Prize in Chemistry 1997” (Thông cáo báo chí). The Royal Swedish Academy of Science. Bản gốc lưu trữ ngày 23 tháng 10 năm 2009. Truy cập ngày 21 tháng 2 năm 2010.
đọc thêm
liên kết ngoài
- Ảnh động
- Dòng ion trong điện thế hoạt động tại Blackwell Publishing
- Sự lan truyền điện thế hoạt động trong các sợi trục có bao myelin và không myelin tại Blackwell Publishing
- Tạo AP trong tế bào tim và tạo AP trong neuron
- điện thế màng nghỉ từ cuộc sống: Khoa học sinh học, của WK Purves, D Sadava, GH Orians, và HC Heller, ấn bản thứ 8, New York: WH Freeman, ISBN 978-0-7167-7671-0 .
- Chuyển động ion và điện thế Goldman cho nồng độ ion tùy ý tại Đại học Arizona
- Một phim hoạt hình minh họa điện thế hoạt động
- Tuyên truyền điện thế hoạt động
- Sản xuất điện thế hoạt động: mô phỏng kẹp điện thế và dòng điện [ liên kết chết vĩnh viễn ][ liên kết chết vĩnh viễn ]
- Phần mềm nguồn mở để mô phỏng điện thế hoạt động của neuron và tim tại SourceForge.net
- Giới thiệu về điện thế hoạt động, Khoa học thần kinh trực tuyến (sách giáo khoa khoa học thần kinh điện tử của Trường Y khoa UT Houston)
- Khan Academy: Electrotonic và điện thế hoạt động
[[Thể loại:Sinh học màng]] [[Thể loại:Quá trình tế bào]] [[Thể loại:Điện hóa]] [[Thể loại:Tụ điện]] [[Thể loại:Pages with unreviewed translations]]




