Etynodiol diacetate
 | |
| Dữ liệu lâm sàng | |
|---|---|
| Tên thương mại | Continuin, Demulen, Femulen, Luteonorm, Luto-Metrodiol, Metrodiol, Ovulen, others |
| Đồng nghĩa | Ethynodiol diacetate; Norethindrol diacetate; 3β-Hydroxynorethisterone 3β,17β-diacetate;[1] 17α-Ethynylestr-4-ene-3β,17β-diyl diacetate; CB-8080; SC-11800 |
| Dược đồ sử dụng | By mouth |
| Mã ATC | |
| Tình trạng pháp lý | |
| Tình trạng pháp lý |
|
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS |
|
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| ECHA InfoCard | 100.005.496 |
| Dữ liệu hóa lý | |
| Công thức hóa học | C24H32O4 |
| Khối lượng phân tử | 384.509 g/mol |
| Mẫu 3D (Jmol) | |
SMILES
| |
Định danh hóa học quốc tế
| |
Etynodiol diacetate, hoặc ethynodiol diacetate, được bán dưới tên thương hiệu Demulen và Femulen cùng với những loại khác, là một loại thuốc proestin được sử dụng trong thuốc tránh thai.[2][3][4] Thuốc chỉ có sẵn kết hợp với estrogen.[5] Nó được dùng bằng đường uống.[6]
Diacetate Etynodiol là một progestin, hoặc một tổng hợp progestogen, và do đó là một chất chủ vận của thụ thể progesterone, các đích sinh học của progestogen như progesterone.[7][8] Nó có hoạt động androgenic và estrogen yếu và không có hoạt động nội tiết tố quan trọng khác.[9][10][11] Thuốc là một tiền chất của norethisterone trong cơ thể, với etynodiol xảy ra như một chất trung gian.[7][8][12]
Etynodiol, một hợp chất có liên quan, được phát hiện vào năm 1954 và etynodiol diacetate đã được giới thiệu cho mục đích y tế vào năm 1965.[13][14] Thuốc vẫn có sẵn ngày hôm nay chỉ ở Hoa Kỳ, Canada và một số quốc gia khác.[4][5]
Sử dụng trong y tế[sửa | sửa mã nguồn]
Etynodiol diacetate được sử dụng kết hợp với estrogen như ethinylestradiol hoặc mestranol trong thuốc tránh thai kết hợp cho phụ nữ.[6]
Tác dụng phụ[sửa | sửa mã nguồn]
Dược lý[sửa | sửa mã nguồn]

Etynodiol diacetate hầu như không hoạt động về mặt ái lực đối với các thụ thể progesterone và androgen và hoạt động như một tiền chất được chuyển đổi nhanh chóng của norethisterone, với etynodiol xảy ra như một chất trung gian.[7][8][12] Sau khi uống và trong quá trình chuyển hóa đầu tiên ở gan, etynodiol diacetate nhanh chóng được chuyển hóa bởi các este thành etynodiol,[12] sau đó là oxy hóa nhóm hydroxyl để sản xuất norethisterone.[8] Ngoài hoạt động proogenogen của nó, etynodiol diacetate có hoạt tính androgen yếu,[9][10] và, không giống như hầu hết các proestin nhưng tương tự như norethisterone và noretynodrel,[15] cũng có một số hoạt động estrogen.[10][11]
Dược động học của etynodiol diacetate đã được xem xét.[16]
Hóa học[sửa | sửa mã nguồn]
Etynodiol diacetate, còn được gọi là 3β-hydroxy-17α-ethynyl-19-nortestosterone 3β, 17β-diaceate, 3β-hydroxynorethisterone 3β, 17β-diacetate, hoặc 17α-ethynylestr-3, 17 diacetate, là một steroid estrane tổng hợp và là một dẫn xuất của testosterone.[3][4] Nó đặc biệt là một dẫn xuất của 19-nortestosterone và 17α-ethynyltestosterone, hoặc của norethisterone (17α-ethynyl-19-nortestosterone), trong đó nhóm ketone C3 đã được khử hydro thành nhóm hydroxyl và axetat este và vị trí C17β.[3][4] Etynodiol diacetate là este 3β, 17β- diaxetat của etynodiol (17α-ethynylestr-4-ene-3β, 17β-diol).[3][4]
Tổng hợp[sửa | sửa mã nguồn]
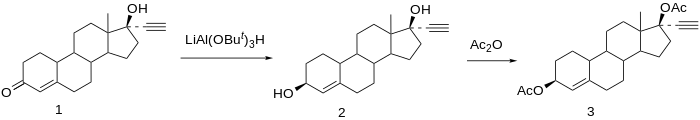
Tổng hợp hóa học của etynodiol diacetate đã được công bố.[16]
Giảm norethisterone (1) gắn 3,17-diol. Hợp chất 3β-hydroxy là sản phẩm mong muốn; do các phản ứng tại C3 không thể hiện gần như tính chất lập thể như các phản ứng tại C17 do thiếu các nhóm thế trực tiếp âm thanh nổi tương đối, nên sự hình thành các đồng phân mong muốn được sử dụng bằng chất khử cồng kềnh, hydrat tri-tert-butoxyalumin hydride. Acetyl hóa của 3β, 17β-diol liên kết etynodiol diacetate (3).[17]
Lịch sử[sửa | sửa mã nguồn]
Etynodiol được tổng hợp lần đầu tiên vào năm 1954, thông qua việc khử norethisterone và etynodiol diacetate đã được giới thiệu cho sử dụng y tế vào năm 1965.[13][14]
Xã hội và văn hoá[sửa | sửa mã nguồn]
Tên gốc[sửa | sửa mã nguồn]
Etynodiol diacetate là tên gốc của thuốc (INN của dạng rượu tự do là etynodiol), trong khi ethynodiol diacetate là USAN, BAN và JAN.[3][4][5] Nó cũng được biết đến với tên mã phát triển trước đây là CB-8080 và SC-11800.[3][4][5]
Tên thương hiệu[sửa | sửa mã nguồn]
Etynodiol diacetate đang hoặc đã được bán trên thị trường dưới tên thương hiệu bao gồm Conova, Continuin, Demulen, Femulen, Kelnor, Luteonorm, Luto-Metrodiol, Metrodiol, Ovulen, Soluna, Zovia, và những người khác.[3][4][5]
Khả dụng[sửa | sửa mã nguồn]
Etynodiol diacetate vẫn chỉ được bán ở một số quốc gia, bao gồm Hoa Kỳ, Canada, Argentina và Ô-man.[5]
Tham khảo[sửa | sửa mã nguồn]
- ^ Schindler, Adolf E; Campagnoli, Carlo; Druckmann, René; Huber, Johannes; Pasqualini, Jorge R; Schweppe, Karl W; Thijssen, Jos H.H (2003). “Classification and pharmacology of progestins”. Maturitas. 46: 7–16. doi:10.1016/j.maturitas.2003.09.014. ISSN 0378-5122. PMID 14670641.
- ^ Donna Shoupe; Florence P. Haseltine (ngày 6 tháng 12 năm 2012). Contraception. Springer Science & Business Media. tr. 21–. ISBN 978-1-4612-2730-4.
- ^ a b c d e f g J. Elks (ngày 14 tháng 11 năm 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. tr. 522–. ISBN 978-1-4757-2085-3.
- ^ a b c d e f g h Index Nominum 2000: International Drug Directory. Taylor & Francis US. 2000. tr. 422. ISBN 978-3-88763-075-1. Truy cập ngày 30 tháng 5 năm 2012.
- ^ a b c d e f “Bản sao đã lưu trữ”. Bản gốc lưu trữ ngày 5 tháng 2 năm 2018. Truy cập ngày 22 tháng 8 năm 2019.
- ^ a b Robert W. Blum (ngày 22 tháng 10 năm 2013). Adolescent Health Care: Clinical Issues. Elsevier Science. tr. 216–. ISBN 978-1-4832-7738-7.
- ^ a b c Hammerstein J (1990). “Prodrugs: advantage or disadvantage?”. Am. J. Obstet. Gynecol. 163 (6 Pt 2): 2198–203. PMID 2256526.
- ^ a b c d IARC Working Group on the Evaluation of Carcinogenic Risks to Humans; World Health Organization; International Agency for Research on Cancer (2007). Combined Estrogen-progestogen Contraceptives and Combined Estrogen-progestogen Menopausal Therapy. World Health Organization. tr. 146–. ISBN 978-92-832-1291-1.
- ^ a b Armen H. Tashjian; Ehrin J. Armstrong (ngày 21 tháng 7 năm 2011). Principles of Pharmacology: The Pathophysiologic Basis of Drug Therapy. Lippincott Williams & Wilkins. tr. 523–. ISBN 978-1-4511-1805-6.
- ^ a b c Kenneth L. Becker (ngày 24 tháng 4 năm 2001). Principles and Practice of Endocrinology and Metabolism. Lippincott Williams & Wilkins. tr. 1004. ISBN 978-0-7817-1750-2. Truy cập ngày 30 tháng 5 năm 2012.
- ^ a b Allan H. Goroll; Albert G. Mulley (ngày 27 tháng 1 năm 2009). Primary Care Medicine: Office Evaluation and Management of the Adult Patient. Lippincott Williams & Wilkins. tr. 876. ISBN 978-0-7817-7513-7. Truy cập ngày 30 tháng 5 năm 2012.
- ^ a b c Stanczyk FZ (2002). “Pharmacokinetics and potency of progestins used for hormone replacement therapy and contraception”. Rev Endocr Metab Disord. 3 (3): 211–24. doi:10.1023/A:1020072325818. PMID 12215716.
- ^ a b Progress in Medicinal Chemistry. Butterworth-Heinemann. ngày 21 tháng 9 năm 2011. tr. 180–. ISBN 978-0-08-086256-9.
- ^ a b William Andrew Publishing (ngày 22 tháng 10 năm 2013). Pharmaceutical Manufacturing Encyclopedia, 3rd Edition. Elsevier. tr. 1516–. ISBN 978-0-8155-1856-3.
- ^ Benno Clemens Runnebaum; Thomas Rabe; Ludwig Kiesel (ngày 6 tháng 12 năm 2012). Female Contraception: Update and Trends. Springer Science & Business Media. tr. 36–. ISBN 978-3-642-73790-9.
- ^ a b Die Gestagene. Springer-Verlag. ngày 27 tháng 11 năm 2013. tr. 14–15, 286. ISBN 978-3-642-99941-3.
- ^ a b Klimstra, P.; Colton, F. (1967). “The synthesis of 3β-hydroxyestr-4-en-17-one and 3β-hydroxiandrost-4-en-17-one”. Steroids. 10 (4): 411–424. doi:10.1016/0039-128X(67)90119-5.
- ^ Sondheimer, F.; Klibansky, Y. (1959). “Synthesis of 3β-hydroxy analogues of steroidal hormones, a biologically active class of compounds”. Tetrahedron. 5: 15–26. doi:10.1016/0040-4020(59)80066-1.
