Tinh thể học tia X
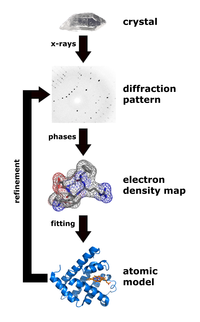
Tinh thể học tia X là ngành khoa học xác định sự sắp xếp của các nguyên tử bên trong một tinh thể dựa vào dữ liệu về sự phân tán của các tia X sau khi chiếu vào các electron của tinh thể. Sau khi xây dựng được hình ảnh 3 chiều của mật độ các electron bên trong tinh thể, vị trí của nguyên tử tính trung bình, các liên kết hóa học... có thể được thu thập.
Bước quan trọng trong tinh thể học tia X là sự nhiễu xạ tia X từ tinh thể. Một tinh thể là một vật rắn với các nguyên tử bên trong có trật tự cố định và được lặp đi lặp lại dọc theo 3 hướng chính gọi là vector cơ sở hay vector lưới (bais hay lattice). Nhiều chất có thể chuyển về dạng tinh thể như muối, kim loại, khoáng chất, chất bán dẫn, cũng như các phân tử vô cơ, hữu cơ hay sinh học khác.
Sau khi thu được dạng tinh thể của một chất, nó sẽ được treo lên máy đo góc (goniometer) và được bắn tia X vào, tạo ra các mẫu nhiễu xạ của các điểm gọi là điểm phản xạ. Tiếp, tinh thể sẽ được xoay tròn từ từ (theo một độ dời góc nhất định) và cứ mỗi lần xoay ta lại thu thập một mẫu nhiễu xạ mới. Tập hợp các ảnh 2D này sẽ được chuyển thành một mô hình 3D về mật độ của các electron bên trong tinh thể nhờ phương pháp toán học biến đổi Fourier và dữ liệu hóa học của mẫu (tức là ta đã biết thành phần hóa học của chất). Từ đó, có thể suy ra vị trí của các nhân nguyên tử mật độ electron và dữ liệu hóa học.
Tổng quan về nhiễu xạ tia X đơn tinh thể[sửa | sửa mã nguồn]
Phương pháp lâu đời nhất và chính xác nhất của tinh thể học tia X là nhiễu xạ tia X đơn tinh thể, trong đó chùm tia X bị bản hồi từ các mặt phẳng có khoảng cách đều nhau của một đơn tinh thể, tạo ra một mẫu nhiễu xạ gồm các điểm gọi là nhiễu xạ. Mỗi nhiễu xạ tương ứng với một tập các mặt phẳng có khoảng cách đều nhau bên trong tinh thể. Mật độ các electron bên trong tinh thể được xác định từ vị trí và độ sáng của các nhiễu xạ khác nhau quan sát được khi tinh thể từ từ xoay quanh chùm tia X; mật độ này, cùng với dữ liệu bổ sung (về thành phần hóa học), cho phép ta xác định vị trí của các nguyên tử bên trong tinh thể. Nó có thể xác định lực liên kết hóa học trung bình giữa các nguyên tử và góc giữa chúng trong khoảng vài ngàn Ångström và vài chục độ.
Thủ tục[sửa | sửa mã nguồn]
Kĩ thuật nhiễu xạ tia X đơn tinh thể có 3 bước chính. Đầu tiên - khó nhất - là thu thập một tinh thể tốt. Tinh thể phải đủ lớn (thường là lớn hơn 100 micron ở mọi chiều), không có tạp chất và có cấu trúc ổn định, không bị nứt nẻ.
Bước hai, đặt tinh thể vào trong đường đi của chùm tia X cực mạnh, thường có bước sóng đơn (monochromatic X-rays), để tạo ra các mẫu nhiễu sắc. Tinh thể từ từ xoay và dữ liệu được thu thập lại. Mỗi ảnh chứa hàng chục ngàn điểm nhiễu xạ với các cường độ khác nhau.
Bước ba, dùng kĩ thuật tính toán và dữ liệu hóa học bổ sung để đưa ra mô hình về sự sắp xếp các nguyên tử bên trong tinh thể. Kết quả có thể được lưu trữ ở các CSDL công cộng.
Hạn chế[sửa | sửa mã nguồn]
Lịch sử[sửa | sửa mã nguồn]
Sơ lược về tinh thể và tia X[sửa | sửa mã nguồn]

Các tinh thể từ lâu đã nổi tiếng về tính sắp xếp theo quy luật và đối xứng, nhưng chưa được nghiên cứu một cách khoa học mãi cho tới thế kỉ 17. Johannes Kepler đã đưa ra giả thuyết trong cuốn Strena seu de Nive Sexangula (1611) rằng tính đối xứng lục giác của tinh thể bông tuyết là do sự đóng gói theo quy luật của các phân tử nước hình cầu[1].

Nicolas Steno (1669) là người đầu tiên thử nghiệm tính đối xứng của tinh thể, ông đã cho thấy rằng các góc giữa 2 bề mặt tinh thể là luôn như nhau[2] và tiếp đến là René Just Haüy (1784), người đã khám phá ra rằng mỗi mặt của một tinh thể có thể được mô tả bởi 3 số nguyên nhỏ, gọi là chỉ số Miller. Điều này dẫn Haüy đến quan điểm đúng đắn là các tinh thể có cấu trúc mảng 3 chiều không thay đổi (lưới Bravais) các nguyên tử và phân tử; một phân tử tế bào đơn vị được lặp đi vô hạn định dọc theo 3 trục cơ bản đó (các trục này không nhất thiết là vuông góc nhau). Vào thế kỉ 19, tổng hợp mọi đối xứng có thể có của một tinh thể đã được đưa ra bởi Johann Hessel[3], Auguste Bravais[4], Yevgraf Fyodorov[5], Arthur Schönflies[6] và sau này là William Barlow.

Tia X được khám phá ra bởi Wilhelm Conrad Röntgen năm 1895. Nó là sóng điện từ, hay một dạng khác của ánh sáng.
Phân tích tia X của các tinh thể[sửa | sửa mã nguồn]

Các tinh thể là các mảng cố định của các nguyên tử và tia X có thể được xem là các sóng điện từ. Các nguyên tử làm phân tán tia X, chủ yếu dựa vào các electron của nguyên tử; nó cũng giống như sóng biển đánh vào một ngọn hải đăng có các gờ đá bao quanh thì tạo ra một làn sóng nhỏ khác tỏa ra theo mọi hướng từ ngọn hải đăng đó, thì tia X đánh vào một electron bao quanh nguyên tử cũng tạo ra một sóng cầu tỏa ra từ electron đó. Hiện tượng này gọi là tán xạ (scatterer). Một mảng không thay đổi các tán xạ tạo ra một mảng cố định các sóng cầu. Mặc dù các sóng này triệt tiêu nhau theo hầu hết các hướng, chúng vẫn cộng lẫn nhau theo một vài hướng, tuân theo định luật Bragg.
với n là số nguyên. Những hướng chọn lựa sẽ xuất hiện là các điểm trên mẫu nhiễu xạ, hay còn gọi là sự phản xạ (reflection).
Phát triển từ 1912 đến 1920[sửa | sửa mã nguồn]

Sau nghiên cứu tiên phong của von Laue, lĩnh vực này phát triển nhanh chóng, nổi tiếng nhất là hai nhà vật lý William Lawrence Bragg và cha của ông William Henry Bragg. Năm 1912-1913, Bragg trẻ đã phát triển ra định luật Bragg, liên kết tán xạ quan sát được với sự phản xạ từ các mặt phẳng có khoảng cách đều nhau bên trong tinh thể[7].
Đóng góp trong hóa học và khoa học vật liệu[sửa | sửa mã nguồn]
Phương pháp[sửa | sửa mã nguồn]
Tinh thể hóa[sửa | sửa mã nguồn]
Thu thập dữ liệu[sửa | sửa mã nguồn]
Treo tinh thể lên[sửa | sửa mã nguồn]

Vì cả tinh thể và chùm tia là rất nhỏ, nên tinh thể phải đặt ở giữa chùm tia với độ chính xác trong khoảng 25 microns, nhờ sự hỗ trợ của một camera được hội tụ ở tinh thể. Loại đo góc kế phổ dụng nhất là "kappa goniometer", loại thường có 3 góc xoay: góc ω, xoay quanh trục gần như vuông góc với chùm tia; góc κ, quay quanh trục vào khoảng 50° so với trục ω; và góc φ quay quanh trục mao dẫn (loop/capillary axis). Khi góc κ là zero, thì các trục ω và φ trùng khớp.
Nguồn tia X[sửa | sửa mã nguồn]
Nguồn tia X sáng nhất và hữu ích nhất là Xincrotron; độ sáng cao cho phép tạo ra độ phân giải cao. Nó cũng dễ điều chỉnh bước sóng của tia xạ. Các máy Xincrotron là tài sản quốc gia, mỗi thiết bị tương ứng với một dòng tia nơi dữ liệu được thu thập liên tục.

Các nguồn tia X nhỏ hơn và yếu hơn thì thường được dùng trong các phòng TN để kiểm tra chát lượng tinh thể trước khi đem đến các máy Xinchrotron.
Ghi lại các nhiễu xạ[sửa | sửa mã nguồn]

Khi một tinh thể được treo lên máy đo góc và được chiếu vào bằng chùm tia X cực mạnh ở phía trước, nó sẽ làm phát tán chùm tia X đó và tạo ra mẫu các điểm đen hay là nhiễu xạ mà có thể được quan sát thông qua màn hình nằm phía sau tinh thể. Cường độ mạnh yếu khác nhau của tia phản xạ có thể cho ta biết được sự sắp xếp của các phân tử bên trong tinh thể ở mức nguyên tử. Cường độ này được đo đạc dựa vào phim nhiếp ảnh, một bộ nhận dạng diện tích (area detector) hay thiết bị cảm ứng hình cảnh charge-coupled device (CCD). Đỉnh có góc nhỏ sẽ tương ứng với dữ liệu có độ phân giải thấp, trong khi đỉnh (peak) có góc cao sẽ cho ra dữ liệu có độ phân giải cao.
Một hình ảnh các điểm (spot) thì không đủ để xây dựng lại toàn bộ cấu trúc tinh thể; nó chỉ là một lát nhỏ trong toàn bộ biến đổi Fourier. Để thu thập mọi thông tin cần thiết, tinh thể phải được xoay từng bước cho đến hết một góc 180°, với mỗi ảnh sẽ được lưu lại tại mỗi bước. Tuy nhiên, vì tinh thể có tính đối xứng cao, nên có thể dùng một góc xoay nhỏ hơn, như 90° hay 45°. Trục xoay cũng nên được đổi ít nhất 1 lần, để tránh việc phát triển các điểm mù (blind spot). Thông thừong nên lắc cho tinh thể dịch đôi chút (cỡ 0.5-2°).
Thư viện ảnh[sửa | sửa mã nguồn]
Xem thêm[sửa | sửa mã nguồn]
- Xác định cấu trúc
- Nhiễu xạ neutron
- Nhiễu xạ electron
- Phân tán tia X góc rộng (Wide angle X-ray scattering - WAXS)
- Phân tán tia X góc hẹp (Small angle X-ray scattering - SAXS)
- Lưới Bravais
- Nhóm điểm tinh thể
Chú thích[sửa | sửa mã nguồn]
- ^ Kepler, J (1611). Strena seu de Nive Sexangula. Frankfurt: G. Tampach.
- ^ Steno, N (1669). De solido intra solidum naturaliter contento dissertationis prodromus. Florentiae.
- ^ Hessel, JFC (1831). Kristallometrie oder Kristallonomie und Kristallographie. Leipzig.
- ^ Bravais, Auguste (1850). “Mémoire sur les systèmes formés par des points distribués regulièrement sur un plan ou dans l'espace”. J. l'Ecole Polytech. 19. Đã bỏ qua văn bản “pages 1–?” (trợ giúp)
- ^ I. I. Shafranovskii and N. V. Belov (1962). “E. S. Fedorov” (PDF). 50 Years of X-Ray Diffraction, ed. Paul Ewald (Springer): 351–353. ISBN 9027790299. Chú thích có tham số trống không rõ:
|1=(trợ giúp) - ^ Schönflies, A (1891). Kristallsysteme und Kristallstruktur. Leipzig.
- ^ Bragg WL (1912). “The Specular Reflexion of X-rays”. Nature. 90: 410. doi:10.1038/090410b0.
Bragg WL (1913). “The Diffraction of Short Electromanetic Waves by a Crystal”. Proceedings of the Cambridge Philosophical Society. 17: 43–57.
Bragg WL (1914). “Die Reflexion der Röntgenstrahlen”. Jahrbuch der Radioaktivität und Elektronik. 11: 350.
Tài liệu[sửa | sửa mã nguồn]
Bảng quốc tế về tinh thể học[sửa | sửa mã nguồn]
- International Tables for Crystallography. Volume A, Space-group Symmetry (ấn bản 5). Dordrecht: Kluwer Academic Publishers, for the International Union of Crystallography. 2002. ISBN 0-7923-6590-9.
- Michael G. Rossmann and Eddy Arnold biên tập (2001). International Tables for Crystallography. Volume F, Crystallography of biological molecules. Dordrecht: Kluwer Academic Publishers, for the International Union of Crystallography. ISBN 0-7923-6857-6.
- International Tables for Crystallography. Brief Teaching Edition of Volume A, Space-group Symmetry (ấn bản 4). Dordrecht: Kluwer Academic Publishers, for the International Union of Crystallography. 1996. ISBN 0-7923-4252-6.
Tập hợp các bài báo[sửa | sửa mã nguồn]
- Macromolecular Crystallography, Part A (Methods in Enzymology, v. 276) . San Diego: Academic Press. 1997. ISBN 0-12-182177-3.
- Macromolecular Crystallography, Part B (Methods in Enzymology, v. 277) . San Diego: Academic Press. 1997. ISBN 0-12-182178-1.
- Crystallization of Nucleic Acids and Proteins: A Practical Approach . Oxford: Oxford University Press. 1999. ISBN 0-19-963678-8.
Sách[sửa | sửa mã nguồn]
- Blow, D (2002). Outline of Crystallography for Biologists. Oxford: Oxford University Press. ISBN 0-19-851051-9.
- Clegg, W (1998). Crystal Structure Determination (Oxford Chemistry Primer). Oxford: Oxford University Press. ISBN 0-19-855-901-1.
- Drenth, J (1999). Principles of Protein X-Ray Crystallography. New York: Springer-Verlag. ISBN 0-387-98587-5.
- Giacovazzo, C (1992). Fundamentals of Crystallography. Monaco HL, Viterbo D, Scordari F, Gilli G, Zanotti G, and Catti M. Oxford: Oxford University Press. ISBN 0-19-855578-4.
- Glusker, JP (1994). Crystal Structure Analysis for Chemists and Biologists. Lewis M, Rossi M. New York: VCH Publishers. ISBN 0-471-18543-4.
- Massa, W (2004). Crystal Structure Determination. Berlin: Springer. ISBN 3540206442.
- McPherson, A (1999). Crystallization of Biological Macromolecules. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press. ISBN 0-87969-617-6.
- McPherson, A (2003). Introduction to Macromolecular Crystallography. John Wiley & Sons. ISBN 0-471-25122-4.
- McRee, DE (1993). Practical Protein Crystallography. San Diego: Academic Press. ISBN 0-12-486050-8.
- Rhodes, G (2000). Crystallography Made Crystal Clear. San Diego: Academic Press. ISBN 0-12-587072-8., PDF copy of select chapters
- Zachariasen, WH (1945). Theory of X-ray Diffraction in Crystals. New York: Dover Publications. LCCN 67-0 – 0.
Lịch sử[sửa | sửa mã nguồn]
- Friedrich, W (1922). “Die Geschichte der Auffindung der Röntgenstrahlinterferenzen”. Die Naturwissenschaften. 10. Đã bỏ qua văn bản “pages 363–366” (trợ giúp)
- Lonsdale, K (1949). Crystals and X-rays. New York: D. van Nostrand.
- Bragg, William Lawrence, D. C. Phillips and H. Lipson (1992). The Development of X-ray Analysis. New York: Dover. ISBN 0-486-67316-2.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- Ewald PP (1962). Fifty Years of X-ray Diffraction. Utrecht: published for the International Union of Crystallography by A. Oosthoek's Uitgeversmaatschappij N.V.
- Ewald, P. P., editor 50 Years of X-Ray Diffraction (Reprinted in pdf format for the IUCr XVIII Congress, Glasgow, Scotland, Copyright © 1962, 1999 International Union of Crystallography).
- Bijvoet JM, Burgers WG, Hägg G (1969). Early Papers on Diffraction of X-rays by Crystals (Volume I). Utrecht: published for the International Union of Crystallography by A. Oosthoek's Uitgeversmaatschappij N.V.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- Bijvoet JM, Burgers WG, Hägg G (1972). Early Papers on Diffraction of X-rays by Crystals (Volume II). Utrecht: published for the International Union of Crystallography by A. Oosthoek's Uitgeversmaatschappij N.V.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
Liên kết ngoài[sửa | sửa mã nguồn]
Hướng dẫn[sửa | sửa mã nguồn]
| Wikimedia Commons có thêm hình ảnh và phương tiện truyền tải về Tinh thể học tia X. |
- Simple, non technical introduction Lưu trữ 2012-03-03 tại Wayback Machine
- "Small Molecule Crystalization" Lưu trữ 2016-03-03 tại Wayback Machine (PDF) at Illinois Institute of Technology website
- International Union of Crystallography
- Crystallography 101
- Interactive structure factor tutorial Lưu trữ 2015-04-15 tại Wayback Machine
- Book of Fourier Lưu trữ 2021-03-18 tại Wayback Machine, about a technique which is used in X-ray crystallography
- Lecture notes on X-ray crystallography and structure determination
CSDL chính[sửa | sửa mã nguồn]
- Protein Data Bank Lưu trữ 2015-04-18 tại Wayback Machine (PDB)
- Nucleic Acid Databank (NDB)
- Cambridge Structural Database (CSD)
- Inorganic Crystal Structure Database (ICSD)
- Biological Macromolecule Crystallization Database Lưu trữ 2007-04-03 tại Wayback Machine (BMCD)
CSDL dẫn xuất[sửa | sửa mã nguồn]
- PDBsum
- Proteopeida - the collaborative, 3D encyclopedia of proteins and other molecules
- RNABase
- HIC-Up database of PDB ligands Lưu trữ 2020-08-08 tại Wayback Machine
- Structural Classification of Proteins database
- CATH Protein Structure Classification
- List of transmembrane proteins with known 3D structure Lưu trữ 2011-04-11 tại Wayback Machine
- Orientations of Proteins in Membranes database
Kiểm tra cấu trúc[sửa | sửa mã nguồn]
- WHAT-IF structural validation suite Lưu trữ 2008-05-07 tại Wayback Machine
- Biotech structural validation suite Lưu trữ 2007-10-28 tại Wayback Machine (formerly ProCheck)
- MolProbity structural validation suite
- ProSA-web
- NQ-Flipper (check for unfavorable rotamers of Asn and Gln residues)
- DALI server (identifies proteins similar to a given protein)