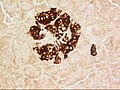
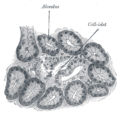
Tiểu đảo tụy
| Tiểu đảo tụy | |
|---|---|
 Tiểu đảo tụy là tuyến tụy nội tiết, tiết các hormone điều hòa chuyển hóa đường huyết | |
 Tiểu đảo tụy ở chuột, gần với mạch máu. Màu đỏ: insulin, màu xanh: Nhân. | |
| Chi tiết | |
| Một phần của | Tụy |
| Cơ quan | Hệ nội tiết |
| Định danh | |
| Latinh | insulae pancreaticae |
| MeSH | D007515 |
| TA | A05.9.01.019 |
| FMA | 16016 |
| Thuật ngữ giải phẫu | |
Tiểu đảo tụy hay tiểu đảo Langerhans là một vùng của tụy chứa các tế bào nội tiết (sản xuất hormone), được nhà giải phẫu bệnh lý người Đức Paul Langerhans phát hiện năm 1869.[1] Tiểu đảo tụy chiếm 1 đến 2% thể tích tuyến tụy và nhận 10 đến 15% lưu lượng máu đến tụy.[2][3] Tiểu đảo tụy sắp xếp dày đặc trong tụy người, có vai trò rất quan trọng trong quá trình chuyển hóa glucose.[4]
Cấu tạo
[sửa | sửa mã nguồn]Có khoảng 3 triệu tiểu đảo phân bố dưới dạng các dây tế bào nối với nhau, mỗi dây có độ dài trung bình khoảng 0,1 mm (đường kính 109 µm).[5]:914 Mỗi dây ngăn cách khỏi mô tụy xung quanh bởi một nang mô liên kết liên tục với mô liên kết sợi. : 914
Giải phẫu vi thể
[sửa | sửa mã nguồn]Hormone được sản xuất trong tiểu đảo tụy bài tiết trực tiếp vào dòng máu qua (ít nhất) năm loại tế bào. Trong các tiểu đảo tụy ở chuột, tập hợp tế bào nội tiết được phân phối như sau:[6]
- Tế bào alpha sản xuất glucagon (20% tổng số tế bào đảo)
- Tế bào beta sản xuất insulin và amylin (≈70%)
- Tế bào delta sản xuất somatostatin (<10%)
- Tế bào epsilon sản xuất ghrelin (<1%)
- Tế bào PP (tế bào gamma hay tế bào F) sản xuất polypeptide tụy (<5%)
Có sự khác nhau về kiến trúc tế bào của tiểu đảo tụy giữa các loài.[7][8][9] Đặc biệt, trong khi tiểu đảo tụy của bộ Gặm nhấm, số lượng tế bào beta sản xuất insulin chiếm chủ yếu ở trung tâm, còn các tế bào alpha, delta và PP khá khan hiếm ở ngoại vi. Tiểu đảo tụy người, tế bào alpha và beta phân bố khá đều.
Tiểu đảo ảnh hưởng lẫn nhau thông qua giao tiếp paracrine (tác động gần) và autocrine (tác động lên chính tế bào tiết), và tế bào beta giao tiếp qua tín hiệu điện đến 6 - 7 tế bào beta khác (không giao tiếp tế bào khác loại).[10]
-
Một tiểu đảo tụy (nhuộm).
-
Một tiểu đảo tụy, các tế bào alpha.
-
Một tiểu đảo tụy, các tế bào beta.
Chức năng
[sửa | sửa mã nguồn]Hệ thống điều hòa ngược paracrine của các tiểu đảo tụy có cấu trúc như sau:[11]
- Glucose/Insulin: kích hoạt tế bào beta và ức chế tế bào alpha
- Glycogen/Glucagon: kích hoạt tế bào alpha nhằm kích hoạt tế bào beta và tế bào delta
- Somatostatin: ức chế tế bào alpha và tế bào beta
Một số lượng lớn các thụ thể bắt cặp với protein G (GPCR) điều chỉnh việc tiết insulin, glucagon và somatostatin từ tiểu đảo tụy.[12] Một số GPCR này chính là mục tiêu của các loại thuốc sử dụng để điều trị bệnh tiểu đường type 2 (GLP-1 là chất chủ vận thụ thể, DPPIV là chất ức chế).
-
Nhuộm miễn dịch huỳnh quang tiểu đảo tụy ở chuột, thể hiện polypeptide tụy.
-
Nhuộm miễn dịch huỳnh quang tiểu đảo tụy ở chuột, thể hiện insulin
-
Nhuộm miễn dịch huỳnh quang tiểu đảo tụy ở chuột, thể hiện glucagon
Ý nghĩa lâm sàng
[sửa | sửa mã nguồn]Bệnh tiểu đường
[sửa | sửa mã nguồn]Các tế bào beta của đảo tụy tiết ra insulin, có vai trò quan trọng trong bệnh tiểu đường. Sự tự miễn dịch có thể là nguyên nhân gây nên sự phá hủy các tế bào beta. Tuy nhiên, cũng có những chứng cứ cho thấy các tế bào beta không phá hủy mà chỉ trở nên bất hoạt.
Cấy ghép
[sửa | sửa mã nguồn]Do tế bào beta trong tiểu đảo tụy bị phá hủy có chọn lọc bởi quá trình tự miễn trong bệnh tiểu đường type 1, các bác sĩ lâm sàng và nhà nghiên cứu đang tích cực phát triển phương pháp cấy ghép tiểu đảo nhằm phục hồi chức năng sinh lý của tế bào beta, thay thế cho phương pháp ghép tụy hoàn toàn hoặc ghép tụy nhân tạo.[13][14]
Ghép tiểu đảo cho bệnh nhân mắc tiểu đường type 1 hiện đang cần ức chế miễn dịch mạnh với mục đích ngăn chặn sự thải ghép của cơ thể đích với tiểu đảo người hiến.[15]
Hình ảnh bổ sung
[sửa | sửa mã nguồn]-
Tiểu đảo tụy: sáng; nang tuyến tụy: tối (nhuộm hemalum-eosin).
-
Tụy chó. 250x.
-
Tiểu đảo tụy giữa chuột (ở trên) và người (dưới) có sự khác nhau, tương ứng với phần bụng (trái) và phần lưng (phải) của tụy. Các loại tế bào khác nhau được đánh dấu bằng màu.
Xem thêm
[sửa | sửa mã nguồn]Tham khảo
[sửa | sửa mã nguồn]- ^ Langerhans P (1869). “Beitrage zur mikroscopischen anatomie der bauchspeichel druse”. Inaugural-dissertation. Berlin: Gustav Lange.
- ^ Barrett KE, Boitano S, Barman SM, Brooks HL (22 tháng 7 năm 2009). Ganong's review of medical physiology (ấn bản thứ 23). McGraw Hill Medical. tr. 316. ISBN 978-0-07-160568-7.
- ^ “Functional Anatomy of the Endocrine Pancreas”. Bản gốc lưu trữ ngày 31 tháng 3 năm 2023. Truy cập ngày 20 tháng 12 năm 2019.
- ^ Pour, Parviz M.; Standop, Jens; Batra, Surinder K. (tháng 1 năm 2002). “Are islet cells the gatekeepers of the pancreas?”. Pancreatology. 2 (5): 440–448. doi:10.1159/000064718. PMID 12378111.
- ^ Sleisenger, edited by Mark Feldman, Lawrence S. Friedman, Lawrence J. Brandt; consulting editor, Marvin H. (2009). Sleisenger & Fordtran's gastrointestinal and liver disease pathophysiology, diagnosis, management (ấn bản thứ 9). St. Louis, Missouri: MD Consult. ISBN 978-1-4160-6189-2.Quản lý CS1: văn bản dư: danh sách tác giả (liên kết)
- ^ Elayat AA; el-Naggar MM; Tahir M; Bassam dahrouj (1995). “An immunocytochemical and morphometric study of the rat pancreatic islets”. Journal of Anatomy. 186. (Pt 3) (Pt 3): 629–37. PMC 1167020. PMID 7559135.
- ^ Brissova M, Fowler MJ, Nicholson WE, Chu A, Hirshberg B, Harlan DM, Powers AC (2005). “Assessment of human pancreatic islet architecture and composition by laser scanning confocal microscopy”. Journal of Histochemistry and Cytochemistry. 53 (9): 1087–97. doi:10.1369/jhc.5C6684.2005. PMID 15923354.
- ^ Ichii H, Inverardi L, Pileggi A, Molano RD, Cabrera O, Caicedo A, Messinger S, Kuroda Y, Berggren PO, Ricordi C (2005). “A novel method for the assessment of cellular composition and beta-cell viability in human islet preparations”. American Journal of Transplantation. 5 (7): 1635–45. CiteSeerX 10.1.1.578.5893. doi:10.1111/j.1600-6143.2005.00913.x. PMID 15943621.
- ^ Cabrera O, Berman DM, Kenyon NS, Ricordi C, Berggren PO, Caicedo A (2006). “The unique cytoarchitecture of human pancreatic islets has implications for islet cell function”. Proceedings of the National Academy of Sciences of the United States of America. 103 (7): 2334–9. Bibcode:2006PNAS..103.2334C. doi:10.1073/pnas.0510790103. ISSN 1091-6490. PMC 1413730. PMID 16461897.
- ^ Kelly, Catriona; McClenaghan, Neville H.; Flatt, Peter R. (2011). “Role of islet structure and cellular interactions in the control of insulin secretion”. Islets. 3 (2): 41–47. doi:10.4161/isl.3.2.14805. PMID 21372635.
- ^ Wang, Michael B.; Bullock, John; Boyle, Joseph R. (2001). Physiology. Hagerstown, MD: Lippincott Williams & Wilkins. tr. 391. ISBN 978-0-683-30603-3.
- ^ "An atlas and functional analysis of G-protein coupled receptors in human islets of Langerhans.Amisten S, Salehi A, Rorsman P, Jones PM, Persaud SJ., Pharmacol Ther. 2013 May 18. PMID 23694765
- ^ Meloche RM (2007). “Transplantation for the treatment of type 1 diabetes”. World Journal of Gastroenterology. 13 (47): 6347–55. doi:10.3748/wjg.13.6347. PMC 4205453. PMID 18081223.
- ^ Hogan A, Pileggi A, Ricordi C (2008). “Transplantation: current developments and future directions; the future of clinical islet transplantation as a cure for diabetes”. Frontiers in Bioscience. 13 (13): 1192–205. doi:10.2741/2755. PMID 17981623.
- ^ Chatenoud L (2008). “Chemical immunosuppression in islet transplantation—friend or foe?”. New England Journal of Medicine. 358 (11): 1192–3. doi:10.1056/NEJMcibr0708067. ISSN 0028-4793. PMID 18337609.