Khác biệt giữa bản sửa đổi của “Hydro sulfide”
Không có tóm lược sửa đổi |
|||
| Dòng 64: | Dòng 64: | ||
Muối sunfua của kim loại nhóm IA như Na<sub>2</sub>S, K<sub>2</sub>S tan trong nước và tác dụng với các axit HCl, H<sub>2</sub>SO<sub>4</sub> sinh ra khí H<sub>2</sub>S. Muối sunfua của kim loại nặng như CuS, PbS.. không tan trong nước, không tác dụng với dung dịch axit HCl, H<sub>2</sub>SO<sub>4</sub>. Muối sunfua của một số kim loại còn lại như ZnS, FeS không tan trong nước nhưng tác dụng với dung dịch axit HCl, H<sub>2</sub>SO<sub>4</sub> sinh ra khí H<sub>2</sub>S. Một số muối sunfua có màu đặc trưng như ZnS màu trắng (dùng làm màn huỳnh quang, ti vi.); CdS, As<sub>2</sub>S<sub>3</sub> màu vàng; CuS, PbS, Ag<sub>2</sub>S, HgS màu đen. Dựa vào tính chất này để nhận biết muối sunfua. |
Muối sunfua của kim loại nhóm IA như Na<sub>2</sub>S, K<sub>2</sub>S tan trong nước và tác dụng với các axit HCl, H<sub>2</sub>SO<sub>4</sub> sinh ra khí H<sub>2</sub>S. Muối sunfua của kim loại nặng như CuS, PbS.. không tan trong nước, không tác dụng với dung dịch axit HCl, H<sub>2</sub>SO<sub>4</sub>. Muối sunfua của một số kim loại còn lại như ZnS, FeS không tan trong nước nhưng tác dụng với dung dịch axit HCl, H<sub>2</sub>SO<sub>4</sub> sinh ra khí H<sub>2</sub>S. Một số muối sunfua có màu đặc trưng như ZnS màu trắng (dùng làm màn huỳnh quang, ti vi.); CdS, As<sub>2</sub>S<sub>3</sub> màu vàng; CuS, PbS, Ag<sub>2</sub>S, HgS màu đen. Dựa vào tính chất này để nhận biết muối sunfua. |
||
== |
==Điều chế== |
||
Hydro sunfua thường thu được nhất khi tách khỏi [[khí chua]], đây là khí tự nhiên có hàm lượng {{Chem|H|2|S}} cao. Nó cũng có thể được sản xuất bằng cách xử lý [[hydro]] bằng lưu huỳnh nguyên tố nóng chảy ở khoảng 450°C. Các hydrocarbon có thể phục vụ như một nguồn cung cấp hydro trong quá trình này. <ref name="ullmann">{{Chú thích sách|title=Ullmann's Encyclopedia of Chemical Industry|last=Francois Pouliquen|last2=Claude Blanc|last3=Emmanuel Arretz|last4=Ives Labat|last5=Jacques Tournier-Lasserve|last6=Alain Ladousse|last7=Jean Nougayrede|last8=Gérard Savin|last9=Raoul Ivaldi|year=200|isbn=978-3527306732|chapter=Hydrogen Sulfide|doi=10.1002/14356007.a13_467}}</ref> |
Hydro sunfua thường thu được nhất khi tách khỏi [[khí chua]], đây là khí tự nhiên có hàm lượng {{Chem|H|2|S}} cao. Nó cũng có thể được sản xuất bằng cách xử lý [[hydro]] bằng lưu huỳnh nguyên tố nóng chảy ở khoảng 450°C. Các hydrocarbon có thể phục vụ như một nguồn cung cấp hydro trong quá trình này. <ref name="ullmann">{{Chú thích sách|title=Ullmann's Encyclopedia of Chemical Industry|last=Francois Pouliquen|last2=Claude Blanc|last3=Emmanuel Arretz|last4=Ives Labat|last5=Jacques Tournier-Lasserve|last6=Alain Ladousse|last7=Jean Nougayrede|last8=Gérard Savin|last9=Raoul Ivaldi|year=200|isbn=978-3527306732|chapter=Hydrogen Sulfide|doi=10.1002/14356007.a13_467}}</ref> |
||
| Dòng 85: | Dòng 85: | ||
Máy nước nóng có thể hỗ trợ chuyển đổi [[Sunfat|sulfate]] trong nước thành khí hydro sulfide. Điều này là do cung cấp một môi trường ấm áp bền vững cho [[Vi khuẩn khử sunfat|vi khuẩn lưu huỳnh]] và duy trì phản ứng tương tác giữa sunfat trong nước và cực dương của máy nước nóng, thường được làm từ kim loại [[Magie|magiê]] . <ref>{{Chú thích web|url=http://www.health.state.mn.us/divs/eh/wells/waterquality/hydrosulfide.html|tựa đề=Why Does My Water Smell Like Rotten Eggs? Hydrogen Sulfide and Sulfur Bacteria in Well Water|website=Minnesota Department of Health|nhà xuất bản=Minnesota Department of Health|ngày truy cập=1 December 2014}}</ref> |
Máy nước nóng có thể hỗ trợ chuyển đổi [[Sunfat|sulfate]] trong nước thành khí hydro sulfide. Điều này là do cung cấp một môi trường ấm áp bền vững cho [[Vi khuẩn khử sunfat|vi khuẩn lưu huỳnh]] và duy trì phản ứng tương tác giữa sunfat trong nước và cực dương của máy nước nóng, thường được làm từ kim loại [[Magie|magiê]] . <ref>{{Chú thích web|url=http://www.health.state.mn.us/divs/eh/wells/waterquality/hydrosulfide.html|tựa đề=Why Does My Water Smell Like Rotten Eggs? Hydrogen Sulfide and Sulfur Bacteria in Well Water|website=Minnesota Department of Health|nhà xuất bản=Minnesota Department of Health|ngày truy cập=1 December 2014}}</ref> |
||
=== Sinh tổng hợp trong cơ thể === |
|||
Hydro sunfua có thể được tạo ra trong các tế bào thông qua con đường enzyme hoặc không enzyme. {{Chem|H|2|S}} trong cơ thể hoạt động như một phân tử tín hiệu khí được biết là có tác dụng ức chế Phức hợp IV của chuỗi vận chuyển điện tử ti thể làm giảm hiệu quả hoạt động tạo ATP và sinh hóa trong tế bào. <ref name=":42">{{Chú thích sách|title=Cell signalling|last=T.|first=Hancock, John|year=2017|isbn=9780199658480|edition=Fourth|location=Oxford, United Kingdom|oclc=947925636}}</ref> Ba enzyme được biết đến để tổng hợp {{Chem|H|2|S}}: cystathionine-lyase (CSE), cystathionine-synthetase (CBS) và 3-mercaptopyruvate sulfurtransferase (3-MST). <ref name=":12">{{Chú thích|isbn=9783319181431}}</ref> Những enzyme này đã được xác định trong một chiều rộng của các tế bào và mô sinh học, và hoạt động của chúng đã được quan sát thấy là do một số trạng thái bệnh gây ra. <ref name=":24">{{Chú thích tạp chí|last=Kabil|first=Omer|last2=Banerjee|first2=Ruma|date=2014-02-10|title=Enzymology of H2S Biogenesis, Decay and Signaling|journal=Antioxidants & Redox Signaling|volume=20|issue=5|pages=770–782|doi=10.1089/ars.2013.5339|issn=1523-0864|pmc=3910450|pmid=23600844}}</ref> Ngày càng rõ ràng rằng {{Chem|H|2|S}} là một trung gian quan trọng của một loạt các chức năng tế bào trong sức khỏe và bệnh tật. <ref name=":12" /> CBS và CSE là những người đề xuất chính của {{Chem|H|2|S}}, theo con đường trans-sulfuration. <ref name=":32">{{Chú thích tạp chí|last=Kabil|first=Omer|last2=Vitvitsky|first2=Victor|last3=Xie|first3=Peter|last4=Banerjee|first4=Ruma|date=2011-07-15|title=The Quantitative Significance of the Transsulfuration Enzymes for H2S Production in Murine Tissues|journal=Antioxidants & Redox Signaling|volume=15|issue=2|pages=363–372|doi=10.1089/ars.2010.3781|issn=1523-0864|pmc=3118817|pmid=21254839}}</ref> Những enzyme này được đặc trưng bởi sự chuyển một nguyên tử lưu huỳnh từ methionine sang serine để tạo thành một phân tử cystein. <ref name=":32" /> 3-MST cũng góp phần vào việc sản xuất hydro sunfua bằng con đường dị hóa cystein. <ref name=":24" /> <ref name=":32" /> Các axit amin trong chế độ ăn uống, chẳng hạn như methionine và cysteine đóng vai trò là chất nền chính cho quá trình chuyển hóa và trong sản xuất hydro sunfua. Hydrogen sulfide cũng có thể được tổng hợp bằng con đường không enzyme, có nguồn gốc từ các protein như [[ferredoxin]] và [[protein Rieske]].<ref name=":24" /> |
|||
== Công dụng == |
|||
=== Sản xuất lưu huỳnh, hợp chất vô cơ và sunfua kim loại kiềm === |
|||
Công dụng chính của hydro sunfua là tiền chất của lưu huỳnh nguyên tố. Một số [[hợp chất lưu huỳnh hữu cơ]] được sản xuất bằng hydro sunfua. Chúng bao gồm [[methanethiol]], [[ethanethiol]] và [[axit thioglycolic]] . <ref name="ullmann2">{{Chú thích sách|title=Ullmann's Encyclopedia of Chemical Industry|last=Francois Pouliquen|last2=Claude Blanc|last3=Emmanuel Arretz|last4=Ives Labat|last5=Jacques Tournier-Lasserve|last6=Alain Ladousse|last7=Jean Nougayrede|last8=Gérard Savin|last9=Raoul Ivaldi|year=200|isbn=978-3527306732|chapter=Hydrogen Sulfide|doi=10.1002/14356007.a13_467}}</ref> |
|||
Khi kết hợp với [[Kim loại kiềm|các bazơ kim loại kiềm]], hydro sunfua chuyển đổi thành hydrosulfide kiềm như [[Natri hiđrosunfua|natri hydrosulfua]] và [[Natri sunfua|natri sulfua]] : |
|||
: H<sub>2</sub>S + NaOH → NaSH + H<sub>2</sub>O |
|||
: NaSH + NaOH → Na<sub>2</sub>S + H<sub>2</sub>O |
|||
Các hợp chất này được sử dụng trong ngành công nghiệp [[Sản xuất giấy|làm giấy]] . Cụ thể, muối của SH <sup>-</sup> phá vỡ liên kết giữa các thành phần lignin và cellulose của [[bột giấy]] trong [[ Quy trình kraft|quy trình Kraft]] . <ref name="ullmann3">{{Chú thích sách|title=Ullmann's Encyclopedia of Chemical Industry|last=Francois Pouliquen|last2=Claude Blanc|last3=Emmanuel Arretz|last4=Ives Labat|last5=Jacques Tournier-Lasserve|last6=Alain Ladousse|last7=Jean Nougayrede|last8=Gérard Savin|last9=Raoul Ivaldi|year=200|isbn=978-3527306732|chapter=Hydrogen Sulfide|doi=10.1002/14356007.a13_467}}</ref> |
|||
Natri sunfua có thể đảo ngược khi có mặt axit biến thành hydrosulfua và hydro sulfua; nó cung cấp hydrosulfua trong các dung dịch hữu cơ và được sử dụng trong sản xuất [[ Thiophenol|thiophenol]].<ref>{{Chú thích tạp chí|last=Khazaei, A.|displayauthors=etal|date=2012|title=Synthesis of thiophenols using sodium sulfide in acidic media|journal=Synlett|volume=23|issue=13|pages=1893–1896|doi=10.1055/s-0032-1316557}}</ref> |
|||
=== Hóa phân tích === |
|||
Trong hơn một thế kỷ, hydro sunfua rất quan trọng trong [[Hóa phân tích|hóa học phân tích]] trong [[Hóa phân tích|phân tích]] [[Phân tích vô cơ định tính|vô cơ định tính]] các ion kim loại. Trong các phân tích này, các ion kim loại nặng (và [[phi kim]] ) (ví dụ: Pb (II), Cu (II), Hg (II), As (III)) bị kết tủa từ dung dịch khi tiếp xúc với {{Chem|H|2|S}}). Các thành phần của kết tủa kết quả phân phối lại với một số chọn lọc, và do đó được xác định. |
|||
=== Tiền chất của sunfua kim loại === |
|||
Như đã chỉ ra ở trên, nhiều ion kim loại phản ứng với hydro sunfua để tạo ra sunfua kim loại tương ứng. Chuyển đổi này được khai thác rộng rãi. Ví dụ, khí hoặc nước bị ô nhiễm bởi hydro sunfua có thể được làm sạch bằng kim loại, bằng cách tạo thành sunfua kim loại. Trong quá trình tinh chế [[quặng]] kim [[Quặng|loại]] bằng [[Tuyển nổi|phương pháp tuyển nổi]], bột khoáng thường được xử lý bằng hydro sunfua để tăng cường sự phân tách. Các bộ phận kim loại đôi khi bị thụ động với hydro sunfua. Các chất xúc tác được sử dụng trong [[Khử lưu huỳnh bằng hydro|hydrodesulfurization]] được kích hoạt thường xuyên với hydro sulfide, và hoạt động của các chất xúc tác kim loại được sử dụng trong các bộ phận khác của [[ Tinh chế|nhà máy lọc dầu]] cũng được sửa đổi bằng hydro sulfua. |
|||
<br /> |
|||
==Tham khảo== |
==Tham khảo== |
||
{{tham khảo}} |
{{tham khảo}} |
||
Phiên bản lúc 06:54, ngày 17 tháng 6 năm 2020
| Hydro sulfide | |
|---|---|
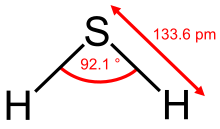 Cấu trúc phân tử của hydro sulfua | |
| Tổng quan | |
| Danh pháp IUPAC | Hydro sulfid, hydro sulfua, sunfan |
| Tên khác | Hiđrô sunfua, sunfua hiđrô |
| Công thức phân tử | H2S |
| Phân tử gam | 34,082 g/mol |
| Biểu hiện | Khí không màu |
| Số CAS | [7783-06-4] |
| Thuộc tính | |
| Tỷ trọng và pha | 1,363 g/L, khí |
| Độ hòa tan trong nước | 2,5 g/L |
| Nhiệt độ nóng chảy | -82,3 °C (190,85 K) |
| Điểm sôi | -60,28 °C (212,87 K) |
| pKa | 7[1][2] |
| Khác | |
| MSDS | MSDS ngoài |
| Các nguy hiểm chính | Cực độc Dễ cháy |
| NFPA 704 | |
| Điểm bắt lửa | -82,4 °C |
| Rủi ro/An toàn | R: 12, 26, 50 S: 1/2, 9, 16, 36, 38, 45, 61 |
| Số RTECS | MX1225000 |
| Dữ liệu hóa chất bổ sung | |
| Cấu trúc & thuộc tính | n εr, v.v. |
| Dữ liệu nhiệt động lực | Các trạng thái rắn, lỏng, khí |
| Dữ liệu quang phổ | UV, IR, NMR, MS |
| Các hợp chất liên quan | |
| Các hợp chất tương tự | Nước Selenua hyđro Teluarua hyđro |
| Các hợp chất liên quan | natri sunfua natri hiđrôsunfua, Dimetyl sunfua |
| Ngoại trừ có thông báo khác, các dữ liệu được lấy ở 25 °C, 100 kPa Thông tin về sự phủ nhận và tham chiếu | |
Hydro sulfua là hợp chất hóa học có công thức H
2S. Nó là một loại khí chalcogen hydrua không màu với mùi hôi đặc trưng của trứng thối. Nó rất độc, có tính ăn mòn và dễ cháy. [3]
Hydro sulfua thường được sản xuất từ sự phân hủy vi sinh vật của chất hữu cơ trong trường hợp không có khí oxy, chẳng hạn như trong đầm lầy và cống rãnh; quá trình này thường được gọi là quá trình phân hủy kỵ khí được thực hiện bởi các vi sinh vật khử sulfate . H
2S cũng xuất hiện trong khí núi lửa, khí tự nhiên và trong một số nguồn nước giếng. [4] Cơ thể con người tạo ra một lượng nhỏ H
2S và sử dụng nó như là một phân tử tín hiệu . [5]
Nhà hóa học người Thụy Điển Carl Wilhelm Scheele được cho là đã phát hiện ra thành phần hóa học của hydro sunfua vào năm 1777.
Tính chất hóa học
Hydro sulfua đậm đặc hơn không khí một chút; hỗn hợp H
2S và không khí có thể phát nổ. Hydro sulfua cháy trong oxy với ngọn lửa màu xanh lam để tạo thành lưu huỳnh dioxit (SO
2) và nước . Nói chung, hydro sunfua hoạt động như một chất khử, đặc biệt là với sự có mặt của bazơ, tạo thành ion SH-.
Ở nhiệt độ cao hoặc với sự có mặt của chất xúc tác, lưu huỳnh dioxit phản ứng với hydro sunfua để tạo thành lưu huỳnh nguyên tố và nước . Phản ứng này được khai thác trong quy trình Claus, một phương pháp công nghiệp quan trọng để loại bỏ hydro sunfua.
Hydro sulfua tan ít trong nước và hoạt động như một axit yếu ( pKa = = 6,9 trong 0,01-0.1 dung dịch mol / lít ở 18°C), tạo ra ion hydrosulfua HS−
(cũng viết SH−
). Hydro sulfua và các dung dịch của nó là không màu. Khi tiếp xúc với không khí, nó từ từ bị oxy hóa tạo thành lưu huỳnh nguyên tố, không tan trong nước. Các anion sunfua S2−
không được hình thành trong dung dịch nước. [6]
Hydro sulfua phản ứng với các ion kim loại để tạo thành sunfua kim loại, không hòa tan, thường là chất rắn màu tối. Giấy acetate chì (II) được sử dụng để phát hiện hydro sunfua vì nó dễ dàng chuyển thành chì (II) sunfua, có màu đen. Xử lý sunfua kim loại bằng axit mạnh thường giải phóng hydro sunfua.
Ở áp suất trên 90 GPa ( gigapascal ), hydro sunfua trở thành chất dẫn điện của kim loại. Khi được làm mát dưới nhiệt độ tới hạn, pha áp suất cao này thể hiện tính siêu dẫn . Nhiệt độ tới hạn tăng theo áp suất, dao động từ 23 K ở 100 GPa đến 150 K ở mức 200 GPa. [7] Nếu hydro sunfua được điều áp ở nhiệt độ cao hơn, sau đó được làm mát, nhiệt độ tới hạn là 203 K (−70 °C), nhiệt độ tới hạn siêu dẫn cao nhất được chấp nhận vào năm 2015. Bằng cách thay thế một phần nhỏ lưu huỳnh bằng phốt pho và sử dụng áp suất thậm chí cao hơn, người ta đã dự đoán rằng có thể tăng nhiệt độ tới hạn lên trên 0 °C (273 K) và đạt được tính siêu dẫn ở nhiệt độ phòng . [8]
Tính axit yếu
Khí H2S tan trong nước tạo thành dung dịch axit sunfuahiđric rất yếu (yếu hơn axit H2CO3) với H+ + HS- K1= 6.10-8 và HS- H+ + S 2- K2=10-14
Tác dụng với các dung dịch kiềm tạo hai muối, muối trung hoà và muối axit:
- H2S + 2NaOH = Na2S + 2H2O
- H2S + NaOH = NaHS + H2O
Đặc biệt H2S tác dụng với các dung dịch muối cacbonat kim loại kiềm chỉ tạo ra muối hiđro cacbonat.
- H2S + Na2CO3 = NaHCO3 + NaHS
Tính khử mạnh
Trong axit H2S và các muối của nó (S có số oxi hoá -2) nên là chất khử mạnh. H2S cháy trong không khí với ngọn lửa màu xanh.
- 2H2S + 3O2 → 2 H2O + 2SO2
Nếu không cung cấp đủ không khí, H2S bị oxi hóa thành S. Clo có thể oxi hoá H2S thành H2SO4 (khi có nước).
- 4Cl2 + H2S + 4H2O → H2SO4 + 8 HCl
H2S tác dụng với các kim loại kiềm tạo thành muối axit.
- 2H2S + 2K → 2KHS + H2
Còn với các kim loại khác thì tạo thành muối sunfua. H2S khan không tác dụng với Cu, Ag, Hg, nhưng khi có mặt hơi nước thì lại tác dụng khá nhanh làm cho bề mặt các kim loại này bị xám lại.
- 4 Ag + 2H2S + O2 → 2Ag2S + 2H2O
Các sunfua
Muối sunfua của kim loại nhóm IA như Na2S, K2S tan trong nước và tác dụng với các axit HCl, H2SO4 sinh ra khí H2S. Muối sunfua của kim loại nặng như CuS, PbS.. không tan trong nước, không tác dụng với dung dịch axit HCl, H2SO4. Muối sunfua của một số kim loại còn lại như ZnS, FeS không tan trong nước nhưng tác dụng với dung dịch axit HCl, H2SO4 sinh ra khí H2S. Một số muối sunfua có màu đặc trưng như ZnS màu trắng (dùng làm màn huỳnh quang, ti vi.); CdS, As2S3 màu vàng; CuS, PbS, Ag2S, HgS màu đen. Dựa vào tính chất này để nhận biết muối sunfua.
Điều chế
Hydro sunfua thường thu được nhất khi tách khỏi khí chua, đây là khí tự nhiên có hàm lượng H
2S cao. Nó cũng có thể được sản xuất bằng cách xử lý hydro bằng lưu huỳnh nguyên tố nóng chảy ở khoảng 450°C. Các hydrocarbon có thể phục vụ như một nguồn cung cấp hydro trong quá trình này. [9]
Vi khuẩn khử sunfat ( giảm lưu huỳnh ) tạo ra năng lượng có thể sử dụng trong điều kiện oxy thấp bằng cách sử dụng sunfat (lưu huỳnh nguyên tố) để oxy hóa các hợp chất hữu cơ hoặc hydro; điều này tạo ra hydro sunfua như một sản phẩm thải.
Một chế phẩm phòng thí nghiệm tiêu chuẩn là xử lý sắt sunfua bằng axit mạnh trong bình Kipp:
FeS + 2 HCl → FeCl2 + H2S
Để sử dụng trong phân tích vô cơ định tính, thioacetamide được sử dụng để điều chế H
2S:
CH3C(S)NH2 + H2O → CH3C(O)NH2 + H2S
Nhiều sunfua kim loại và phi kim, ví dụ nhôm sunfua, photpho pentasulfide, silic disulfide giải phóng hydro sunfua khi tiếp xúc với nước: [10]
6 H2O + Al2S3 → 3 H2S + 2 Al(OH)3
Khí này cũng được sản xuất bằng cách đun nóng lưu huỳnh với các hợp chất hữu cơ rắn và bằng cách giảm các hợp chất hữu cơ chứa lưu huỳnh bằng hydro.
Máy nước nóng có thể hỗ trợ chuyển đổi sulfate trong nước thành khí hydro sulfide. Điều này là do cung cấp một môi trường ấm áp bền vững cho vi khuẩn lưu huỳnh và duy trì phản ứng tương tác giữa sunfat trong nước và cực dương của máy nước nóng, thường được làm từ kim loại magiê . [11]
Sinh tổng hợp trong cơ thể
Hydro sunfua có thể được tạo ra trong các tế bào thông qua con đường enzyme hoặc không enzyme. H
2S trong cơ thể hoạt động như một phân tử tín hiệu khí được biết là có tác dụng ức chế Phức hợp IV của chuỗi vận chuyển điện tử ti thể làm giảm hiệu quả hoạt động tạo ATP và sinh hóa trong tế bào. [12] Ba enzyme được biết đến để tổng hợp H
2S: cystathionine-lyase (CSE), cystathionine-synthetase (CBS) và 3-mercaptopyruvate sulfurtransferase (3-MST). [13] Những enzyme này đã được xác định trong một chiều rộng của các tế bào và mô sinh học, và hoạt động của chúng đã được quan sát thấy là do một số trạng thái bệnh gây ra. [14] Ngày càng rõ ràng rằng H
2S là một trung gian quan trọng của một loạt các chức năng tế bào trong sức khỏe và bệnh tật. [13] CBS và CSE là những người đề xuất chính của H
2S, theo con đường trans-sulfuration. [15] Những enzyme này được đặc trưng bởi sự chuyển một nguyên tử lưu huỳnh từ methionine sang serine để tạo thành một phân tử cystein. [15] 3-MST cũng góp phần vào việc sản xuất hydro sunfua bằng con đường dị hóa cystein. [14] [15] Các axit amin trong chế độ ăn uống, chẳng hạn như methionine và cysteine đóng vai trò là chất nền chính cho quá trình chuyển hóa và trong sản xuất hydro sunfua. Hydrogen sulfide cũng có thể được tổng hợp bằng con đường không enzyme, có nguồn gốc từ các protein như ferredoxin và protein Rieske.[14]
Công dụng
Sản xuất lưu huỳnh, hợp chất vô cơ và sunfua kim loại kiềm
Công dụng chính của hydro sunfua là tiền chất của lưu huỳnh nguyên tố. Một số hợp chất lưu huỳnh hữu cơ được sản xuất bằng hydro sunfua. Chúng bao gồm methanethiol, ethanethiol và axit thioglycolic . [16]
Khi kết hợp với các bazơ kim loại kiềm, hydro sunfua chuyển đổi thành hydrosulfide kiềm như natri hydrosulfua và natri sulfua :
- H2S + NaOH → NaSH + H2O
- NaSH + NaOH → Na2S + H2O
Các hợp chất này được sử dụng trong ngành công nghiệp làm giấy . Cụ thể, muối của SH - phá vỡ liên kết giữa các thành phần lignin và cellulose của bột giấy trong quy trình Kraft . [17]
Natri sunfua có thể đảo ngược khi có mặt axit biến thành hydrosulfua và hydro sulfua; nó cung cấp hydrosulfua trong các dung dịch hữu cơ và được sử dụng trong sản xuất thiophenol.[18]
Hóa phân tích
Trong hơn một thế kỷ, hydro sunfua rất quan trọng trong hóa học phân tích trong phân tích vô cơ định tính các ion kim loại. Trong các phân tích này, các ion kim loại nặng (và phi kim ) (ví dụ: Pb (II), Cu (II), Hg (II), As (III)) bị kết tủa từ dung dịch khi tiếp xúc với H
2S). Các thành phần của kết tủa kết quả phân phối lại với một số chọn lọc, và do đó được xác định.
Tiền chất của sunfua kim loại
Như đã chỉ ra ở trên, nhiều ion kim loại phản ứng với hydro sunfua để tạo ra sunfua kim loại tương ứng. Chuyển đổi này được khai thác rộng rãi. Ví dụ, khí hoặc nước bị ô nhiễm bởi hydro sunfua có thể được làm sạch bằng kim loại, bằng cách tạo thành sunfua kim loại. Trong quá trình tinh chế quặng kim loại bằng phương pháp tuyển nổi, bột khoáng thường được xử lý bằng hydro sunfua để tăng cường sự phân tách. Các bộ phận kim loại đôi khi bị thụ động với hydro sunfua. Các chất xúc tác được sử dụng trong hydrodesulfurization được kích hoạt thường xuyên với hydro sulfide, và hoạt động của các chất xúc tác kim loại được sử dụng trong các bộ phận khác của nhà máy lọc dầu cũng được sửa đổi bằng hydro sulfua.
Tham khảo
- ^ Perrin, D.D. (1982). Ionisation Constants of Inorganic Acids and Bases in Aqueous Solution (ấn bản 2). Oxford: Pergamon Press.
- ^ Bruckenstein, S.; Kolthoff, I.M., in Kolthoff, I.M.; Elving, P.J. Treatise on Analytical Chemistry, Vol. 1, pt. 1; Wiley, NY, 1959, pp. 432–433.
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (ấn bản 2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- ^ “Hydrogen Sulphide In Well Water”. Truy cập ngày 4 tháng 9 năm 2018.
- ^ Bos, E. M; Van Goor, H; Joles, J. A; Whiteman, M; Leuvenink, H. G (2015). “Hydrogen sulfide: Physiological properties and therapeutic potential in ischaemia”. British Journal of Pharmacology. 172 (6): 1479–1493. doi:10.1111/bph.12869. PMC 4369258. PMID 25091411.
- ^ May, P.M.; Batka, D.; Hefter, G.; Könignberger, E.; Rowland, D. (2018). “Goodbye to S2-”. Chem. Comm. 54 (16): 1980–1983. doi:10.1039/c8cc00187a. PMID 29404555.
- ^ A bot will complete this citation soon. Click here to jump the queue. MISSING LINK. .
- ^ Cartlidge, Edwin (18 tháng 8 năm 2015). “Superconductivity record sparks wave of follow-up physics”. Nature. 524 (7565): 277. Bibcode:2015Natur.524..277C. doi:10.1038/nature.2015.18191. PMID 26289188.
- ^ Francois Pouliquen; Claude Blanc; Emmanuel Arretz; Ives Labat; Jacques Tournier-Lasserve; Alain Ladousse; Jean Nougayrede; Gérard Savin; Raoul Ivaldi (200). “Hydrogen Sulfide”. Ullmann's Encyclopedia of Chemical Industry. doi:10.1002/14356007.a13_467. ISBN 978-3527306732.
- ^ McPherson, William (1913). Laboratory manual. Boston: Ginn and Company. tr. 445.
- ^ “Why Does My Water Smell Like Rotten Eggs? Hydrogen Sulfide and Sulfur Bacteria in Well Water”. Minnesota Department of Health. Minnesota Department of Health. Truy cập ngày 1 tháng 12 năm 2014.
- ^ T., Hancock, John (2017). Cell signalling . Oxford, United Kingdom. ISBN 9780199658480. OCLC 947925636.
- ^ a b , ISBN 9783319181431
|title=trống hay bị thiếu (trợ giúp) - ^ a b c Kabil, Omer; Banerjee, Ruma (10 tháng 2 năm 2014). “Enzymology of H2S Biogenesis, Decay and Signaling”. Antioxidants & Redox Signaling. 20 (5): 770–782. doi:10.1089/ars.2013.5339. ISSN 1523-0864. PMC 3910450. PMID 23600844.
- ^ a b c Kabil, Omer; Vitvitsky, Victor; Xie, Peter; Banerjee, Ruma (15 tháng 7 năm 2011). “The Quantitative Significance of the Transsulfuration Enzymes for H2S Production in Murine Tissues”. Antioxidants & Redox Signaling. 15 (2): 363–372. doi:10.1089/ars.2010.3781. ISSN 1523-0864. PMC 3118817. PMID 21254839.
- ^ Francois Pouliquen; Claude Blanc; Emmanuel Arretz; Ives Labat; Jacques Tournier-Lasserve; Alain Ladousse; Jean Nougayrede; Gérard Savin; Raoul Ivaldi (200). “Hydrogen Sulfide”. Ullmann's Encyclopedia of Chemical Industry. doi:10.1002/14356007.a13_467. ISBN 978-3527306732.
- ^ Francois Pouliquen; Claude Blanc; Emmanuel Arretz; Ives Labat; Jacques Tournier-Lasserve; Alain Ladousse; Jean Nougayrede; Gérard Savin; Raoul Ivaldi (200). “Hydrogen Sulfide”. Ullmann's Encyclopedia of Chemical Industry. doi:10.1002/14356007.a13_467. ISBN 978-3527306732.
- ^ Khazaei, A. (2012). “Synthesis of thiophenols using sodium sulfide in acidic media”. Synlett. 23 (13): 1893–1896. doi:10.1055/s-0032-1316557. Đã bỏ qua tham số không rõ
|displayauthors=(gợi ý|display-authors=) (trợ giúp)
Liên kết ngoài
| Wikimedia Commons có thêm hình ảnh và phương tiện truyền tải về Hydro sulfide. |
