Khác biệt giữa bản sửa đổi của “Insulin”
Không có tóm lược sửa đổi |
Không có tóm lược sửa đổi |
||
| Dòng 12: | Dòng 12: | ||
Insulin là hormone peptide đầu tiên được phát hiện. <ref name=":0">{{Chú thích sách|title=Endotext|vauthors=Weiss M, Steiner DF, Philipson LH|date=2000|publisher=MDText.com, Inc.|veditors=Feingold KR, Anawalt B, Boyce A, Chrousos G, Dungan K, Grossman A, Hershman JM, Kaltsas G, Koch C, Kopp P, Korbonits M, McLachlan R, Morley JE, New M, Perreault L, Purnell J, Rebar R, Singer F, Trence DL, Vinik A, Wilson DP|chapter=Insulin Biosynthesis, Secretion, Structure, and Structure-Activity Relationships|pmid=25905258|access-date=2020-02-18|display-editors=6|chapter-url=http://www.ncbi.nlm.nih.gov/books/NBK279029/}}</ref> [[Frederick Banting]] và [[ Charles Herbert hay nhất|Charles Herbert Best]], làm việc trong phòng thí nghiệm của [[John James Rickard Macleod|JJR Macleod]] tại [[Đại học Toronto]], là những người đầu tiên phân lập insulin từ tuyến tụy chó vào năm 1921. [[Frederick Sanger|Frederick Sanger đã giải]] trình tự cấu trúc axit amin vào năm 1951, khiến insulin trở thành protein đầu tiên được giải trình tự đầy đủ. <ref name="Stretton_2002">{{Chú thích tạp chí|vauthors=Stretton AO|date=October 2002|title=The first sequence. Fred Sanger and insulin|journal=Genetics|volume=162|issue=2|pages=527–32|pmc=1462286|pmid=12399368}}</ref> [[Cấu trúc tinh thể]] của insulin ở trạng thái rắn được xác định bởi [[Dorothy Hodgkin]] vào năm 1969. Insulin cũng là protein đầu tiên được tổng hợp hóa học và sản xuất bằng [[DNA tái tổ hợp|công nghệ tái tổ hợp DNA]] . <ref>{{Chú thích web|url=https://www.diabetes.co.uk/insulin/history-of-insulin.html|tựa đề=The discovery and development of insulin as a medical treatment can be traced back to the 19th century.|tác giả=Editor|ngày=2019-01-15|website=Diabetes|ngôn ngữ=en-GB|ngày truy cập=2020-02-17}}</ref> Nó nằm trong [[Danh sách các thuốc thiết yếu của WHO|Danh sách các loại thuốc thiết yếu của WHO]], gồm các loại thuốc quan trọng nhất cần có trong [[hệ thống y tế]] cơ bản. <ref name="WHO2015E">{{Chú thích web|url=http://www.who.int/medicines/publications/essentialmedicines/EML2015_8-May-15.pdf|tựa đề=19th WHO Model List of Essential Medicines (April 2015)|ngày=April 2015|nhà xuất bản=WHO|ngày truy cập=May 10, 2015}}</ref> |
Insulin là hormone peptide đầu tiên được phát hiện. <ref name=":0">{{Chú thích sách|title=Endotext|vauthors=Weiss M, Steiner DF, Philipson LH|date=2000|publisher=MDText.com, Inc.|veditors=Feingold KR, Anawalt B, Boyce A, Chrousos G, Dungan K, Grossman A, Hershman JM, Kaltsas G, Koch C, Kopp P, Korbonits M, McLachlan R, Morley JE, New M, Perreault L, Purnell J, Rebar R, Singer F, Trence DL, Vinik A, Wilson DP|chapter=Insulin Biosynthesis, Secretion, Structure, and Structure-Activity Relationships|pmid=25905258|access-date=2020-02-18|display-editors=6|chapter-url=http://www.ncbi.nlm.nih.gov/books/NBK279029/}}</ref> [[Frederick Banting]] và [[ Charles Herbert hay nhất|Charles Herbert Best]], làm việc trong phòng thí nghiệm của [[John James Rickard Macleod|JJR Macleod]] tại [[Đại học Toronto]], là những người đầu tiên phân lập insulin từ tuyến tụy chó vào năm 1921. [[Frederick Sanger|Frederick Sanger đã giải]] trình tự cấu trúc axit amin vào năm 1951, khiến insulin trở thành protein đầu tiên được giải trình tự đầy đủ. <ref name="Stretton_2002">{{Chú thích tạp chí|vauthors=Stretton AO|date=October 2002|title=The first sequence. Fred Sanger and insulin|journal=Genetics|volume=162|issue=2|pages=527–32|pmc=1462286|pmid=12399368}}</ref> [[Cấu trúc tinh thể]] của insulin ở trạng thái rắn được xác định bởi [[Dorothy Hodgkin]] vào năm 1969. Insulin cũng là protein đầu tiên được tổng hợp hóa học và sản xuất bằng [[DNA tái tổ hợp|công nghệ tái tổ hợp DNA]] . <ref>{{Chú thích web|url=https://www.diabetes.co.uk/insulin/history-of-insulin.html|tựa đề=The discovery and development of insulin as a medical treatment can be traced back to the 19th century.|tác giả=Editor|ngày=2019-01-15|website=Diabetes|ngôn ngữ=en-GB|ngày truy cập=2020-02-17}}</ref> Nó nằm trong [[Danh sách các thuốc thiết yếu của WHO|Danh sách các loại thuốc thiết yếu của WHO]], gồm các loại thuốc quan trọng nhất cần có trong [[hệ thống y tế]] cơ bản. <ref name="WHO2015E">{{Chú thích web|url=http://www.who.int/medicines/publications/essentialmedicines/EML2015_8-May-15.pdf|tựa đề=19th WHO Model List of Essential Medicines (April 2015)|ngày=April 2015|nhà xuất bản=WHO|ngày truy cập=May 10, 2015}}</ref> |
||
== |
== Sự tiến hóa và phân bố loài == |
||
Insulin có thể có nguồn gốc từ hơn một tỷ năm trước. <ref name="Alzira">{{Chú thích tạp chí|vauthors=de Souza AM, López JA|year=2004|title=Insulin or insulin-like studies on unicellular organisms: a review|journal=Braz. Arch. Biol. Technol.|volume=47|issue=6|pages=973–81|doi=10.1590/S1516-89132004000600017|doi-access=free}}</ref> Nguồn gốc phân tử của insulin ít nhất là từ các [[Sinh vật nhân thực|sinh vật nhân chuẩn]] đơn bào đơn giản nhất. <ref name="LeRoith">{{Chú thích tạp chí|vauthors=LeRoith D, Shiloach J, Heffron R, Rubinovitz C, Tanenbaum R, Roth J|date=August 1985|title=Insulin-related material in microbes: similarities and differences from mammalian insulins|journal=Canadian Journal of Biochemistry and Cell Biology|volume=63|issue=8|pages=839–49|doi=10.1139/o85-106|pmid=3933801}}</ref> Ngoài động vật, protein giống như insulin cũng được biết là tồn tại ở các loài fungi và protista. <ref name="Alzira" /> |
|||
Insulin được tổng hợp trong tế bào beta ở đảo tuỵ bằng bộ máy tổng hợp protein tế bào (bắt đầu bằng quá trình tổng hợp RNA của insulin, dịch mã để tổng hợp các tiền hormone (preprohormone), gọi là preproinsulin, tại hệ thống lưới nội nguyên sinh, tiếp theo là biến đổi preproinsulin hình thành các tiền insulin (proinsulin). Sau đó là quá trình hình thành insulin tại bộ máy golgi. Sau khi được tổng hợp, insulin được 'gói' trong các hạt tiết để qua màng tế bào và vào máu. Khoảng 1/6 proinsulin không biến đổi thành insulin. Ở những bệnh nhân đái tháo đường do thiếu insulin vẫn có sự hiện diện của proinsulin nhưng không may, nó không thực hiện bù được chức năng của insulin. |
|||
Insulin được sản xuất bởi [[ Tế bào Beta|các tế bào beta]] của các [[tiểu đảo tụy]] ở hầu hết các động vật có xương sống và bởi [[ Cơ thể Brockmann|cơ thể Brockmann]] ở một số [[Phân thứ lớp Cá xương thật|loài cá teleost]] . <ref>{{Chú thích tạp chí|vauthors=Wright JR, Yang H, Hyrtsenko O, Xu BY, Yu W, Pohajdak B|date=2014|title=A review of piscine islet xenotransplantation using wild-type tilapia donors and the production of transgenic tilapia expressing a "humanized" tilapia insulin|journal=Xenotransplantation|volume=21|issue=6|pages=485–95|doi=10.1111/xen.12115|pmc=4283710|pmid=25040337}}</ref> [[ Ốc nón|Ốc sên]] ''[[Ốc nón địa lý|Conus geographus]]'' và ''[[Conus tulipa]]'', ốc biển có nọc độc săn cá nhỏ, sử dụng các dạng insulin biến đổi trong cocktail nọc độc của chúng. Độc tố insulin, có cấu trúc gần với cá hơn là insulin tự nhiên của ốc sên, làm chậm con cá bằng cách hạ thấp mức đường huyết của chúng. <ref>{{Chú thích báo|url=https://www.theguardian.com/science/2015/jan/19/venomous-sea-snail-insulin-prey-conus-geographus|title=Deadly sea snail uses weaponised insulin to make its prey sluggish|date=19 January 2015|work=}}</ref> <ref name="pmid25605914">{{Chú thích tạp chí|vauthors=Safavi-Hemami H, Gajewiak J, Karanth S, Robinson SD, Ueberheide B, Douglass AD, Schlegel A, Imperial JS, Watkins M, Bandyopadhyay PK, Yandell M, Li Q, Purcell AW, Norton RS, Ellgaard L, Olivera BM|date=February 2015|title=Specialized insulin is used for chemical warfare by fish-hunting cone snails|journal=Proceedings of the National Academy of Sciences of the United States of America|volume=112|issue=6|pages=1743–48|bibcode=2015PNAS..112.1743S|doi=10.1073/pnas.1423857112|pmc=4330763|pmid=25605914}}</ref> |
|||
Sau khi vào máu, insulin ở dạng tự do và có thời gian bán phân huỷ trong huyết tương khoảng 6 phút, chính vì vậy, sau khi tiết khoảng 10-15 phút insulin sẽ không còn hiện diện trong máu nữa. Nếu không kết hợp được với các thụ quan (insulin receptor), insulin sẽ bị phân huỷ tại gan và một phần nhỏ tại thận. |
|||
== Gen == |
|||
Các [[ Preproinsulin|preproinsulin]], tiền thân của insulin được mã hóa bởi các [[gen]] ''INS'', nằm trên nhiễm sắc thể 11p15.5. <ref name="entrez">{{Chú thích web|url=https://www.ncbi.nlm.nih.gov/sites/entrez?Db=gene&Cmd=ShowDetailView&TermToSearch=3630|tựa đề=Entrez Gene: INS insulin|ngày truy cập=}}</ref> <ref name="pmid6243748">{{Chú thích tạp chí|vauthors=Bell GI, Pictet RL, Rutter WJ, Cordell B, Tischer E, Goodman HM|date=March 1980|title=Sequence of the human insulin gene|journal=Nature|volume=284|issue=5751|pages=26–32|bibcode=1980Natur.284...26B|doi=10.1038/284026a0|pmid=6243748}}</ref> |
|||
=== Các alen === |
|||
Một loạt các [[alen]] đột biến với những thay đổi trong khu vực mã hóa đã được xác định. Một [[ Gen liên kết|gen đọc qua]], INS-IGF2, trùng lặp với gen này ở vùng 5 'và với gen IGF2 ở vùng 3'. <ref name="entrez2">{{Chú thích web|url=https://www.ncbi.nlm.nih.gov/sites/entrez?Db=gene&Cmd=ShowDetailView&TermToSearch=3630|tựa đề=Entrez Gene: INS insulin|ngày truy cập=}}</ref> |
|||
=== Quy định === |
|||
[[Tập tin:Insulin_gene_activation.png|liên_kết=https://vi.wikipedia.org/wiki/T%E1%BA%ADp%20tin:Insulin_gene_activation.png|nhỏ|500x500px|Sơ đồ điều hòa insulin khi đường huyết cao]] |
|||
Trong các tế bào beta của tụy, [[glucose]] là tác nhân kích thích sinh lý chính để điều hòa tổng hợp insulin. Insulin chủ yếu được điều hòa thông qua các [[ Yếu tố phiên mã|yếu tố phiên mã]] [[ PDX1|PDX1]], [[ Thần kinh1|NeuroD1]] và [[ MafA|MafA]] . <ref name="Bernardo_2008">{{Chú thích tạp chí|vauthors=Bernardo AS, Hay CW, Docherty K|date=November 2008|title=Pancreatic transcription factors and their role in the birth, life and survival of the pancreatic beta cell|url=https://hal.archives-ouvertes.fr/hal-00532050/file/PEER_stage2_10.1016%252Fj.mce.2008.07.006.pdf|department=review|journal=Molecular and Cellular Endocrinology|volume=294|issue=1–2|pages=1–9|doi=10.1016/j.mce.2008.07.006|pmid=18687378}}</ref> <ref name="Rutter_2015">{{Chú thích tạp chí|vauthors=Rutter GA, Pullen TJ, Hodson DJ, Martinez-Sanchez A|date=March 2015|title=Pancreatic β-cell identity, glucose sensing and the control of insulin secretion|url=https://semanticscholar.org/paper/821b0f8dc5b1bca7828a1f7698c543d56243d0c3|department=review|journal=The Biochemical Journal|volume=466|issue=2|pages=203–18|doi=10.1042/BJ20141384|pmid=25697093|doi-access=free}}</ref> <ref name="Rutter_2000">{{Chú thích tạp chí|vauthors=Rutter GA, Tavaré JM, Palmer DG|date=June 2000|title=Regulation of Mammalian Gene Expression by Glucose|department=review|journal=News in Physiological Sciences|volume=15|issue=3|pages=149–54|doi=10.1152/physiologyonline.2000.15.3.149|pmid=11390898|doi-access=free}}</ref> <ref name="Poitout_2006">{{Chú thích tạp chí|vauthors=Poitout V, Hagman D, Stein R, Artner I, Robertson RP, Harmon JS|date=April 2006|title=Regulation of the insulin gene by glucose and d acids|department=review|journal=The Journal of Nutrition|volume=136|issue=4|pages=873–76|doi=10.1093/jn/136.4.873|pmc=1853259|pmid=16549443}}</ref> |
|||
Trong trạng thái glucose thấp, [[ PDX1|PDX1]] (protein homeobox tụy và tá tràng 1) nằm ở ngoại vi hạt nhân do kết quả của sự tương tác với [[ HDAC1|HDAC1]] và [[ HDAC2|2]], <ref name="Vaulont_2000">{{Chú thích tạp chí|vauthors=Vaulont S, Vasseur-Cognet M, Kahn A|date=October 2000|title=Glucose regulation of gene transcription|department=review|journal=The Journal of Biological Chemistry|volume=275|issue=41|pages=31555–58|doi=10.1074/jbc.R000016200|pmid=10934218|doi-access=free}}</ref> dẫn đến điều hòa giảm bài tiết insulin. <ref name="Christensen_2011">{{Chú thích tạp chí|vauthors=Christensen DP, Dahllöf M, Lundh M, Rasmussen DN, Nielsen MD, Billestrup N, Grunnet LG, Mandrup-Poulsen T|date=2011|title=Histone deacetylase (HDAC) inhibition as a novel treatment for diabetes mellitus|url=|journal=Molecular Medicine|volume=17|issue=5–6|pages=378–90|doi=10.2119/molmed.2011.00021|pmc=3105132|pmid=21274504}}</ref> Sự gia tăng [[Glucose|nồng]] độ [[glucose]] trong máu gây ra [[Phosphoryl hóa|sự phosphoryl hóa]] [[ PDX1|PDX1]], dẫn đến việc nó trải qua quá trình chuyển vị hạt nhân và liên kết yếu tố A3 trong chất kích thích insulin. <ref name="Wang_2016">{{Chú thích tạp chí|vauthors=Wang W, Shi Q, Guo T, Yang Z, Jia Z, Chen P, Zhou C|date=June 2016|title=PDX1 and ISL1 differentially coordinate with epigenetic modifications to regulate insulin gene expression in varied glucose concentrations|journal=Molecular and Cellular Endocrinology|volume=428|issue=|pages=38–48|doi=10.1016/j.mce.2016.03.019|pmid=26994512|doi-access=free}}</ref> Sau khi chuyển vị trí, nó tương tác với các hệ số điều khiển [[ EP300|HAT p300]] và [[ TẬP 7|SETD7]] . [[ PDX1|PDX1]] ảnh hưởng đến việc sửa đổi [[histone]] thông qua [[acetyl hóa]] và khử [[Acetyl hóa|acetyl]] cũng như [[ Methyl hóa|methyl hóa]] . Nó cũng được cho là để ức chế [[glucagon]] . <ref>{{Chú thích tạp chí|vauthors=Wang X, Wei X, Pang Q, Yi F|date=August 2012|title=Histone deacetylases and their inhibitors: molecular mechanisms and therapeutic implications in diabetes mellitus|journal=Acta Pharmaceutica Sinica B|volume=2|issue=4|pages=387–95|doi=10.1016/j.apsb.2012.06.005|doi-access=free}}</ref> |
|||
[[ Thần kinh1|NeuroD1]], còn được gọi là β2, điều chỉnh quá trình exocytosis insulin trong [[ Tế bào|tế bào]] [[ Thần kinh1|reat]] bằng cách trực tiếp gây ra sự biểu hiện của [[Gen|các gen]] liên quan đến exocytosis. <ref name="Andrali_2008">{{Chú thích tạp chí|vauthors=Andrali SS, Sampley ML, Vanderford NL, Ozcan S|date=October 2008|title=Glucose regulation of insulin gene expression in pancreatic beta-cells|department=review|journal=The Biochemical Journal|volume=415|issue=1|pages=1–10|doi=10.1042/BJ20081029|pmid=18778246|doi-access=free}}</ref> Nó được định vị trong [[ Cytosol|cytosol]], nhưng để đáp ứng với [[glucose]] cao, nó bị [[ Glycosyl hóa|glycosyl hóa]] bởi [[ OGT (gen)|OGT]] và / hoặc [[phosphoryl hóa]] bởi [[ Kinase điều hòa tín hiệu ngoại bào|ERK]], gây ra sự chuyển vị vào nhân. Trong nhân β2 dị hóa với [[ TCF3|E47]], liên kết với yếu tố E1 của chất kích thích insulin và tuyển dụng đồng hoạt hóa [[ EP300|p300]] mà acetylates 2. Nó có thể tương tác với các yếu tố phiên mã khác cũng như kích hoạt gen insulin. <ref name="Andrali_2008" /> |
|||
[[ MafA|MafA]] bị suy giảm do các [[proteasome]] khi mức [[Glucose|đường huyết]] thấp. Nồng độ [[Glucose|glucose tăng]] làm cho một protein [[ Glycosyl hóa|glycosylated]] không xác định. Protein này hoạt động như một yếu tố phiên mã cho [[ MafA|MafA]] theo cách không xác định và [[ MafA|MafA]] được vận chuyển ra khỏi tế bào. [[ MafA|MafA]] sau đó được chuyển trở lại vào nhân nơi nó liên kết với yếu tố C1 của chất kích thích insulin. <ref name="pmid19393272">{{Chú thích tạp chí|vauthors=Kaneto H, Matsuoka TA, Kawashima S, Yamamoto K, Kato K, Miyatsuka T, Katakami N, Matsuhisa M|date=July 2009|title=Role of MafA in pancreatic beta-cells|url=|journal=Advanced Drug Delivery Reviews|volume=61|issue=7–8|pages=489–96|doi=10.1016/j.addr.2008.12.015|pmid=19393272}}</ref> <ref name="Aramata_2007">{{Chú thích tạp chí|vauthors=Aramata S, Han SI, Kataoka K|date=December 2007|title=Roles and regulation of transcription factor MafA in islet beta-cells|url=|journal=Endocrine Journal|volume=54|issue=5|pages=659–66|doi=10.1507/endocrj.KR-101|pmid=17785922|doi-access=free}}</ref> |
|||
Các yếu tố phiên mã này hoạt động hiệp đồng và trong một sắp xếp phức tạp. Tăng [[Glucose|đường huyết]] sau một thời gian có thể phá hủy khả năng liên kết của các protein này, và do đó làm giảm lượng insulin tiết ra, gây ra [[Tiểu đường|bệnh tiểu đường]] . Các hoạt động liên kết giảm có thể được trung gian bởi [[Ứng kích ôxi hóa|stress oxy hóa]] gây ra bởi [[glucose]] và [[Chất chống ôxy hóa|chất chống oxy hóa]] được cho là để ngăn chặn sự giảm bài tiết insulin trong [[ Tế bào|các tế bào β]] glucotoxic tụy. Các phân tử tín hiệu căng thẳng và các [[ Loài oxy phản ứng|loài oxy phản ứng]] ức chế gen insulin bằng cách can thiệp vào các đồng yếu tố liên kết các yếu tố phiên mã và chính các yếu tố phiên mã. <ref name="Kaneto_2012">{{Chú thích tạp chí|vauthors=Kaneto H, Matsuoka TA|date=October 2012|title=Involvement of oxidative stress in suppression of insulin biosynthesis under diabetic conditions|url=|journal=International Journal of Molecular Sciences|volume=13|issue=10|pages=13680–90|doi=10.3390/ijms131013680|pmc=3497347|pmid=23202973}}</ref> |
|||
Một số [[ Trình tự quy định|trình tự quy định]] trong khu vực [[Vùng gen khởi động|khởi động]] của gen insulin người liên kết với [[ Yếu tố phiên mã|các yếu tố phiên mã]] . Nói chung, các [[ Một hộp|hộp A]] liên kết với các yếu tố [[ Pdx1|Pdx1]], [[ Hộp điện tử|hộp E]] liên kết với [[ Thần kinh|NeuroD]], hộp C liên kết với [[ MafA|MafA]] và [[ Phần tử phản hồi CAMP|các yếu tố phản ứng cAMP]] với [[ TẠO|CREB]] . Ngoài ra còn có [[Trình tự tắt (di truyền)|trình tự tắt]] ức chế phiên mã. |
|||
== Cấu trúc == |
|||
[[Tập tin:InsulinMonomer.jpg|liên_kết=https://vi.wikipedia.org/wiki/T%E1%BA%ADp%20tin:InsulinMonomer.jpg|nhỏ|250x250px|'''Cấu trúc của insulin.''' Phía bên trái là mô hình lấp đầy không gian của monome insulin, được cho là có hoạt tính sinh học. [[Cacbon|Carbon]] có màu xanh lá cây, trắng [[hydro]], đỏ [[Ôxy|oxy]] và xanh [[nitơ]] . Ở phía bên phải là một [[ Sơ đồ ruy băng|sơ đồ ruy băng]] của hexamer insulin, được cho là dạng được lưu trữ. Một đơn vị monome được làm nổi bật với chuỗi A màu xanh lam và chuỗi B màu lục lam. Màu vàng biểu thị các liên kết disulfide và các quả cầu màu đỏ tươi là các ion kẽm.]] |
|||
Trái với suy nghĩ ban đầu rằng các hoocmon nói chung sẽ là các phân tử hóa học nhỏ, vì hoóc môn peptide đầu tiên được biết về cấu trúc của nó, insulin được tìm thấy là khá lớn. <ref name=":02">{{Chú thích sách|title=Endotext|vauthors=Weiss M, Steiner DF, Philipson LH|date=2000|publisher=MDText.com, Inc.|veditors=Feingold KR, Anawalt B, Boyce A, Chrousos G, Dungan K, Grossman A, Hershman JM, Kaltsas G, Koch C, Kopp P, Korbonits M, McLachlan R, Morley JE, New M, Perreault L, Purnell J, Rebar R, Singer F, Trence DL, Vinik A, Wilson DP|chapter=Insulin Biosynthesis, Secretion, Structure, and Structure-Activity Relationships|pmid=25905258|access-date=2020-02-18|display-editors=6|chapter-url=http://www.ncbi.nlm.nih.gov/books/NBK279029/}}</ref> Một protein đơn (monome) của insulin người bao gồm 51 [[axit amin]] và có [[khối lượng phân tử]] là 5808 [[Đơn vị khối lượng nguyên tử|Da]] . Công [[Công thức hóa học|thức phân tử]] của insulin người là C<sub>257</sub>H<sub>383</sub>N<sub>65</sub>O<sub>77</sub>S<sub>6</sub>. <ref>{{Chú thích web|url=https://pubchem.ncbi.nlm.nih.gov/compound/16129672|tựa đề=Insulin human|nhà xuất bản=[[PubChem]]|ngày truy cập=26 February 2019}}</ref> Nó là sự kết hợp của hai chuỗi peptide ( [[ Protein dimer|dimer]] ) được đặt tên là chuỗi A và chuỗi B, được liên kết với nhau bằng hai [[ Liên kết disulfide|liên kết disulfide]] . Chuỗi A bao gồm 21 axit amin, trong khi chuỗi B bao gồm 30 dư lượng. Các liên kết disulfide liên kết (interchain) được hình thành tại dư lượng cystein giữa các vị trí A7 - B7 và A20 - B19. Có một liên kết disulfide (xâm nhập) bổ sung trong chuỗi A giữa dư lượng cystein tại các vị trí A4 và A11. Chuỗi A thể hiện hai vùng xoắn ốc ở A1 - A8 và A12 - A19 là phản song song; trong khi chuỗi B có một chuỗi trung tâm (bao gồm dư lượng B9 - B19) nằm bên cạnh liên kết disulfide ở hai bên và hai tấm ((bao gồm B7 - B10 và B20 - B23). <ref name=":02" /> <ref name=":1">{{Chú thích tạp chí|vauthors=Fu Z, Gilbert ER, Liu D|date=January 2013|title=Regulation of insulin synthesis and secretion and pancreatic Beta-cell dysfunction in diabetes|journal=Current Diabetes Reviews|volume=9|issue=1|pages=25–53|doi=10.2174/157339913804143225|pmc=3934755|pmid=22974359}}</ref> |
|||
Trình tự axit amin của insulin được [[ Trình tự bảo tồn|bảo tồn mạnh mẽ]] và chỉ thay đổi một chút giữa các loài. Insulin [[Bò nhà|bò]] khác với con người chỉ có ba dư lượng [[axit amin]] và insulin [[Chi Lợn|lợn]] trong một. Ngay cả insulin từ một số loài cá cũng tương tự như con người để có hiệu quả lâm sàng ở người. Insulin ở một số động vật không xương sống có trình tự khá giống với insulin người và có tác dụng sinh lý tương tự. Sự tương đồng mạnh mẽ được thấy trong chuỗi insulin của các loài khác nhau cho thấy nó đã được bảo tồn trong phần lớn lịch sử tiến hóa của động vật. Tuy nhiên, C-peptide của [[ Proinsulin|proinsulin]] khác nhau nhiều hơn giữa các loài; nó cũng là một hoóc môn, nhưng là thứ yếu. <ref name=":12">{{Chú thích tạp chí|vauthors=Fu Z, Gilbert ER, Liu D|date=January 2013|title=Regulation of insulin synthesis and secretion and pancreatic Beta-cell dysfunction in diabetes|journal=Current Diabetes Reviews|volume=9|issue=1|pages=25–53|doi=10.2174/157339913804143225|pmc=3934755|pmid=22974359}}</ref> |
|||
Insulin được sản xuất và lưu trữ trong cơ thể dưới dạng hexamer (một đơn vị gồm sáu phân tử insulin), trong khi dạng hoạt động là monome. Hexamer có kích thước khoảng 36000 Da. Sáu phân tử được liên kết với nhau như ba đơn vị dimeric để tạo thành phân tử đối xứng. Một tính năng quan trọng là sự hiện diện của các nguyên tử kẽm (Zn <sup>2+</sup> ) trên trục đối xứng, được bao quanh bởi ba phân tử nước và ba dư lượng histamine ở vị trí B10. <ref name=":03">{{Chú thích sách|title=Endotext|vauthors=Weiss M, Steiner DF, Philipson LH|date=2000|publisher=MDText.com, Inc.|veditors=Feingold KR, Anawalt B, Boyce A, Chrousos G, Dungan K, Grossman A, Hershman JM, Kaltsas G, Koch C, Kopp P, Korbonits M, McLachlan R, Morley JE, New M, Perreault L, Purnell J, Rebar R, Singer F, Trence DL, Vinik A, Wilson DP|chapter=Insulin Biosynthesis, Secretion, Structure, and Structure-Activity Relationships|pmid=25905258|access-date=2020-02-18|display-editors=6|chapter-url=http://www.ncbi.nlm.nih.gov/books/NBK279029/}}</ref> <ref name=":13">{{Chú thích tạp chí|vauthors=Fu Z, Gilbert ER, Liu D|date=January 2013|title=Regulation of insulin synthesis and secretion and pancreatic Beta-cell dysfunction in diabetes|journal=Current Diabetes Reviews|volume=9|issue=1|pages=25–53|doi=10.2174/157339913804143225|pmc=3934755|pmid=22974359}}</ref> |
|||
Hexamer là một dạng không hoạt động với sự ổn định lâu dài, phục vụ như một cách để giữ cho insulin phản ứng cao được bảo vệ, nhưng vẫn có sẵn. Việc chuyển đổi hexamer-monome là một trong những khía cạnh trung tâm của các công thức insulin để tiêm. Hexamer ổn định hơn nhiều so với monome, đó là mong muốn vì lý do thực tế; tuy nhiên, monome là một loại thuốc phản ứng nhanh hơn nhiều vì tốc độ khuếch tán có liên quan nghịch với kích thước hạt. Một loại thuốc phản ứng nhanh có nghĩa là tiêm insulin không phải đi trước bữa ăn hàng giờ, điều này sẽ giúp những người mắc bệnh tiểu đường linh hoạt hơn trong lịch trình hàng ngày. <ref name="pmid16158220">{{Chú thích tạp chí|vauthors=Dunn MF|date=August 2005|title=Zinc-ligand interactions modulate assembly and stability of the insulin hexamer -- a review|journal=Biometals|volume=18|issue=4|pages=295–303|doi=10.1007/s10534-005-3685-y|pmid=16158220}}</ref> Insulin có thể tổng hợp và tạo thành [[ Tờ Beta|các tấm beta]] xen kẽ [[ Fibrillar|fibrillar]] . Điều này có thể gây ra [[Bệnh thoái hóa tinh bột|bệnh amyloidosis]] và ngăn ngừa việc lưu trữ insulin trong thời gian dài. <ref name="pmid19864624">{{Chú thích tạp chí|vauthors=Ivanova MI, Sievers SA, Sawaya MR, Wall JS, Eisenberg D|date=November 2009|title=Molecular basis for insulin fibril assembly|journal=Proceedings of the National Academy of Sciences of the United States of America|volume=106|issue=45|pages=18990–5|bibcode=2009PNAS..10618990I|doi=10.1073/pnas.0910080106|pmc=2776439|pmid=19864624}}</ref> |
|||
== Tổng hợp, tác dụng sinh lý và thoái hóa == |
|||
=== Tổng hợp === |
|||
Insulin được sản xuất trong [[Tụy|tuyến tụy]] và cơ thể Brockmann (ở một số loài cá) và được giải phóng khi phát hiện bất kỳ kích thích nào. Những kích thích này bao gồm sự gia tăng nồng độ axit amin và glucose trong huyết tương do quá trình tiêu hóa thức ăn. <ref name="MedicalPhysiology">{{Chú thích sách|title=Medical physiology : principles for clinical medicine|last=Rhoades|first=Rodney A.|last2=Bell|first2=David R.|date=2009|publisher=Lippincott Williams & Wilkins|isbn=978-0-7817-6852-8|edition=3rd|location=Philadelphia|pages=644–47|name-list-format=vanc}}</ref> [[Cacbohydrat|Carbonhydrate]] có thể là polymer của các loại đường đơn giản hoặc chính các loại đường đơn giản. Nếu carbohydrate bao gồm glucose, thì glucose đó sẽ được hấp thụ vào máu và mức glucose trong máu sẽ bắt đầu tăng lên. Trong các tế bào đích, insulin bắt đầu [[ Truyền tín hiệu|truyền tín hiệu]], có tác dụng tăng hấp thu và lưu trữ [[glucose]] . Cuối cùng, insulin bị thoái hóa, chấm dứt phản ứng. |
|||
[[Tập tin:Insulin_path.svg|liên_kết=https://vi.wikipedia.org/wiki/T%E1%BA%ADp%20tin:Insulin_path.svg|nhỏ|566x566px|Insulin trải qua sửa đổi hậu biến rộng rãi dọc theo con đường sản xuất. Sản xuất và bài tiết phần lớn là độc lập; insulin chuẩn bị được lưu trữ chờ tiết. Cả C-peptide và insulin trưởng thành đều có hoạt tính sinh học. Các thành phần tế bào và protein trong hình ảnh này không được chia tỷ lệ.]] |
|||
Ở động vật có vú, insulin được tổng hợp trong tuyến tụy trong các tế bào beta. Một triệu đến ba triệu đảo nhỏ tụy tạo thành một phần [[Hệ nội tiết|nội tiết]] của tuyến tụy, chủ yếu là một [[Tuyến ngoại tiết|tuyến ngoại]] [[Tuyến|tiết]] . Phần nội tiết chỉ chiếm 2% tổng khối lượng của tuyến tụy. Trong các tiểu đảo tụy, các tế bào beta chiếm 65%-80% của tất cả các tế bào. {{Cần chú thích|date=July 2020}} |
|||
Insulin bao gồm hai chuỗi polypeptide, chuỗi A- và B-, được liên kết với nhau bằng liên kết disulfide. Tuy nhiên, lần đầu tiên nó được tổng hợp dưới dạng một polypeptide đơn gọi là [[ Preproinsulin|preproinsulin]] trong các tế bào beta. Preproinsulin chứa một [[ Peptide tín hiệu|peptide tín hiệu]] dư lượng 24 chỉ đạo chuỗi polypeptide mới sinh đến [[mạng lưới nội chất]] thô (RER). Peptide tín hiệu được phân cắt khi polypeptide được chuyển thành lum của RER, tạo thành [[ Proinsulin|proinsulin]] . <ref>{{Chú thích sách|url=https://books.google.com/?id=ohgjG0qAvfgC&pg=PA66#v=onepage|title=Joslin's Diabetes Mellitus|vauthors=Kahn CR, Weir GC|publisher=Lippincott Williams & Wilkins|year=2005|isbn=978-8493531836|edition=14th|pages=|author-link=C. Ronald Kahn}}</ref> Trong RER, proinsulin gấp thành hình dạng chính xác và 3 liên kết disulfide được hình thành. Khoảng 5 phút10 sau khi được lắp ráp trong mạng lưới nội chất, proinsulin được vận chuyển đến mạng lưới xuyên Golgi (TGN) nơi hình thành các hạt chưa trưởng thành. Vận chuyển đến TGN có thể mất khoảng 30 phút. |
|||
Proinsulin trải qua quá trình trưởng thành thành insulin hoạt động thông qua hoạt động của endopeptidase tế bào được gọi là [[ Prohormone convertase|prohormone convertase]] ( [[ Proprotein convertase 1|PC1]] và [[ Proprotein convertase 2|PC2]] ), cũng như [[ Carboxypeptidase E|carboxypeptidase E]] của exoprotease. <ref name="pmid16591494">{{Chú thích tạp chí|vauthors=Steiner DF, Oyer PE|date=February 1967|title=The biosynthesis of insulin and a probable precursor of insulin by a human islet cell adenoma|journal=Proceedings of the National Academy of Sciences of the United States of America|volume=57|issue=2|pages=473–80|bibcode=1967PNAS...57..473S|doi=10.1073/pnas.57.2.473|pmc=335530|pmid=16591494}}</ref> Các endopeptidase phân cắt ở 2 vị trí, giải phóng một đoạn gọi là [[ C-peptide|C-peptide]] và để lại 2 chuỗi peptide, chuỗi B- và A-, được liên kết bởi 2 liên kết disulfide. Các vị trí phân tách được đặt sau một cặp dư lượng cơ bản (lysine-64 và arginine-65, và arginine-31 và −32). Sau khi phân tách C-peptide, 2 cặp dư lượng cơ bản này được loại bỏ bởi carboxypeptidase. <ref name="creighton">{{Chú thích sách|url=https://archive.org/details/proteinsstructur0000crei/page/81|title=Proteins: Structures and Molecular Properties|last=Creighton|first=Thomas E|publisher=W H Freeman and Company|year=1993|isbn=978-0-7167-2317-2|edition=2nd|pages=[https://archive.org/details/proteinsstructur0000crei/page/81 81–83]|name-list-format=vanc}}</ref> [[ C-peptide|C-peptide]] là phần trung tâm của proinsulin và chuỗi proinsulin chính đi theo thứ tự "BCA" (chuỗi B và A được xác định trên cơ sở khối lượng và C-peptide được phát hiện sau đó). {{Cần chú thích|date=July 2020}} |
|||
==Tác động của insulin đến trao đổi carbohydrate== |
==Tác động của insulin đến trao đổi carbohydrate== |
||
Phiên bản lúc 12:12, ngày 2 tháng 8 năm 2020
Bài viết hoặc đoạn này cần được wiki hóa để đáp ứng tiêu chuẩn quy cách định dạng và văn phong của Wikipedia. |

Insulin ( /ˈɪn.sjʊ.lɪn/, [1] [2] từ Latin insula, nghĩa đen: 'đảo') là một hormone peptide được sản xuất bởi các tế bào beta của đảo tụy ; nó được coi là hormone đồng hóa chính của cơ thể. [3] Nó điều chỉnh sự chuyển hóa carbohydrate, chất béo và protein bằng cách thúc đẩy sự hấp thụ glucose từ máu vào tế bào gan, mỡ và cơ xương . [4] Trong các mô này, glucose được hấp thụ được chuyển đổi thành glycogen thông qua glycogenesis hoặc chất béo ( triglyceride ) thông qua quá trình lipogenesis, hoặc, trong trường hợp của gan, thành cả hai. [4] Sự sản xuất và bài tiết glucose của gan bị ức chế mạnh mẽ bởi nồng độ insulin cao trong máu. [5] Insulin lưu hành cũng ảnh hưởng đến quá trình tổng hợp protein trong nhiều loại mô. Do đó, nó là một hormone đồng hóa, thúc đẩy quá trình chuyển đổi các phân tử nhỏ trong máu thành các phân tử lớn bên trong các tế bào. Nồng độ insulin thấp trong máu có tác dụng ngược lại bằng cách thúc đẩy quá trình dị hóa lan rộng, đặc biệt là mỡ cơ thể dự trữ .
Các tế bào beta rất nhạy cảm với lượng đường trong máu để chúng tiết ra insulin vào máu để đáp ứng với mức glucose cao; và ức chế bài tiết insulin khi nồng độ glucose thấp. [6] Insulin tăng cường hấp thu glucose và chuyển hóa trong các tế bào, do đó làm giảm lượng đường trong máu. Các tế bào alpha lân cận của chúng, bằng cách lấy tín hiệu từ các tế bào beta, [6] tiết glucagon vào máu theo cách ngược lại: tăng tiết khi glucose trong máu thấp và giảm bài tiết khi nồng độ glucose cao. Glucagon làm tăng mức đường huyết bằng cách kích thích glycogenolysis và gluconeogenesis ở gan. [7] [6] Sự tiết insulin và glucagon vào máu để đáp ứng với nồng độ glucose trong máu là cơ chế chính của cân bằng nội môi glucose . [6]
Giảm hoặc mất hoạt động của insulin dẫn đến đái tháo đường, một tình trạng của lượng đường trong máu cao (tăng đường huyết). Có hai loại bệnh. Trong đái tháo đường týp 1, các tế bào beta bị phá hủy bởi phản ứng tự miễn dịch để insulin không còn có thể được tổng hợp hoặc tiết vào máu. [8] Trong đái tháo đường týp 2, sự phá hủy các tế bào beta ít rõ rệt hơn so với bệnh tiểu đường loại 1, và không phải do quá trình tự miễn dịch. Thay vào đó, có sự tích tụ amyloid trong các đảo nhỏ tụy, có khả năng phá vỡ giải phẫu và sinh lý của chúng. [9] Cơ chế bệnh sinh của bệnh tiểu đường loại 2 chưa được hiểu rõ nhưng giảm dân số tế bào beta đảo, giảm chức năng bài tiết của các tế bào beta đảo nhỏ tồn tại và kháng insulin mô ngoại biên có liên quan. [10] Bệnh tiểu đường loại 2 được đặc trưng bởi sự tăng tiết glucagon không bị ảnh hưởng và không đáp ứng với nồng độ glucose trong máu. Nhưng insulin vẫn được tiết vào máu để đáp ứng với đường huyết. [9] Kết quả là glucose tích lũy trong máu.
Protein insulin của con người bao gồm 51 axit amin và có khối lượng phân tử là 5808 Da. Nó là một dimer hetero của chuỗi A và chuỗi B, được liên kết với nhau bằng liên kết disulfide . Cấu trúc của Insulin thay đổi một chút giữa các loài động vật. Insulin từ các nguồn động vật khác nhau một chút về hiệu quả (về tác dụng chuyển hóa carbohydrate ) so với insulin người vì những biến thể này. Insulin lợn đặc biệt gần với phiên bản người và được sử dụng rộng rãi để điều trị bệnh nhân tiểu đường loại 1 trước khi insulin người có thể được sản xuất với số lượng lớn bằng công nghệ DNA tái tổ hợp . [11] [12] [13] [14]
Insulin là hormone peptide đầu tiên được phát hiện. [15] Frederick Banting và Charles Herbert Best, làm việc trong phòng thí nghiệm của JJR Macleod tại Đại học Toronto, là những người đầu tiên phân lập insulin từ tuyến tụy chó vào năm 1921. Frederick Sanger đã giải trình tự cấu trúc axit amin vào năm 1951, khiến insulin trở thành protein đầu tiên được giải trình tự đầy đủ. [16] Cấu trúc tinh thể của insulin ở trạng thái rắn được xác định bởi Dorothy Hodgkin vào năm 1969. Insulin cũng là protein đầu tiên được tổng hợp hóa học và sản xuất bằng công nghệ tái tổ hợp DNA . [17] Nó nằm trong Danh sách các loại thuốc thiết yếu của WHO, gồm các loại thuốc quan trọng nhất cần có trong hệ thống y tế cơ bản. [18]
Sự tiến hóa và phân bố loài
Insulin có thể có nguồn gốc từ hơn một tỷ năm trước. [19] Nguồn gốc phân tử của insulin ít nhất là từ các sinh vật nhân chuẩn đơn bào đơn giản nhất. [20] Ngoài động vật, protein giống như insulin cũng được biết là tồn tại ở các loài fungi và protista. [19]
Insulin được sản xuất bởi các tế bào beta của các tiểu đảo tụy ở hầu hết các động vật có xương sống và bởi cơ thể Brockmann ở một số loài cá teleost . [21] Ốc sên Conus geographus và Conus tulipa, ốc biển có nọc độc săn cá nhỏ, sử dụng các dạng insulin biến đổi trong cocktail nọc độc của chúng. Độc tố insulin, có cấu trúc gần với cá hơn là insulin tự nhiên của ốc sên, làm chậm con cá bằng cách hạ thấp mức đường huyết của chúng. [22] [23]
Gen
Các preproinsulin, tiền thân của insulin được mã hóa bởi các gen INS, nằm trên nhiễm sắc thể 11p15.5. [24] [25]
Các alen
Một loạt các alen đột biến với những thay đổi trong khu vực mã hóa đã được xác định. Một gen đọc qua, INS-IGF2, trùng lặp với gen này ở vùng 5 'và với gen IGF2 ở vùng 3'. [26]
Quy định
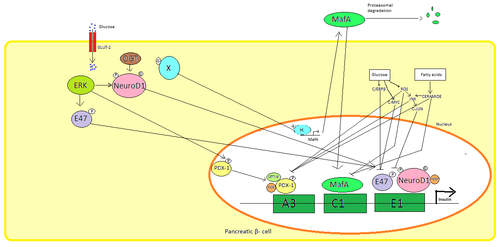
Trong các tế bào beta của tụy, glucose là tác nhân kích thích sinh lý chính để điều hòa tổng hợp insulin. Insulin chủ yếu được điều hòa thông qua các yếu tố phiên mã PDX1, NeuroD1 và MafA . [27] [28] [29] [30]
Trong trạng thái glucose thấp, PDX1 (protein homeobox tụy và tá tràng 1) nằm ở ngoại vi hạt nhân do kết quả của sự tương tác với HDAC1 và 2, [31] dẫn đến điều hòa giảm bài tiết insulin. [32] Sự gia tăng nồng độ glucose trong máu gây ra sự phosphoryl hóa PDX1, dẫn đến việc nó trải qua quá trình chuyển vị hạt nhân và liên kết yếu tố A3 trong chất kích thích insulin. [33] Sau khi chuyển vị trí, nó tương tác với các hệ số điều khiển HAT p300 và SETD7 . PDX1 ảnh hưởng đến việc sửa đổi histone thông qua acetyl hóa và khử acetyl cũng như methyl hóa . Nó cũng được cho là để ức chế glucagon . [34]
NeuroD1, còn được gọi là β2, điều chỉnh quá trình exocytosis insulin trong tế bào reat bằng cách trực tiếp gây ra sự biểu hiện của các gen liên quan đến exocytosis. [35] Nó được định vị trong cytosol, nhưng để đáp ứng với glucose cao, nó bị glycosyl hóa bởi OGT và / hoặc phosphoryl hóa bởi ERK, gây ra sự chuyển vị vào nhân. Trong nhân β2 dị hóa với E47, liên kết với yếu tố E1 của chất kích thích insulin và tuyển dụng đồng hoạt hóa p300 mà acetylates 2. Nó có thể tương tác với các yếu tố phiên mã khác cũng như kích hoạt gen insulin. [35]
MafA bị suy giảm do các proteasome khi mức đường huyết thấp. Nồng độ glucose tăng làm cho một protein glycosylated không xác định. Protein này hoạt động như một yếu tố phiên mã cho MafA theo cách không xác định và MafA được vận chuyển ra khỏi tế bào. MafA sau đó được chuyển trở lại vào nhân nơi nó liên kết với yếu tố C1 của chất kích thích insulin. [36] [37]
Các yếu tố phiên mã này hoạt động hiệp đồng và trong một sắp xếp phức tạp. Tăng đường huyết sau một thời gian có thể phá hủy khả năng liên kết của các protein này, và do đó làm giảm lượng insulin tiết ra, gây ra bệnh tiểu đường . Các hoạt động liên kết giảm có thể được trung gian bởi stress oxy hóa gây ra bởi glucose và chất chống oxy hóa được cho là để ngăn chặn sự giảm bài tiết insulin trong các tế bào β glucotoxic tụy. Các phân tử tín hiệu căng thẳng và các loài oxy phản ứng ức chế gen insulin bằng cách can thiệp vào các đồng yếu tố liên kết các yếu tố phiên mã và chính các yếu tố phiên mã. [38]
Một số trình tự quy định trong khu vực khởi động của gen insulin người liên kết với các yếu tố phiên mã . Nói chung, các hộp A liên kết với các yếu tố Pdx1, hộp E liên kết với NeuroD, hộp C liên kết với MafA và các yếu tố phản ứng cAMP với CREB . Ngoài ra còn có trình tự tắt ức chế phiên mã.
Cấu trúc

Trái với suy nghĩ ban đầu rằng các hoocmon nói chung sẽ là các phân tử hóa học nhỏ, vì hoóc môn peptide đầu tiên được biết về cấu trúc của nó, insulin được tìm thấy là khá lớn. [39] Một protein đơn (monome) của insulin người bao gồm 51 axit amin và có khối lượng phân tử là 5808 Da . Công thức phân tử của insulin người là C257H383N65O77S6. [40] Nó là sự kết hợp của hai chuỗi peptide ( dimer ) được đặt tên là chuỗi A và chuỗi B, được liên kết với nhau bằng hai liên kết disulfide . Chuỗi A bao gồm 21 axit amin, trong khi chuỗi B bao gồm 30 dư lượng. Các liên kết disulfide liên kết (interchain) được hình thành tại dư lượng cystein giữa các vị trí A7 - B7 và A20 - B19. Có một liên kết disulfide (xâm nhập) bổ sung trong chuỗi A giữa dư lượng cystein tại các vị trí A4 và A11. Chuỗi A thể hiện hai vùng xoắn ốc ở A1 - A8 và A12 - A19 là phản song song; trong khi chuỗi B có một chuỗi trung tâm (bao gồm dư lượng B9 - B19) nằm bên cạnh liên kết disulfide ở hai bên và hai tấm ((bao gồm B7 - B10 và B20 - B23). [39] [41]
Trình tự axit amin của insulin được bảo tồn mạnh mẽ và chỉ thay đổi một chút giữa các loài. Insulin bò khác với con người chỉ có ba dư lượng axit amin và insulin lợn trong một. Ngay cả insulin từ một số loài cá cũng tương tự như con người để có hiệu quả lâm sàng ở người. Insulin ở một số động vật không xương sống có trình tự khá giống với insulin người và có tác dụng sinh lý tương tự. Sự tương đồng mạnh mẽ được thấy trong chuỗi insulin của các loài khác nhau cho thấy nó đã được bảo tồn trong phần lớn lịch sử tiến hóa của động vật. Tuy nhiên, C-peptide của proinsulin khác nhau nhiều hơn giữa các loài; nó cũng là một hoóc môn, nhưng là thứ yếu. [42]
Insulin được sản xuất và lưu trữ trong cơ thể dưới dạng hexamer (một đơn vị gồm sáu phân tử insulin), trong khi dạng hoạt động là monome. Hexamer có kích thước khoảng 36000 Da. Sáu phân tử được liên kết với nhau như ba đơn vị dimeric để tạo thành phân tử đối xứng. Một tính năng quan trọng là sự hiện diện của các nguyên tử kẽm (Zn 2+ ) trên trục đối xứng, được bao quanh bởi ba phân tử nước và ba dư lượng histamine ở vị trí B10. [43] [44]
Hexamer là một dạng không hoạt động với sự ổn định lâu dài, phục vụ như một cách để giữ cho insulin phản ứng cao được bảo vệ, nhưng vẫn có sẵn. Việc chuyển đổi hexamer-monome là một trong những khía cạnh trung tâm của các công thức insulin để tiêm. Hexamer ổn định hơn nhiều so với monome, đó là mong muốn vì lý do thực tế; tuy nhiên, monome là một loại thuốc phản ứng nhanh hơn nhiều vì tốc độ khuếch tán có liên quan nghịch với kích thước hạt. Một loại thuốc phản ứng nhanh có nghĩa là tiêm insulin không phải đi trước bữa ăn hàng giờ, điều này sẽ giúp những người mắc bệnh tiểu đường linh hoạt hơn trong lịch trình hàng ngày. [45] Insulin có thể tổng hợp và tạo thành các tấm beta xen kẽ fibrillar . Điều này có thể gây ra bệnh amyloidosis và ngăn ngừa việc lưu trữ insulin trong thời gian dài. [46]
Tổng hợp, tác dụng sinh lý và thoái hóa
Tổng hợp
Insulin được sản xuất trong tuyến tụy và cơ thể Brockmann (ở một số loài cá) và được giải phóng khi phát hiện bất kỳ kích thích nào. Những kích thích này bao gồm sự gia tăng nồng độ axit amin và glucose trong huyết tương do quá trình tiêu hóa thức ăn. [47] Carbonhydrate có thể là polymer của các loại đường đơn giản hoặc chính các loại đường đơn giản. Nếu carbohydrate bao gồm glucose, thì glucose đó sẽ được hấp thụ vào máu và mức glucose trong máu sẽ bắt đầu tăng lên. Trong các tế bào đích, insulin bắt đầu truyền tín hiệu, có tác dụng tăng hấp thu và lưu trữ glucose . Cuối cùng, insulin bị thoái hóa, chấm dứt phản ứng.

Ở động vật có vú, insulin được tổng hợp trong tuyến tụy trong các tế bào beta. Một triệu đến ba triệu đảo nhỏ tụy tạo thành một phần nội tiết của tuyến tụy, chủ yếu là một tuyến ngoại tiết . Phần nội tiết chỉ chiếm 2% tổng khối lượng của tuyến tụy. Trong các tiểu đảo tụy, các tế bào beta chiếm 65%-80% của tất cả các tế bào. [cần dẫn nguồn]
Insulin bao gồm hai chuỗi polypeptide, chuỗi A- và B-, được liên kết với nhau bằng liên kết disulfide. Tuy nhiên, lần đầu tiên nó được tổng hợp dưới dạng một polypeptide đơn gọi là preproinsulin trong các tế bào beta. Preproinsulin chứa một peptide tín hiệu dư lượng 24 chỉ đạo chuỗi polypeptide mới sinh đến mạng lưới nội chất thô (RER). Peptide tín hiệu được phân cắt khi polypeptide được chuyển thành lum của RER, tạo thành proinsulin . [48] Trong RER, proinsulin gấp thành hình dạng chính xác và 3 liên kết disulfide được hình thành. Khoảng 5 phút10 sau khi được lắp ráp trong mạng lưới nội chất, proinsulin được vận chuyển đến mạng lưới xuyên Golgi (TGN) nơi hình thành các hạt chưa trưởng thành. Vận chuyển đến TGN có thể mất khoảng 30 phút.
Proinsulin trải qua quá trình trưởng thành thành insulin hoạt động thông qua hoạt động của endopeptidase tế bào được gọi là prohormone convertase ( PC1 và PC2 ), cũng như carboxypeptidase E của exoprotease. [49] Các endopeptidase phân cắt ở 2 vị trí, giải phóng một đoạn gọi là C-peptide và để lại 2 chuỗi peptide, chuỗi B- và A-, được liên kết bởi 2 liên kết disulfide. Các vị trí phân tách được đặt sau một cặp dư lượng cơ bản (lysine-64 và arginine-65, và arginine-31 và −32). Sau khi phân tách C-peptide, 2 cặp dư lượng cơ bản này được loại bỏ bởi carboxypeptidase. [50] C-peptide là phần trung tâm của proinsulin và chuỗi proinsulin chính đi theo thứ tự "BCA" (chuỗi B và A được xác định trên cơ sở khối lượng và C-peptide được phát hiện sau đó). [cần dẫn nguồn]
Tác động của insulin đến trao đổi carbohydrate
Insulin là Hormon duy nhất, làm giảm được nồng độ glucose trong máu. Ngược lại là Glucagon, có nhiệm vụ làm tăng nồng độ glucose trong máu. Cả Adrenaline, Cortisol và các hormon của tuyến giáp trạng cũng có tác dụng tăng nồng độ glucose trong máu.
Tác động của insulin đến chức năng dự trữ đường tại gan
Sau một bữa ăn nhiều tinh bột và đường, hàm lượng glucose trong máu tăng sẽ kích thích tế bào beta của đảo tuỵ tiết insulin. Insulin sẽ tác động đến các quá trình giữ, dự trữ và sử dụng glucose bởi các loại mô trong cơ thể đặc biệt là tại gan, cơ và mô mỡ.
Khi nồng độ glucose trong máu tăng cao (sau khi ăn, uống đồ uống có nhiều đường, truyền glucose v.v.), glucose sẽ được dự trữ trong gan dưới dạng glycogen. Khi hàm lượng đường trong máu giảm (khi đói, giữa hai bữa ăn...) glycogen sẽ biến đổi trở lại thành glucose để đi vào máu giữ cho lượng đường trong máu (gọi tắt là đường huyết) không hạ quá thấp.
Insulin tác động đến quá trình này như sau:
- Insulin ức chế phosphorylase, một enzyme biến đổi glycogen thành glucose
- Insulin làm tăng cường hấp thu glucose của các tế bào gan thông qua tác động của enzyme glucokinase (enzyme này tăng cường phosphoryl hoá giữ glucose không qua được màng tế bào để đi ra ngoài).
- Tăng cường hoạt tính của enzyme tổng hợp glycogen bao gồm phosphofructokinase dẫn đến giai đoạn hai của quá trình phosphoryl hoá phân tử glucose và glucose synthetase có tác dụng tạo chuỗi từ các monosaccharide để hình thành phân tử glycogen.
Các tác động này làm tăng lượng glycogen dự trữ trong gan (có thể chiếm 5-6% khối lượng của gan hay khoảng 100gram glycogen).
Thuốc Insulin
Insulin được bào chế nhân tạo dùng điều trị cho bệnh đái tháo đường. Người bị bệnh này hoặc bị thiếu insulin (tiểu đường loại I) hoặc có đề kháng insulin (tiểu đường loại II). Thuốc insulin thường là thuốc chích dưới da, có nhiều loại nhưng nằm trong hai dạng chính tùy theo tác dụng nhanh hay chậm. Dạng tác dụng nhanh dùng ngay trước bữa ăn, để tăng độ insulin trong cơ thể phù hợp với độ carbohydrate sắp nhập vào. Dạng tác dụng chậm dùng vào buổi tối, để giữ lượng đường trong máu không tăng vọt trong nhiều giờ hôm sau. Liều lượng insulin do đó phải được thay đổi thường lệ. Tăng khi ăn nhiều hơn. Giảm khi hoạt động nhiều hơn (đường là năng lượng dùng trong hoạt động).
Những tác dụng phụ của insulin là:
- Làm bầm tím hay cứng da thịt chỗ chích thường xuyên.
- Làm lượng đường hạ quá thấp làm bệnh nhân mệt hay xỉu.
- Phát ban ở chỗ tiêm hoặc toàn thân (hiếm gặp).
Xem thêm
- Hormone Glucagon
- Hormone Adrenaline
- Hormone Cortisol
Tham khảo
- ^ “Insulin | Meaning of Insulin by Lexico”. Lexico Dictionaries | English.
- ^ “insulin - WordReference.com Dictionary of English”. www.wordreference.com.
- ^ Voet D, Voet JG (2011). Biochemistry (ấn bản thứ 4). New York: Wiley.
- ^ a b Stryer, Lubert (1995). Biochemistry . New York: W.H. Freeman and Company. tr. 773–74. ISBN 0-7167-2009-4. Đã bỏ qua tham số không rõ
|name-list-format=(gợi ý|name-list-style=) (trợ giúp) - ^ Sonksen P, Sonksen J (tháng 7 năm 2000). “Insulin: understanding its action in health and disease”. British Journal of Anaesthesia. 85 (1): 69–79. doi:10.1093/bja/85.1.69. PMID 10927996.
- ^ a b c d Koeslag JH, Saunders PT, Terblanche E (tháng 6 năm 2003). “A reappraisal of the blood glucose homeostat which comprehensively explains the type 2 diabetes mellitus-syndrome X complex”. The Journal of Physiology (xuất bản 2003). 549 (Pt 2): 333–46. doi:10.1113/jphysiol.2002.037895. PMC 2342944. PMID 12717005.
- ^ Stryer, Lubert (1995). Biochemistry . New York: W.H. Freeman and Company. tr. 773–74. ISBN 0-7167-2009-4. Đã bỏ qua tham số không rõ
|name-list-format=(gợi ý|name-list-style=) (trợ giúp) - ^ American Society of Health-System Pharmacists (1 tháng 2 năm 2009). “Insulin Injection”. PubMed Health. National Center for Biotechnology Information, U.S. National Library of Medicine. Truy cập ngày 12 tháng 10 năm 2012.
- ^ a b Koeslag JH, Saunders PT, Terblanche E (tháng 6 năm 2003). “A reappraisal of the blood glucose homeostat which comprehensively explains the type 2 diabetes mellitus-syndrome X complex”. The Journal of Physiology (xuất bản 2003). 549 (Pt 2): 333–46. doi:10.1113/jphysiol.2002.037895. PMC 2342944. PMID 12717005.
- ^ Voet D, Voet JG (2011). Biochemistry (ấn bản thứ 4). New York: Wiley.
- ^ Drug Information Portal NLM – Insulin human USAN http://druginfo.nlm.nih.gov/drugportal/
- ^ “First Successful Laboratory Production of Human Insulin Announced”. News Release. Genentech. 6 tháng 9 năm 1978. Truy cập ngày 26 tháng 9 năm 2016.
- ^ Tof I (1994). “Recombinant DNA technology in the synthesis of human insulin”. Little Tree Publishing. Truy cập ngày 3 tháng 11 năm 2009.
- ^ Aggarwal SR (tháng 12 năm 2012). “What's fueling the biotech engine-2011 to 2012”. Nature Biotechnology. 30 (12): 1191–7. doi:10.1038/nbt.2437. PMID 23222785.
- ^ Weiss M, Steiner DF, Philipson LH (2000). “Insulin Biosynthesis, Secretion, Structure, and Structure-Activity Relationships”. Trong Feingold KR, Anawalt B, Boyce A, Chrousos G, Dungan K, Grossman A, và đồng nghiệp (biên tập). Endotext. MDText.com, Inc. PMID 25905258. Truy cập ngày 18 tháng 2 năm 2020.
- ^ Stretton AO (tháng 10 năm 2002). “The first sequence. Fred Sanger and insulin”. Genetics. 162 (2): 527–32. PMC 1462286. PMID 12399368.
- ^ Editor (15 tháng 1 năm 2019). “The discovery and development of insulin as a medical treatment can be traced back to the 19th century”. Diabetes (bằng tiếng Anh). Truy cập ngày 17 tháng 2 năm 2020.Quản lý CS1: văn bản dư: danh sách tác giả (liên kết)
- ^ “19th WHO Model List of Essential Medicines (April 2015)” (PDF). WHO. tháng 4 năm 2015. Truy cập ngày 10 tháng 5 năm 2015.
- ^ a b de Souza AM, López JA (2004). “Insulin or insulin-like studies on unicellular organisms: a review”. Braz. Arch. Biol. Technol. 47 (6): 973–81. doi:10.1590/S1516-89132004000600017.
- ^ LeRoith D, Shiloach J, Heffron R, Rubinovitz C, Tanenbaum R, Roth J (tháng 8 năm 1985). “Insulin-related material in microbes: similarities and differences from mammalian insulins”. Canadian Journal of Biochemistry and Cell Biology. 63 (8): 839–49. doi:10.1139/o85-106. PMID 3933801.
- ^ Wright JR, Yang H, Hyrtsenko O, Xu BY, Yu W, Pohajdak B (2014). “A review of piscine islet xenotransplantation using wild-type tilapia donors and the production of transgenic tilapia expressing a "humanized" tilapia insulin”. Xenotransplantation. 21 (6): 485–95. doi:10.1111/xen.12115. PMC 4283710. PMID 25040337.
- ^ “Deadly sea snail uses weaponised insulin to make its prey sluggish”. 19 tháng 1 năm 2015.
- ^ Safavi-Hemami H, Gajewiak J, Karanth S, Robinson SD, Ueberheide B, Douglass AD, Schlegel A, Imperial JS, Watkins M, Bandyopadhyay PK, Yandell M, Li Q, Purcell AW, Norton RS, Ellgaard L, Olivera BM (tháng 2 năm 2015). “Specialized insulin is used for chemical warfare by fish-hunting cone snails”. Proceedings of the National Academy of Sciences of the United States of America. 112 (6): 1743–48. Bibcode:2015PNAS..112.1743S. doi:10.1073/pnas.1423857112. PMC 4330763. PMID 25605914.
- ^ “Entrez Gene: INS insulin”.
- ^ Bell GI, Pictet RL, Rutter WJ, Cordell B, Tischer E, Goodman HM (tháng 3 năm 1980). “Sequence of the human insulin gene”. Nature. 284 (5751): 26–32. Bibcode:1980Natur.284...26B. doi:10.1038/284026a0. PMID 6243748.
- ^ “Entrez Gene: INS insulin”.
- ^ Bernardo AS, Hay CW, Docherty K (tháng 11 năm 2008). “Pancreatic transcription factors and their role in the birth, life and survival of the pancreatic beta cell” (PDF). review. Molecular and Cellular Endocrinology. 294 (1–2): 1–9. doi:10.1016/j.mce.2008.07.006. PMID 18687378.
- ^ Rutter GA, Pullen TJ, Hodson DJ, Martinez-Sanchez A (tháng 3 năm 2015). “Pancreatic β-cell identity, glucose sensing and the control of insulin secretion”. review. The Biochemical Journal. 466 (2): 203–18. doi:10.1042/BJ20141384. PMID 25697093.
- ^ Rutter GA, Tavaré JM, Palmer DG (tháng 6 năm 2000). “Regulation of Mammalian Gene Expression by Glucose”. review. News in Physiological Sciences. 15 (3): 149–54. doi:10.1152/physiologyonline.2000.15.3.149. PMID 11390898.
- ^ Poitout V, Hagman D, Stein R, Artner I, Robertson RP, Harmon JS (tháng 4 năm 2006). “Regulation of the insulin gene by glucose and d acids”. review. The Journal of Nutrition. 136 (4): 873–76. doi:10.1093/jn/136.4.873. PMC 1853259. PMID 16549443.
- ^ Vaulont S, Vasseur-Cognet M, Kahn A (tháng 10 năm 2000). “Glucose regulation of gene transcription”. review. The Journal of Biological Chemistry. 275 (41): 31555–58. doi:10.1074/jbc.R000016200. PMID 10934218.
- ^ Christensen DP, Dahllöf M, Lundh M, Rasmussen DN, Nielsen MD, Billestrup N, Grunnet LG, Mandrup-Poulsen T (2011). “Histone deacetylase (HDAC) inhibition as a novel treatment for diabetes mellitus”. Molecular Medicine. 17 (5–6): 378–90. doi:10.2119/molmed.2011.00021. PMC 3105132. PMID 21274504.
- ^ Wang W, Shi Q, Guo T, Yang Z, Jia Z, Chen P, Zhou C (tháng 6 năm 2016). “PDX1 and ISL1 differentially coordinate with epigenetic modifications to regulate insulin gene expression in varied glucose concentrations”. Molecular and Cellular Endocrinology. 428: 38–48. doi:10.1016/j.mce.2016.03.019. PMID 26994512.
- ^ Wang X, Wei X, Pang Q, Yi F (tháng 8 năm 2012). “Histone deacetylases and their inhibitors: molecular mechanisms and therapeutic implications in diabetes mellitus”. Acta Pharmaceutica Sinica B. 2 (4): 387–95. doi:10.1016/j.apsb.2012.06.005.
- ^ a b Andrali SS, Sampley ML, Vanderford NL, Ozcan S (tháng 10 năm 2008). “Glucose regulation of insulin gene expression in pancreatic beta-cells”. review. The Biochemical Journal. 415 (1): 1–10. doi:10.1042/BJ20081029. PMID 18778246.
- ^ Kaneto H, Matsuoka TA, Kawashima S, Yamamoto K, Kato K, Miyatsuka T, Katakami N, Matsuhisa M (tháng 7 năm 2009). “Role of MafA in pancreatic beta-cells”. Advanced Drug Delivery Reviews. 61 (7–8): 489–96. doi:10.1016/j.addr.2008.12.015. PMID 19393272.
- ^ Aramata S, Han SI, Kataoka K (tháng 12 năm 2007). “Roles and regulation of transcription factor MafA in islet beta-cells”. Endocrine Journal. 54 (5): 659–66. doi:10.1507/endocrj.KR-101. PMID 17785922.
- ^ Kaneto H, Matsuoka TA (tháng 10 năm 2012). “Involvement of oxidative stress in suppression of insulin biosynthesis under diabetic conditions”. International Journal of Molecular Sciences. 13 (10): 13680–90. doi:10.3390/ijms131013680. PMC 3497347. PMID 23202973.
- ^ a b Weiss M, Steiner DF, Philipson LH (2000). “Insulin Biosynthesis, Secretion, Structure, and Structure-Activity Relationships”. Trong Feingold KR, Anawalt B, Boyce A, Chrousos G, Dungan K, Grossman A, và đồng nghiệp (biên tập). Endotext. MDText.com, Inc. PMID 25905258. Truy cập ngày 18 tháng 2 năm 2020.
- ^ “Insulin human”. PubChem. Truy cập ngày 26 tháng 2 năm 2019.
- ^ Fu Z, Gilbert ER, Liu D (tháng 1 năm 2013). “Regulation of insulin synthesis and secretion and pancreatic Beta-cell dysfunction in diabetes”. Current Diabetes Reviews. 9 (1): 25–53. doi:10.2174/157339913804143225. PMC 3934755. PMID 22974359.
- ^ Fu Z, Gilbert ER, Liu D (tháng 1 năm 2013). “Regulation of insulin synthesis and secretion and pancreatic Beta-cell dysfunction in diabetes”. Current Diabetes Reviews. 9 (1): 25–53. doi:10.2174/157339913804143225. PMC 3934755. PMID 22974359.
- ^ Weiss M, Steiner DF, Philipson LH (2000). “Insulin Biosynthesis, Secretion, Structure, and Structure-Activity Relationships”. Trong Feingold KR, Anawalt B, Boyce A, Chrousos G, Dungan K, Grossman A, và đồng nghiệp (biên tập). Endotext. MDText.com, Inc. PMID 25905258. Truy cập ngày 18 tháng 2 năm 2020.
- ^ Fu Z, Gilbert ER, Liu D (tháng 1 năm 2013). “Regulation of insulin synthesis and secretion and pancreatic Beta-cell dysfunction in diabetes”. Current Diabetes Reviews. 9 (1): 25–53. doi:10.2174/157339913804143225. PMC 3934755. PMID 22974359.
- ^ Dunn MF (tháng 8 năm 2005). “Zinc-ligand interactions modulate assembly and stability of the insulin hexamer -- a review”. Biometals. 18 (4): 295–303. doi:10.1007/s10534-005-3685-y. PMID 16158220.
- ^ Ivanova MI, Sievers SA, Sawaya MR, Wall JS, Eisenberg D (tháng 11 năm 2009). “Molecular basis for insulin fibril assembly”. Proceedings of the National Academy of Sciences of the United States of America. 106 (45): 18990–5. Bibcode:2009PNAS..10618990I. doi:10.1073/pnas.0910080106. PMC 2776439. PMID 19864624.
- ^ Rhoades, Rodney A.; Bell, David R. (2009). Medical physiology : principles for clinical medicine (ấn bản thứ 3). Philadelphia: Lippincott Williams & Wilkins. tr. 644–47. ISBN 978-0-7817-6852-8. Đã bỏ qua tham số không rõ
|name-list-format=(gợi ý|name-list-style=) (trợ giúp) - ^ Kahn CR, Weir GC (2005). Joslin's Diabetes Mellitus (ấn bản thứ 14). Lippincott Williams & Wilkins. ISBN 978-8493531836.
- ^ Steiner DF, Oyer PE (tháng 2 năm 1967). “The biosynthesis of insulin and a probable precursor of insulin by a human islet cell adenoma”. Proceedings of the National Academy of Sciences of the United States of America. 57 (2): 473–80. Bibcode:1967PNAS...57..473S. doi:10.1073/pnas.57.2.473. PMC 335530. PMID 16591494.
- ^ Creighton, Thomas E (1993). Proteins: Structures and Molecular Properties (ấn bản thứ 2). W H Freeman and Company. tr. 81–83. ISBN 978-0-7167-2317-2. Đã bỏ qua tham số không rõ
|name-list-format=(gợi ý|name-list-style=) (trợ giúp)
Liên kết ngoài
- Insulin, glucagon và bệnh tiểu đường trên Thư viện Khoa học VLOS
