Ion đa nguyên tử

3). Những vùng trong mờ màu đỏ, nằm xung quanh những nguyên tử oxy màu đỏ, là những vùng có thế tĩnh điện âm nhất.
Một ion đa nguyên tử, còn gọi là ion phân tử, là một nhóm hai nguyên tử hoặc phức chất (không nhất thiết khác nhau) trở lên liên kết cộng hóa trị với nhau, có thể được coi là một đơn vị duy nhất và có điện tích khác không, tức nó không trung hòa về điện.
Trong quá khứ, một số người gọi một ion đa nguyên tử là gốc tự do (tiếng Anh: radical). Trong thuật ngữ hiện đại, từ gốc dùng để chỉ các gốc tự do khác nhau, là những nguyên tử, phân tử hoặc ion có electron độc thân mà không nhất thiết mang điện.
Một ví dụ đơn giản của ion đa nguyên tử là ion hydroxide, chứa một nguyên tử oxi và một nguyên tử hydro, với điện tích là −1, với công thức hóa học là OH−
. Một ví dụ về ion dương là ion amoni gồm một nguyên tử nitơ và bốn nguyên tử hydro, với điện tích là +1 và công thức hóa học là NH+
4.
Ion đa nguyên tử thường được xét trong hóa học axit–base và sự hình thành muối.
Thông thường, một ion đa nguyên tử có thể được coi là một axit hay base liên hợp của một phân tử. Ví dụ, base liên hợp của axit sulfuric (H2SO4) là anion đa nguyên tử hydro sunfat (HSO−
4). Loại bỏ đi một ion hydro cho ta anion sunfat (SO2−
4).
Tên gọi các ion đa nguyên tử[sửa | sửa mã nguồn]
Có hai "quy tắc" có thể dùng để nhớ tên gọi của các anion đa nguyên tử. Đầu tiên, khi tiền tố bi- được đặt trước tên, một nguyên tử hydro được thêm vào công thức ion và điện tích của nó tăng lên 1. Một cách khác là sử dụng từ hydro trong tên gọi: anion HCO−
3, tạo từ H+
và CO2−
3, có thể được gọi là bicacbonat hoặc hydrocacbonat.
Hầu hết các anion đa nguyên tử thường gặp đều là các anion oxo, base liên hợp của axit oxo (axit tạo từ oxit của các nguyên tố phi kim). Ví dụ, anion sunfat, SO2−
4, xuất phát từ H
2SO
4, có thể được coi là SO
3 + H
2O.
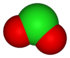
Quy tắc thứ hai là xét số nguyên tử oxi trong ion. Xét họ anion oxo của clo:
| Trạng thái oxy hóa | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| Tên anion | chloride | hypoclorit | clorit | clorat | perchlorat |
| Công thức | Cl− |
ClO− |
ClO− 2 |
ClO− 3 |
ClO− 4 |
| Cấu tạo | 
|

|
|

|

|
Đầu tiên, coi ion đuôi -ate là tên của base, thêm tiền tố pe- là thêm một oxi. Đổi hậu tố -at thành -it làm giảm một oxi, và giữ hậu tố -it và thêm tiền tố hypo- giảm thêm một oxi. Trong tất cả trường hợp, điện tích của ion không đổi. Cách đặt tên này đúng cho nhiều họ anion oxo dựa trên một ion gốc cho họ đó. Hậu tố -it có ít hơn một oxi so với đuôi -at, nhưng những anion -at khác nhau có thể có số nguyên tử oxi khác nhau.
Hai quy tắc trên không đúng cho tất cả các anion đa nguyên tử, nhưng chúng đúng cho hầu hết các anion thường gặp. Bảng sau đưa ra ví dụ về một số họ anion phổ biến này.
| bromide | hypobromit | bromit | bromat | pebromat |
| Br− |
BrO− |
BrO− 2 |
BrO− 3 |
BrO− 4 |
| iodide | hypoiotit | iotit | iotat | peiotat |
| I− |
IO− |
IO− 2 |
IO− 3 |
IO− 4 or IO5− 6 |
| sulfide | hyposunfit | sunfit | sunfat | pesunfat |
| S2− |
S 2O2− 2 |
SO2− 3 |
SO2− 4 |
SO2− 5 |
| selenide | hyposelenide | selenide | selenat | |
| Se2− |
Se 2O2− 2 |
SeO2− 3 |
SeO2− 4 |
|
| telurua | hypotelurit | telurit | telurat | |
| Te2− |
TeO2− 2 |
TeO2− 3 |
TeO2− 4 |
|
| nitride | hyponitrit | nitrit | nitrat | |
| N3− |
N 2O2− 2 |
NO− 2 |
NO− 3 |
|
| phosphua | hypophosphit | phosphit | phosphat | pephosphat |
| P3− |
H 2PO− 2 |
PO3− 3 |
PO3− 4 |
PO3− 5 |
| arsenua | hypoarsenit | arsenit | arsenat | |
| As3− |
AsO3− 2 |
AsO3− 3 |
AsO3− 4 |
Các ion đa nguyên tử khác[sửa | sửa mã nguồn]
Sau đây là một số ion đa nguyên tử khác thường gặp. Chỉ có một số đại diện được liệt kê, do số loại ion đa nguyên tử trong thực tế là rất lớn.
| Tetrahydroxyborat | B(OH)− 4 |
| Axetylua | C2− 2 |
| Ethoxide hoặc etanolat | C 2H 5O− |
| Axetat hoặc etanoat | CH 3COO− hoặc C 2H 3O− 2 |
| Benzoat | C 6H 5COO− hoặc C 7H 5O− 2 |
| Citrat | C 6H 5O3− 7 |
| Cacbonat | CO2− 3 |
| Oxalat | C 2O2− 4 |
| Xyanua | CN− |
| Cromat | CrO2− 4 |
| Dicromat | Cr 2O2− 7 |
| Bicacbonat hoặc hydrogencacbonat | HCO− 3 |
| Hydro phosphat | HPO2− 4 |
| Dihydro phosphat | H 2PO− 4 |
| Hydro sunfat hoặc bisunfat | HSO− 4 |
| Manganat | MnO2− 4 |
| Pemanganat | MnO− 4 |
| Amidua | NH− 2 |
| Peroxide | O2− 2 |
| Hydroxide | OH− |
| Bisulfide | SH− |
| Thioxyanat | SCN− |
| Silicat | SiO2− 4 |
| Thiosunfat | S 2O2− 3 |
| Ion oni | Ion cacbeni | Khác | |||
|---|---|---|---|---|---|
| Guanidini | C(NH 2)+ 3 |
Tropyli | C 7H+ 7 |
Thủy ngân(I) | Hg2+ 2 |
| Amoni | NH+ 4 |
Triphenylcacbeni | (C 6H 5) 3C+ |
||
| Phosphoni | PH+ 4 |
Cyclopropeni | C 3H+ 3 |
||
| Hydroni | H 3O+ |
||||
| Floroni | H 2F+ |
||||
| Pyryli | C 5H 5O+ |
||||
