Calci hypochlorit
| Calci hypochlorit | |
|---|---|
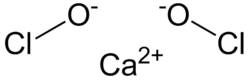 | |
 | |
 | |
| Tên khác | Hypochlorous acid calcium salt Bleaching powder, Calcium oxychloride |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số EINECS | |
| Số RTECS | NH3485000 |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| Thuộc tính | |
| Công thức phân tử | Ca(ClO)2 |
| Khối lượng mol | 142,98 g/mol |
| Bề ngoài | white/gray powder |
| Khối lượng riêng | 2,35 g/cm³ (20 °C) |
| Điểm nóng chảy | 100 °C (373 K; 212 °F) |
| Điểm sôi | 175 °C (448 K; 347 °F) phân hủy |
| Độ hòa tan trong nước | 21 g/100 mL, reacts |
| Độ hòa tan | reacts in alcohol |
| Các nguy hiểm | |
| Phân loại của EU | |
| NFPA 704 |
|
| Chỉ dẫn R | R8, R22, R31, R34, R50 |
| Chỉ dẫn S | (S1/2), S26, S36/37/39, S45, S61 |
| Điểm bắt lửa | Không bắt lửa |
| LD50 | 850 mg/kg (đường miệng, chuột) |
| Các hợp chất liên quan | |
| Anion khác | Calci chloride |
| Cation khác | Natri hypochlorite |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Calci hypochlorit hay chloride vôi là một hợp chất vô cơ có công thức Ca(ClO)2, khối lượng phân tử là 142,976 g/mol, nhiệt độ sôi là 100 °C. Hợp chất này tương đối ổn định và có chlor nhiều hơn so với natri hypochlorit (chất tẩy lỏng). Calci hypochlorit là một chất rắn màu trắng, mặc dù các loại được bán trên thị trường có màu vàng. Nó có mùi của chlor, do sự phân hủy chậm của nó trong không khí ẩm. Nó không hòa tan nhiều trong nước, có tính ổn định, chất oxy hóa mạnh - tiếp xúc với vật liệu dễ cháy có thể dẫn tới hỏa hoạn, nhưng nó không cháy, không tương thích với nước, chất khử, chất dễ cháy, phenol. Calci hypochlorit có hai dạng: khô và ngậm nước.
Ứng dụng
[sửa | sửa mã nguồn]Làm vệ sinh
[sửa | sửa mã nguồn]Calci hypochlorit thường được sử dụng để khử trùng bể bơi công cộng và khử trùng nước uống. Calci hypochlorit cũng được sử dụng trong nhà bếp để khử trùng bề mặt và các thiết bị[1]. Các tác dụng phổ biến khác của nó bao gồm là chất tẩy rửa phòng tắm, xịt khử trùng, tảo, thuốc diệt cỏ, chất tẩy rửa.
Hóa học hữu cơ
[sửa | sửa mã nguồn]Calci hypochlorit là một chất oxy hóa nói chung và do đó tìm thấy một số sử dụng trong hóa học hữu cơ[2]. Ví dụ, hợp chất này được sử dụng để tách glycol, các axit α-hydroxy carboxylic và các axit keto để tạo ra aldehyde phân đoạn hoặc các axit cacboxylic. Calci hypochlorit cũng có thể được sử dụng trong phản ứng dạng halogenoform để sản xuất chloroform[3].
Sản xuất
[sửa | sửa mã nguồn]Calci hypochlorit được sản xuất trong công nghiệp bằng cách xử lý vôi (Ca(OH)2) với khí chlor. Phản ứng có thể được tiến hành theo từng giai đoạn để tạo ra các chế phẩm khác nhau, mỗi loại đều có nồng độ calci hypochlorit khác nhau, cùng với vôi không chuyển đổi và calci chloride[4]:
2Cl2 + 2Ca(OH)2 → Ca(OCl)2 + CaCl2 + 2H2O
Tẩy trắng bột được làm bằng vôi ướt nhẹ. Nó không phải là một hỗn hợp đơn giản gồm calci hypochlorit, calci chlorid và calci hydroxid. Thay vào đó, nó là một hỗn hợp bao gồm chủ yếu là calci hypochlorit Ca(OCl)2, dibasic calci hypochlorite, Ca3(OCl)2(OH)4, và dibasic calci chloride, Ca3Cl2(OH)4[5].
Tính chất
[sửa | sửa mã nguồn]Calci hypochlorit phản ứng với carbon dioxide để tạo thành calci cacbonat và giải phóng dichlor monoxide:
Ca (ClO)2 + CO2 → CaCO3 + Cl2O ↑
Một dung dịch calci hypochlorit là có tính kiềm. Tính kiềm này là do quá trình thủy phân thực hiện bởi ion hypochlorit, do axit hypochlorous yếu, nhưng calci hydroxide là một base mạnh. Kết quả là, ion hypochlorit là một base mạnh kết hợp với nhau, và ion calci là một axit liên kết yếu:
ClO- + H2O → HClO + OH-
Tương tự, calci hypochlorit phản ứng với acid hypochlorit để tạo thành calci chloride, nước và chlor:
Ca (OCl)2 + 4HCl → CaCl2 + 2H2O + 2Cl2
Tác hại
[sửa | sửa mã nguồn]Độc hại, gây kích ứng da. Hít phải, nuốt phải hoặc tiếp xúc (da, mắt) với hơi hoặc chất có thể gây thương tích nghiêm trọng, bỏng hoặc chết. Lửa có thể gây ra các chất khí gây kích ứng, ăn mòn hoặc độc.
Calci hypochlorit sẽ đẩy nhanh quá trình đốt cháy khi bị hỏa hoạn. Một số có thể phân hủy nhanh chóng khi bị nung nóng hoặc dính vào lửa. Có thể gây nổ từ nhiệt hoặc nhiễm bẩn. Một số sẽ phản ứng nổ với hydrocarbon (nhiên liệu). Có thể đốt cháy các chất dễ cháy (gỗ, giấy, dầu, quần áo, vv). Thúng chứa có thể phát nổ khi đun nóng. Uống vào có thể gây nguy hiểm đến tính mạng.
Tham khảo
[sửa | sửa mã nguồn]- ^ Chemical Products Synopsis: Calcium Hypochlorite (Bản báo cáo kỹ thuật). Asbuiy Park, NJ: Mannsvile Chemical Products. 1987.
- ^ Nwaukwa, Stephen; Keehn, Philip (1982). “The oxidation of aldehydes to acids with calcium hypochlorite [Ca(OCl)2]”. Tetrahedron Letters. 23 (31): 3131–3134. doi:10.1016/S0040-4039(00)88577-9.
- ^ Cohen, Julius (1900). Practical Organic Chemistry for Advanced Students. Newyork: Macmillan & Co. tr. 63.
- ^ Vogt, H.; Balej, J; Bennett, J. E.; Wintzer, P.; Sheikh, S. A.; Gallone, P.; Vasudevan, S.; Pelin, K. (2010). “Chlorine Oxides and Chlorine Oxygen Acids”. Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a06_483.pub2.
- ^ W.L Smith, Inorganic bleaches, Production of Hypochlorite in Handbook of Detergents,Part F, (2009) Ed. U Zoller and Paul Sosis, CRCPress, ISBN 978-0-8247-0349-3

