Hafni(IV) sulfide
| Hafni(IV) sulfide | |
|---|---|
 Mẫu hợp chất hafni(IV) sulfide | |
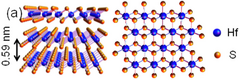 | |
| Danh pháp IUPAC | Hafnium disulfide |
| Tên khác | Hafni disulfide |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| Thuộc tính | |
| Công thức phân tử | HfS2 |
| Khối lượng mol | 242,622 g/mol |
| Bề ngoài | chất rắn màu nâu |
| Mùi | giống lưu huỳnh |
| Khối lượng riêng | 6,03 g/cm³[1] |
| Điểm nóng chảy | |
| Điểm sôi | |
| Độ hòa tan trong nước | không tan |
| Độ hòa tan | tạo phức với amonia |
| BandGap | ~ 1,8 eV (gián tiếp)[2] |
| Cấu trúc | |
| Cấu trúc tinh thể | hP3, P3m1, No. 164[3] |
| Hằng số mạng | a = 0,363 nm, c = 0,584 nm |
| Các nguy hiểm | |
| Nguy hiểm chính | có thể gây độc |
| Các hợp chất liên quan | |
| Anion khác | Hafni(IV) oxide Hafni(IV) selenide |
| Cation khác | Titani(IV) sulfide Zirconi(IV) sulfide |
| Hợp chất liên quan | Wolfram(IV) sulfide Molybden(IV) sulfide |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Hafni(IV) sulfide là một hợp chất vô cơ của hafni và lưu huỳnh, được phân loại là một dichalcogenide phân lớp với công thức hóa học HfS2. Một vài lớp mỏng của vật liệu này có thể được tách ra bằng cách sử dụng kỹ thuật Scotch Tape tiêu chuẩn (xem graphene) và được sử dụng để chế tạo transistor hiệu ứng trường.[4] Quá trình tổng hợp hiệu suất cao của HfS2 cũng đã được chứng minh bằng cách sử dụng quá trình tróc màng ở pha lỏng, tạo ra các mảnh HfS2 ít lớp nhưng ổn định.[5]
Điều chế[sửa | sửa mã nguồn]
Bột hafnium(IV) sulfide có thể được sản xuất bằng phản ứng giữa hydro sulfide và hafni(IV) oxide ở 500–1300 °C.[6]
Hợp chất khác[sửa | sửa mã nguồn]
Phức hợp HfS2·NH3 được tạo thành khi cho HfS2 tác dụng với NH3 ở thể khí hoặc lỏng. HfS2 phản ứng với NH3 tạo thành chất lỏng màu xanh lục đậu, khi tách ra ở dạng bột/tinh thể có màu đỏ cam đậm với vệt màu kim loại đồng.[7]
Tham khảo[sửa | sửa mã nguồn]
- ^ Haynes, William M. biên tập (2011). CRC Handbook of Chemistry and Physics (ấn bản 92). Boca Raton, FL: CRC Press. tr. 4.66. ISBN 1439855110.
- ^ Terashima, K.; Imai, I. (1987). “Indirect absorption edge of ZrS2 and HfS2”. Solid State Communications. 63 (4): 315. Bibcode:1987SSCom..63..315T. doi:10.1016/0038-1098(87)90916-1.
- ^ Hodul, David T.; Stacy, Angelica M. (1984). “Anomalies in the properties of Hf(S2−xTex)1-y and Hf(Se2−xTex)1-y near the metal-insulator transition”. Journal of Solid State Chemistry. 54 (3): 438. Bibcode:1984JSSCh..54..438H. doi:10.1016/0022-4596(84)90176-2.
- ^ Kanazawa, Toru; Amemiya, Tomohiro; Ishikawa, Atsushi; Upadhyaya, Vikrant; Tsuruta, Kenji; Tanaka, Takuo; Miyamoto, Yasuyuki (2016). “Few-layer HfS2 transistors”. Scientific Reports. 6: 22277. Bibcode:2016NatSR...622277K. doi:10.1038/srep22277. PMC 4772098. PMID 26926098.
- ^ Kaur, Harneet (2017). “High Yield Synthesis and Chemical Exfoliation of Two-Dimensional Layered Hafnium Disulphide”. Nano Research. arXiv:1611.00895. doi:10.1007/s12274-017-1636-x.
- ^ Kaminskii, B. T.; Prokof'eva, G. N.; Plygunov, A. S.; Galitskii, P. A. (1 tháng 7 năm 1973). “Manufacture of zirconium and hafnium sulfide powders”. Soviet Powder Metallurgy and Metal Ceramics. 12 (7): 521–524. doi:10.1007/BF00796747.
- ^ R. R. Chianelli, J. C. Scanlon, M. S. Whittingham, F. R. Gamble (ngày 1 tháng 5 năm 1975). Structural studies of the intercalation complexes titanium sulfide-ammonia (TiS2·NH3) and tantalum sulfide-ammonia (TaS2·NH3). Inorg. Chem. 1975, 14 (7): 1691–1696. doi:10.1021/ic50149a052.
