Bạc sulfat
(Đổi hướng từ Bạc sunfat)
| Bạc sulfat | |
|---|---|
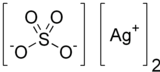 Công thức cấu tạo của bạc sulfat | |
 Mẫu bạc(I) sulfat | |
| Danh pháp IUPAC | Silver sulfate |
| Tên khác | Disilver sulfate |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| UNII | |
| Thuộc tính | |
| Công thức phân tử | Ag2SO4 |
| Khối lượng mol | 311,7996 g/mol |
| Bề ngoài | Tinh thể không màu |
| Mùi | Không mùi |
| Khối lượng riêng | 5,45 g/cm³ (25 ℃) 4,84 g/cm³ (660 ℃)[1] |
| Điểm nóng chảy | 652,2–660 °C (925,4–933,1 K; 1.206,0–1.220,0 °F)[1][2] |
| Điểm sôi | 1.085 °C (1.358 K; 1.985 °F)[3][2] |
| Độ hòa tan trong nước | 0,57 g/100 mL (0 ℃) 0,69 g/100 mL (10 ℃) 0,83 g/100 mL (25 ℃) 0,96 g/100 mL (40 ℃) 1,33 g/100 mL (100 ℃)[4], xem thêm bảng độ tan |
| Tích số tan, Ksp | 1,2·10-5[1] |
| Độ hòa tan | Tan trong dung dịch axit, cồn, aceton, ete, acetat, amit[4] Không tan trong EtOH và HF[3] tạo phức với amonia |
| Độ hòa tan trong axit sulfuric | 8,4498 g/L (0,1 molH2SO4/LH2O)[4] 25,44 g/100 g (13 ℃) 31,56 g/100 g (24,5 ℃) 127,01 g/100 g (96 ℃)[3] |
| Độ hòa tan trong etanol | 7,109 g/L (0,5 nEtOH/H2O)[4] |
| Độ hòa tan trong axit acetic | 7,857 g/L (0,5 nAcOH/H2O)[4] |
| MagSus | -9,29·10-5 cm³/mol[1] |
| Chiết suất (nD) | nα = 1,756 nβ = 1,775 nγ = 1,782[5] |
| Cấu trúc | |
| Cấu trúc tinh thể | Trực thoi, oF56[5] |
| Nhóm không gian | Fddd, No. 70[5] |
| Hằng số mạng | a = 10,2699(5) Å, b = 12,7069(7) Å, c = 5,8181(3) Å[5] |
| Nhiệt hóa học | |
| Enthalpy hình thành ΔfH | -715,9 kJ/mol[1] |
| Entropy mol tiêu chuẩn S | 200,4 kJ/mol[1] |
| Nhiệt dung | 131,4 J/mol·K[1] |
| Các nguy hiểm | |
| NFPA 704 |
|
| Ký hiệu GHS |   [6] [6] |
| Báo hiệu GHS | Nguy hiểm |
| Chỉ dẫn nguy hiểm GHS | H318, H410[6] |
| Chỉ dẫn phòng ngừa GHS | P273, P280, P305+P351+P338, P501[6] |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Bạc(I) sulfat (công thức hóa học: Ag2SO4) là một hợp chất ion bạc được sử dụng trong mạ bạc, là chất thay thế cho bạc(I) nitrat. Muối sulfat này khá bền ở điều kiện sử dụng và lưu trữ bình thường tuy chúng bị tối màu đi khi tiếp xúc với ánh sáng và không khí. Bạc(I) sulfat ít tan trong nước.
Điều chế[sửa | sửa mã nguồn]
Bạc(I) sulfat được điều chế bằng cách cho acid sulfuric vào dung dịch bạc(I) nitrat:
Từ AgHSO4 thu được:
- 2AgHSO4 (dd) ⇌ Ag2SO4 (r) + H2SO4 (dd)
Hợp chất khác[sửa | sửa mã nguồn]
Ag2SO4 còn tạo một số hợp chất với NH3, như Ag2SO4·4NH3 là tinh thể không màu.[7]
Xem thêm[sửa | sửa mã nguồn]
Tham khảo[sửa | sửa mã nguồn]
- ^ a b c d e f g Lide, David R. biên tập (2009). CRC Handbook of Chemistry and Physics . Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ a b “MSDS of Silver sulfate”. https://www.fishersci.ca. Fisher Scientific, Inc. Truy cập ngày 19 tháng 7 năm 2014. Liên kết ngoài trong
|website=(trợ giúp) - ^ a b c Anatolievich, Kiper Ruslan. “silver sulfate”. http://chemister.ru. Truy cập ngày 19 tháng 7 năm 2014. Liên kết ngoài trong
|website=(trợ giúp) - ^ a b c d e Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (ấn bản 2). New York: D. Van Nostrand Company. tr. 622–623.
- ^ a b c d Morris, Marlene C.; McMurdie, Howard F.; Evans, Eloise H.; Paretzkin, Boris; Groot, Johan H. de; Hubbard, Camden R.; Carmel, Simon J. (tháng 6 năm 1976). “13”. Standard X-ray Diffraction Powder Patterns. 25. Washington: Institute for Materials Research National Bureau of Standards.
- ^ a b c Bản dữ liệu Bạc sulfat của Sigma-Aldrich, truy cập lúc {{{Datum}}} (PDF).
- ^ Zeitschrift für Naturforschung: Physik, physikalische Chemie, Kosmophysik. Teil A, Tập 34,Phần 1,Trang 1-786 (Verlag der Zeitschrift für Naturforschung, 1979), trang 333. Truy cập 15 tháng 4 năm 2021.

