Phản ứng Belousov–Zhabotinsky

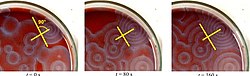
Phản ứng Belousov–Zhabotinsky, hay phản ứng BZ, là một loại phản ứng được dùng như một ví dụ cổ điển cho nhiệt động lực học không cân bằng, đưa đến kết quả thiết lập nên một máy dao động hóa học phi tuyến tính. Thành phần chính thường được dùng trong những máy dao động này là hỗn hợp gồm brom và một axít. Những phản ứng này rất quan trọng trong hóa học lý thuyết vì chúng cho thấy rằng các phản ứng hóa học không bị trạng thái cân bằng nhiệt động lực học tác động. Những phản ứng này khác xa trạng thái cân bằng và duy trì như vậy trong một khoảng thời gian đáng kể và tiến triển hỗn độn. Theo nghĩa này, chúng đưa ra một mô hình hóa học đáng chú ý của các hiện tượng sinh học không cân bằng; như vậy, những mô hình toán học và các mô phỏng của phản ứng BZ chính là cốt lõi của lý thuyết.[1]
Cơ chế hóa học[sửa | sửa mã nguồn]
Cơ chế của phản ứng này rất phức tạp và có thể có khoảng 18 bước khác nhau và là chủ đề của một số tài liệu nghiên cứu.[2][3]
Theo cách tương tự như phản ứng Briggs–Rauscher, hai quá trình trọng yếu xảy ra (cả hai đều là tự động xúc tác); quá trình A tạo ra phân tử brom có màu đỏ, và quá trình B hấp thụ brom để tạo ra ion bromide.[4]
Một trong những biến thể phổ biến nhất của phản ứng này là dùng axit malonic (CH2(CO2H)2) đóng vai trò là axít và kali bromat (KBrO3) là nguồn cung cấp brom. Phương trình tổng quát:[4]
- 3CH2(CO2H)2 + 4BrO−
3 → 4Br− + 9CO2 + 6H2O
Biến thể[sửa | sửa mã nguồn]
Có nhiều biến thể của phản ứng tồn tại. Hóa chất chính duy nhất là chất oxy hóa bromat. Ion xúc tác thường là xeri, nhưng nó cũng có thể sử dụng mangan, hoặc những phức hệ của sắt, rutheni, coban, đồng, bạc, niken, crom và osmi. Nhiều chất khử khác có thể được sử dụng. (Zhabotinsky, 1964b; Field and Burger, 1985)[5]
Chú thích[sửa | sửa mã nguồn]
- ^ Zhang, Dongmei; Györgyi, László; Peltier, William R. (1993). “Deterministic chaos in the Belousov–Zhabotinsky reaction: Experiments and simulations”. Chaos: an Interdisciplinary Journal of Nonlinear Science. 3 (4): 723–745. Bibcode:1993Chaos...3..723Z. doi:10.1063/1.165933. PMID 12780076.
- ^ Field, Richard J.; Foersterling, Horst Dieter (1986). “On the oxybromine chemistry rate constants with cerium ions in the Field-Koeroes-Noyes mechanism of the Belousov-Zhabotinskii reaction: The equilibrium HBrO2 + BrO3- + H+.dblharw. 2BrO.ovrhdot.2 + H2O”. The Journal of Physical Chemistry. 90 (21): 5400–7. doi:10.1021/j100412a101.
- ^ Sirimungkala, Atchara; Försterling, Horst-Dieter; Dlask, Vladimir; Field, Richard J. (1999). “Bromination Reactions Important in the Mechanism of the Belousov−Zhabotinsky System”. The Journal of Physical Chemistry A. 103 (8): 1038–43. Bibcode:1999JPCA..103.1038S. doi:10.1021/jp9825213.
- ^ a b Lister, Ted (1995). Classic Chemistry Demonstrations (PDF). Luân Đôn: Education Division, The Royal Society of Chemistry. tr. 3–4. ISBN 978-1-870343-38-1. Bản gốc (PDF) lưu trữ ngày 16 tháng 8 năm 2014.
- ^ http://www.scholarpedia.org/article/Belousov-Zhabotinsky_reaction
Liên kết ngoài[sửa | sửa mã nguồn]
- Interactive Science Experiment Showcasing the BZ Reaction (A-Level)[liên kết hỏng]
- A Survey Article on the Mathematics of the BZ Reaction
- The Scholarpedia article on the Belousov-Zhabotinsky reaction
- The Belousov–Zhabotinski Reaction
- The Belousov–Zhabotinsky Reaction
- The Phenomenology of the Belousov–Zhabotinsky Reaction, with pictures
- BZ reaction and explanation at The Periodic Table of Videos
- The Belousov–Zhabotinski Reaction PDF file
- Paper cargo surfs chemical waves — Oscillating chemical waves induced by BZ reactions can propel small objects, New Scientist, ngày 18 tháng 2 năm 2008
- The home page of Anatol M. Zhabotinsky
- Simulating Belousov-Zhabotinsky Reactions in Pixel Bender A simulation of the Belousov–Zhabotinsky reaction running inside Flash Player
