Khác biệt giữa bản sửa đổi của “Amino acid”
thêm đoạn ls |
|||
| Dòng 1: | Dòng 1: | ||
[[ |
[[tập tin:AminoAcidball.svg|thumbnail|200px|Cấu trúc chung của một phân tử axít amin, với nhóm amin ở bên trái và nhóm axít cacbonxylic ở bên phải. Nhóm R tùy vào từng axít amin cụ thể.]] |
||
[[tập tin:Amino Acids.svg|thumb|upright=2.0|right|alt=Bảng các axít amin|21 α-axít amin cấu thành lên [[protein]] ở [[sinh vật nhân chuẩn]], được nhóm lại theo giá trị [[hằng số phân ly axít|pK<sub>a</sub>]] của nhóm thế (hoặc mạch bên, side-chain) và điện tích tại giá trị [[pH|pH của cơ thể sống bằng 7,4]]]] |
|||
Trong [[hóa học]], một '''amino acid''' hay '''axít amin''' là một [[phân tử]] chứa cả nhóm [[amin]] và [[axit cacboxylic|axít cacboxylic]]. Trong [[hóa sinh]], thuật ngữ này còn để chỉ ''alpha amino acids'': những axít amin mà trong đó nhóm amin và cacbonxylic gắn vào cùng một [[Cacbon|carbon]], nên gọi là [[alpha cacbon|α–carbon]]. |
|||
'''Axít amin''' là những [[hợp chất hữu cơ]] [[sinh học]] quan trọng chứa [[nhóm chức]] [[amin]] (-NH<sub>2</sub>) và [[axít cacboxylic]] (-COOH), cùng với một [[nhóm thế]] (hay còn gọi mạch bên, side-chain) (nhóm R) nhất định ở mỗi axít amin.<ref>{{Cite encyclopedia|title = Amino|date = 2015|encyclopedia = Dictionary.com|url = http://dictionary.reference.com/browse/amino|accessdate = 2015-07-03}}</ref><ref>{{Cite encyclopedia|title = amino acid|date = 2015|encyclopedia = Cambridge Dictionaries Online|publisher = Cambridge University Press|url = https://dictionary.cambridge.org/us/dictionary/british/amino-acid|accessdate = 2015-07-03}}</ref><ref>{{Cite encyclopedia|title = amino|date = 2015|publisher = Farlex|url = http://www.thefreedictionary.com/amino|accessdate = 2015-07-03|encyclopedia = FreeDictionary.com}}</ref> Các nguyên tố chính của axít amin là [[cacbon]], [[hiđrô]], [[ôxy]], và [[nitơ]], và một số nguyên tố khác có mặt trong nhóm thế của từng axít amin. Tồn tại khoảng 500 axít amin đã được biết đến và phân loại theo nhiều cách khác nhau.<ref>{{cite journal |title = New Naturally Occurring Amino Acids|vauthors = Wagner I, Musso H|doi = 10.1002/anie.198308161|journal = Angewandte Chemie International Edition in English|volume = 22|issue = 11|pages = 816–28|date = November 1983}}</ref> Chúng có thể được phân loại tuân theo vị trí của nhóm chức trong cấu trúc chính như [[cacbon alpha và beta|alpha- <span style="white-space: nowrap">(α-)</span>, beta- <span style="white-space: nowrap">(β-)</span>, gamma- <span style="white-space: nowrap">(γ-)</span> hoặc delta- <span style="white-space: nowrap">(δ-)</span>]] axít amin; các phân loại khác liên quan đến mức độ [[độ phân cực hóa học|phân cực]], độ [[pH]], và kiểu nhóm thế ([[hợp chất không vòng]], [[hợp chất acyclic]], [[tính thơm]], chứa [[hydroxyl]] hoặc [[lưu huỳnh]], vv.). Trong phân tử [[protein]], axít amin chiếm số lượng nhiều thứ hai ([[nước]] là nhiều nhất) ở [[cơ (sinh học)|cơ]], [[tế bào]] và [[mô]].<ref>{{Cite book|title = Human nutrition in the developing world|last = Latham|first = Michael C.|publisher = Food and Agriculture Organization of the United Nations|year = 1997|isbn = |location = Rome|pages = |chapter = Chapter 8. Body composition, the functions of food, metabolism and energy|chapter-url = http://www.fao.org/docrep/W0073E/w0073e04.htm#P1625_217364|series = Food and Nutrition Series - No. 29}}</ref> Bên ngoài protein, axít amin amino có vai trò quan trọng trong các quá trình như vận chuyển [[chất dẫn truyền thần kinh]] và [[sinh tổng hợp]]. |
|||
Phần dư còn lại của một axít amin là phần mà sau khi đã loại bỏ [[phân tử]] [[nước]] (một [[ion hydro|H<sup>+</sup>]] ra khỏi nitơ và một [[ion hydroxít|OH<sup>-</sup>]] khỏi cacbon) và tạo thành [[liên kết peptít]]. |
|||
Trong ngành [[hóa sinh]], axít amin đều có nhóm amin và nhóm axít cacboxylic liên kết với [[nguyên tử]] cacbon alpha đầu tiên có tính quan trọng đặc biệt. Chúng được biết đến như là '''2-, alpha-,''' hoặc '''α-axít amin''' ([[Công thức hóa học|công thức]] tổng quát H<sub>2</sub>NCHRCOOH trong hầu hết các trường hợp,<ref>[[Proline]] là một trường hợp ngoại lệ đối với công thức này. Nó thiếu nhóm NH<sub>2</sub> do cấu trúc vòng của nhóm thế và được biết đến như là axít imin (imino acid); nó được xếp vào nhóm axít amin có cấu trúc đặc biệt.</ref> với R là một nhóm hữu cơ gọi là "nhóm thế");<ref>{{Cite web|title = an introduction to amino acids|url = http://www.chemguide.co.uk/organicprops/aminoacids/background.html|website = chemguide|accessdate = 2015-07-04|date = August 2007|last = Clark|first = Jim}}</ref> thường thuật ngữ "axít amin" là nhắc tới cụ thể hợp chất hóa học này. Chúng bao gồm 23 axít amin cấu thành lên protein,<ref>{{cite encyclopedia|year = 2008|title = Amino acids|encyclopedia = Peptides from A to Z: A Concise Encyclopedia|url = https://books.google.com/books?id=doe9NwgJTAsC&pg=PA20|publisher = Wiley-VCH|location = Germany|isbn = 9783527621170|via = Google Books|page = 20|last = Jakubke|first = Hans-Dieter|last2 = Sewald|first2 = Norbert}}</ref><ref>{{cite book |editor1-first = Loredano|editor1-last = Pollegioni|editor2-first = Stefano|editor2-last = Servi|title = Unnatural Amino Acids: Methods and Protocols|year = 2012|publisher = Humana Press|isbn = 978-1-61779-331-8|page = v|oclc = 756512314|series = Methods in Molecular Biology - Volume 794|url = http://link.springer.com/book/10.1007%2F978-1-61779-331-8}}</ref><ref>{{cite journal |vauthors = Hertweck C|title = Biosynthesis and Charging of Pyrrolysine, the 22nd Genetically Encoded Amino Acid|journal = Angewandte Chemie International Edition|volume = 50|issue = 41|pages = 9540–1|year = 2011|pmid = 21796749|doi = 10.1002/anie.201103769}} |
|||
</ref> mà khi kết hợp lại thành những chuỗi [[peptide]] ("polypeptide") để tạo thành những viên gạch của vô số protein.<ref name="NIGMS">{{cite web|url = http://publications.nigms.nih.gov/structlife/chapter1.html|title = Chapter 1: Proteins are the Body's Worker Molecules|publisher = National Institute of General Medical Sciences|accessdate = 2008-05-20|date = 27 October 2011|website = The Structures of Life}}</ref> Tất cả chúng là những <small>L</small>-[[đồng phân lập thể]] (các [[đồng phân]] "thuận tay trái" (left-handed)), mặc dù một số nhỏ <small>D</small>-axít amin ("thuận tay phải") xuất hiện ở vỏ tế bào vi khuẩn, như chất điều biến neuron (neuromodulator; D-[[serine]]), và ở một số [[kháng sinh]].<ref>{{Cite book|title = Biochemical Pathways: An Atlas of Biochemistry and Molecular Biology|last = |first = |publisher = Wiley|year = 2012|isbn = |location = |editor-last = Michal|editor-first = Gerhard|editor-last2 = Schomburg|editor-first2 = Dietmar|page = 5|edition = 2nd}}</ref> 20 loại axít amin sinh protein được mã hóa trực tiếp bởi bộ ba mã hóa [[codon]] trong [[mã di truyền]] và được coi là những axít amin "chuẩn". Ba axít amin khác ("không chuẩn" hoặc "không chính tắc") là [[selenocysteine]] (có mặt ở nhiều sinh vật nhân sơ cũng như ở hầu hết sinh vật nhân thực, nhưng không do [[ADN]] mã hóa trực tiếp), [[pyrrolysine]] (chỉ thấy xuất hiện ở một số [[vi khuẩn cổ]] và một [[vi khuẩn]]) và [[N-Formylmethionine|''N''-formylmethionine]] (mà là axít amin khởi đầu của protein trong vi khuẩn, [[ty thể]], và [[lục lạp]]). Pyrrolysine và selenocysteine được mã hóa thông qua một số codon khác nhau; ví dụ, selenocysteine được mã hóa bởi codon kết thúc (stop codon) và phần tử SECIS (SECIS element).<ref name="books.google.com">[https://books.google.com/books?id=BDn-AI_YBlMC&pg=PA1&lpg=PA1&ots=WSsFhHJwDy&sig=jkSLFr7AK8iu6OhdX7KOc10eKRY&hl=en&sa=X&ei=gshLUOWZLIin0AXRm4GoBg Modeling Electrostatic Contributions to Protein Folding and Binding] – Tjong, p.1 footnote</ref><ref name="VoJw6fIISSkC p.299">[https://books.google.com/books?id=VoJw6fIISSkC&pg=PA299&lpg=PA299&ots=C20L115r05&sig=4cix7yKNlod3xbzy2TWiOzEe6As&hl=en&sa=X&ei=H81LUL6MOfC10QX4wYG4Cw&ved=0CIcBEOgBMA8 Frontiers in Drug Design and Discovery] ed. Atta-Ur-Rahman & others, p.299</ref><ref name="url_The_Genetic_Codes_NCBI">{{cite web | url = http://www.ncbi.nlm.nih.gov/Taxonomy/Utils/wprintgc.cgi?mode=c | title = The Genetic Codes |vauthors=Elzanowski A, Ostell J | date = 7 April 2008 | work = | publisher = National Center for Biotechnology Information (NCBI) | pages = | quote = | accessdate = 10 March 2010 }}</ref> Tổ hợp Codon–[[RNA vận chuyển|tRNA]] không tìm thấy trong tự nhiên cũng được sử dụng để "mở rộng" mã di truyền và tạo ra các protein chuyên biệt như [[alloprotein]] chứa các axít amin không chuẩn.<ref name="pmid16260173">{{cite journal | vauthors = Xie J, Schultz PG | title = Adding amino acids to the genetic repertoire | journal = Current Opinion in Chemical Biology | volume = 9 | issue = 6 | pages = 548–54 | date = December 2005 | pmid = 16260173 | doi = 10.1016/j.cbpa.2005.10.011 }}</ref><ref name="pmid19318213">{{cite journal | vauthors = Wang Q, Parrish AR, Wang L | title = Expanding the genetic code for biological studies | journal = Chem. Biol. | volume = 16 | issue = 3 | pages = 323–36 | date = March 2009 | pmid = 19318213 | pmc = 2696486 | doi = 10.1016/j.chembiol.2009.03.001 }}</ref><ref name="isbn0-387-22046-1">{{cite book | author = Simon M | title = Emergent computation: emphasizing bioinformatics | publisher = AIP Press/Springer Science+Business Media | location = New York | year = 2005 | pages = 105–106 | isbn = 0-387-22046-1 }}</ref> |
|||
Nhiều axít amin chuẩn và các axít amin không chuẩn cũng có vai trò quan trọng khác bên trong cơ thể ngoài việc cấu tạo lên protein. Ví dụ, trong [[não người]], glutamat ([[axit glutamic]] chuẩn) và [[axit gamma-amino-butyric]] ("GABA", axit gamma-amino không chuẩn) lần lượt là chất dẫn truyền thần kinh kích thích và ức chế (excitatory and inhibitory neurotransmitters);<ref name="pmid12467378">{{cite journal | vauthors = Petroff OA | title = GABA and glutamate in the human brain | journal = Neuroscientist | volume = 8 | issue = 6 | pages = 562–573 | date = December 2002 | pmid = 12467378 | doi = 10.1177/1073858402238515 | url = http://nro.sagepub.com/cgi/pmidlookup?view=long&pmid=12467378 }}</ref> [[hydroxyproline]] (một thành phần chính trong [[collagen]] của [[mô liên kết]]) được tổng hợp từ [[proline]]; axit amin chuẩn [[glycine]] dùng để tổng hợp porphyrin ở [[hồng cầu]]; và axit amin không chuẩn [[carnitine]] tham gia vào quá trình [[lipid|vận chuyển lipid]]. |
|||
Có 9 axit amin sinh protein [[axit amin thiết yếu|"thiết yếu"]] ở cơ thể người do chúng không được tổng hợp từ những hợp chất khác trong cơ thể do vậy cơ thể cần các axit amin này thông qua thức ăn đưa vào. Ngoài ra một số axit amin thiết yếu có điều kiện, nghĩa là bình thường chúng không nhất thiết phải có trong thức ăn, nhưng lại cần có trong khẩu phần của những người không tổng hợp được chúng với một lượng đủ. Axit amin thiết yếu cũng khác nhau tùy từng [[loài]] cụ thể.<ref>Ví dụ, ở [[động vật nhai lại]] như bò lấy một số axit amin thông qua [[vi sinh vật]] trong ngăn ruột tiêu hóa của chúng.</ref> |
|||
Bởi vì ý nghĩa sinh học của chúng, các axit amin là những chất dinh dưỡng quan trọng và thường sử dụng trong [[bổ sung dinh dưỡng]], [[phân bón]], và [[công nghệ thực phẩm]]. Công nghiệp sử dụng bao gồm các sản phẩm [[dược phẩm|thuốc]], nhựa phân hủy bằng sinh học (biodegradable plastic), và các chất xúc tác bất đối xứng (asymmetric catalysis). |
|||
==Lịch sử== |
|||
Một vài axit amin đầu tiên đã được khám phá vào đầu thế kỷ 19. Năm 1806, hai nhà hóa học người Pháp [[Louis-Nicolas Vauquelin]] và [[Pierre Jean Robiquet]] đã cô lập hợp chất trong [[măng tây]] (asparagus) mà sau đó người ta đặt tên nó là [[asparagine]], trở thành axit amin được khám phá đầu tiên.<ref>{{Cite journal|title=The discovery of a new plant principle in Asparagus sativus |vauthors=Vauquelin LN, Robiquet PJ |journal=Annales de Chimie |year=1806 |volume=57 |pages=88–93}}</ref><ref name=Anfinsen>{{Cite book|title=Advances in Protein Chemistry |vauthors=Anfinsen CB, Edsall JT, Richards FM |year=1972 |pages=99, 103 |publisher=Academic Press |location=New York |isbn=978-0-12-034226-6}}</ref> [[Cystine]] được phát hiện vào năm 1810,<ref>{{Cite journal|title=On cystic oxide, a new species of urinary calculus |author=Wollaston WH |journal=Philosophical Transactions of the Royal Society |year=1810 |volume=100|pages=223–30 |doi=10.1098/rstl.1810.0015}}</ref> cho dù monome của nó, [[cysteine]], chưa bị phát hiện cho đến tận năm 1884.<ref name=Anfinsen/><ref>{{Cite journal|title=Über cystin und cystein |author=Baumann E |journal=Z Physiol Chem |year=1884 |volume=8 |issue=4|pages=299–305 | url=http://vlp.mpiwg-berlin.mpg.de/library/data/lit16533 | accessdate=28 March 2011 | archiveurl= https://web.archive.org/web/20110314075450/http://vlp.mpiwg-berlin.mpg.de/library/data/lit16533| archivedate= 14 March 2011 | deadurl= no}}</ref> [[Glycine]] và [[leucine]] được phát hiện vào năm 1820.<ref>{{Cite journal|title=Sur la conversion des matières animales en nouvelles substances par le moyen de l'acide sulfurique |author=Braconnot HM |journal=Annales de Chimie et de Physique |series=2nd Series |year=1820 |volume=13 |pages=113–25}}</ref> Axit amin cuối cùng trong 20 axit amin phổ biến là [[threonine]] được [[William Cumming Rose]] phát hiện vào năm 1935, ông cũng xác định các axit amin thiết yếu và thiết lập mức nhu cầu đòi hỏi tối thiểu về axit amin hàng ngày cho sự phát triển tối ưu.<ref>{{cite journal |url=http://www.jbc.org/content/277/37/e25 |title= The Discovery of the Amino Acid Threonine: the Work of William C. Rose |author1=Robert D. Simoni |author2=Robert L. Hill |author3=Martha Vaughan |journal=Journal of Biological Chemistry |date= September 13, 2002|volume=277 |issue=37 |pages=56–58 |pmid=12218068 }}</ref><ref>{{cite journal |title=Feeding Experiments with Mixtures of Highly Purified Amino Acids. VIII. Isolation and Identification of a New Essential Amino Acid |author=McCoy, R. H. |author2=Meyer, C. E. |author3=Rose, W. C. |last-author-amp=yes |year=1935|journal= Journal of Biological Chemistry |volume= 112 |pages= 283–302 }}</ref> |
|||
Thuật ngữ ''amino acid'' sử dụng trong tiếng Anh xuất hiện từ năm 1898.<ref>{{cite web| url = http://www.etymonline.com/index.php?term=amino | publisher = www.etymonline.com | title = etymonline.com entry for ''amino'' | accessdate = 19 July 2010}}</ref> Các nhà hóa học tìm thấy protein cho thu được các axit amin từ các enzim tiêu hóa hoặc [[thủy phân]] axit. Năm 1902, [[Hermann Emil Fischer|Emil Fischer]] và [[Franz Hofmeister]] đề xuất protein hình thành từ liên kết giữa nhóm amin của một axit amin với nhóm cacboxyl của axit amin bên cạnh, tạo thành mạch thẳng mà Fischer đặt tên là "peptit".<ref>{{cite book |author=Joseph S. Fruton |title=Contrasts in Scientific Style: Research Groups in the Chemical and Biochemical Sciences, |volume=191 |year=1990 |chapter=Chapter 5- Emil Fischer and Franz Hofmeister |pages=163–165 |publisher=American Philosophical Society |isbn=0-87169-191-4 }}</ref> |
|||
== Tổng quan == |
== Tổng quan == |
||
| Dòng 44: | Dòng 58: | ||
==Tham khảo== |
==Tham khảo== |
||
{{tham khảo}} |
{{tham khảo|2}} |
||
== Liên kết ngoài == |
== Liên kết ngoài == |
||
| ⚫ | |||
* [http://micro.magnet.fsu.edu/aminoacids/index.html Molecular Expressions: The Amino Acid Collection] - Chứa các thông tin chi tiết và hình vi ảnh của mỗi axít amin. |
* [http://micro.magnet.fsu.edu/aminoacids/index.html Molecular Expressions: The Amino Acid Collection] - Chứa các thông tin chi tiết và hình vi ảnh của mỗi axít amin. |
||
* [http://researchnews.osu.edu/archive/aminoacd.htm 22nd amino acid] - Bản phát hành từ Ohio State tuyên bố việc tìm ra axít amin thứ 22. |
* [http://researchnews.osu.edu/archive/aminoacd.htm 22nd amino acid] - Bản phát hành từ Ohio State tuyên bố việc tìm ra axít amin thứ 22. |
||
| Dòng 51: | Dòng 66: | ||
* [http://www.organic-chemistry.org/synthesis/C1C/nitrogen/alpha-amino-acids2.shtm Tổng hợp axít amin và dẫn xuất] |
* [http://www.organic-chemistry.org/synthesis/C1C/nitrogen/alpha-amino-acids2.shtm Tổng hợp axít amin và dẫn xuất] |
||
* [http://www.newscientist.com/article.ns?id=mg19025545.200&feedId=online-news_rss20 Right-handed axít amin were left behind] |
* [http://www.newscientist.com/article.ns?id=mg19025545.200&feedId=online-news_rss20 Right-handed axít amin were left behind] |
||
| ⚫ | |||
[[Thể loại:Axít amin| ]] |
[[Thể loại:Axít amin| ]] |
||
Phiên bản lúc 13:50, ngày 27 tháng 7 năm 2016
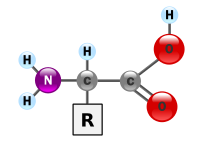
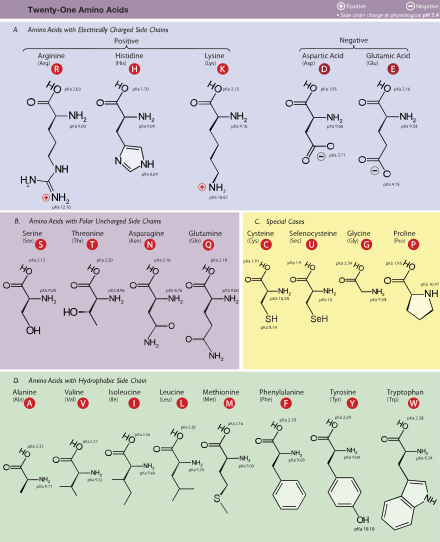
Axít amin là những hợp chất hữu cơ sinh học quan trọng chứa nhóm chức amin (-NH2) và axít cacboxylic (-COOH), cùng với một nhóm thế (hay còn gọi mạch bên, side-chain) (nhóm R) nhất định ở mỗi axít amin.[1][2][3] Các nguyên tố chính của axít amin là cacbon, hiđrô, ôxy, và nitơ, và một số nguyên tố khác có mặt trong nhóm thế của từng axít amin. Tồn tại khoảng 500 axít amin đã được biết đến và phân loại theo nhiều cách khác nhau.[4] Chúng có thể được phân loại tuân theo vị trí của nhóm chức trong cấu trúc chính như alpha- (α-), beta- (β-), gamma- (γ-) hoặc delta- (δ-) axít amin; các phân loại khác liên quan đến mức độ phân cực, độ pH, và kiểu nhóm thế (hợp chất không vòng, hợp chất acyclic, tính thơm, chứa hydroxyl hoặc lưu huỳnh, vv.). Trong phân tử protein, axít amin chiếm số lượng nhiều thứ hai (nước là nhiều nhất) ở cơ, tế bào và mô.[5] Bên ngoài protein, axít amin amino có vai trò quan trọng trong các quá trình như vận chuyển chất dẫn truyền thần kinh và sinh tổng hợp.
Trong ngành hóa sinh, axít amin đều có nhóm amin và nhóm axít cacboxylic liên kết với nguyên tử cacbon alpha đầu tiên có tính quan trọng đặc biệt. Chúng được biết đến như là 2-, alpha-, hoặc α-axít amin (công thức tổng quát H2NCHRCOOH trong hầu hết các trường hợp,[6] với R là một nhóm hữu cơ gọi là "nhóm thế");[7] thường thuật ngữ "axít amin" là nhắc tới cụ thể hợp chất hóa học này. Chúng bao gồm 23 axít amin cấu thành lên protein,[8][9][10] mà khi kết hợp lại thành những chuỗi peptide ("polypeptide") để tạo thành những viên gạch của vô số protein.[11] Tất cả chúng là những L-đồng phân lập thể (các đồng phân "thuận tay trái" (left-handed)), mặc dù một số nhỏ D-axít amin ("thuận tay phải") xuất hiện ở vỏ tế bào vi khuẩn, như chất điều biến neuron (neuromodulator; D-serine), và ở một số kháng sinh.[12] 20 loại axít amin sinh protein được mã hóa trực tiếp bởi bộ ba mã hóa codon trong mã di truyền và được coi là những axít amin "chuẩn". Ba axít amin khác ("không chuẩn" hoặc "không chính tắc") là selenocysteine (có mặt ở nhiều sinh vật nhân sơ cũng như ở hầu hết sinh vật nhân thực, nhưng không do ADN mã hóa trực tiếp), pyrrolysine (chỉ thấy xuất hiện ở một số vi khuẩn cổ và một vi khuẩn) và N-formylmethionine (mà là axít amin khởi đầu của protein trong vi khuẩn, ty thể, và lục lạp). Pyrrolysine và selenocysteine được mã hóa thông qua một số codon khác nhau; ví dụ, selenocysteine được mã hóa bởi codon kết thúc (stop codon) và phần tử SECIS (SECIS element).[13][14][15] Tổ hợp Codon–tRNA không tìm thấy trong tự nhiên cũng được sử dụng để "mở rộng" mã di truyền và tạo ra các protein chuyên biệt như alloprotein chứa các axít amin không chuẩn.[16][17][18]
Nhiều axít amin chuẩn và các axít amin không chuẩn cũng có vai trò quan trọng khác bên trong cơ thể ngoài việc cấu tạo lên protein. Ví dụ, trong não người, glutamat (axit glutamic chuẩn) và axit gamma-amino-butyric ("GABA", axit gamma-amino không chuẩn) lần lượt là chất dẫn truyền thần kinh kích thích và ức chế (excitatory and inhibitory neurotransmitters);[19] hydroxyproline (một thành phần chính trong collagen của mô liên kết) được tổng hợp từ proline; axit amin chuẩn glycine dùng để tổng hợp porphyrin ở hồng cầu; và axit amin không chuẩn carnitine tham gia vào quá trình vận chuyển lipid.
Có 9 axit amin sinh protein "thiết yếu" ở cơ thể người do chúng không được tổng hợp từ những hợp chất khác trong cơ thể do vậy cơ thể cần các axit amin này thông qua thức ăn đưa vào. Ngoài ra một số axit amin thiết yếu có điều kiện, nghĩa là bình thường chúng không nhất thiết phải có trong thức ăn, nhưng lại cần có trong khẩu phần của những người không tổng hợp được chúng với một lượng đủ. Axit amin thiết yếu cũng khác nhau tùy từng loài cụ thể.[20]
Bởi vì ý nghĩa sinh học của chúng, các axit amin là những chất dinh dưỡng quan trọng và thường sử dụng trong bổ sung dinh dưỡng, phân bón, và công nghệ thực phẩm. Công nghiệp sử dụng bao gồm các sản phẩm thuốc, nhựa phân hủy bằng sinh học (biodegradable plastic), và các chất xúc tác bất đối xứng (asymmetric catalysis).
Lịch sử
Một vài axit amin đầu tiên đã được khám phá vào đầu thế kỷ 19. Năm 1806, hai nhà hóa học người Pháp Louis-Nicolas Vauquelin và Pierre Jean Robiquet đã cô lập hợp chất trong măng tây (asparagus) mà sau đó người ta đặt tên nó là asparagine, trở thành axit amin được khám phá đầu tiên.[21][22] Cystine được phát hiện vào năm 1810,[23] cho dù monome của nó, cysteine, chưa bị phát hiện cho đến tận năm 1884.[22][24] Glycine và leucine được phát hiện vào năm 1820.[25] Axit amin cuối cùng trong 20 axit amin phổ biến là threonine được William Cumming Rose phát hiện vào năm 1935, ông cũng xác định các axit amin thiết yếu và thiết lập mức nhu cầu đòi hỏi tối thiểu về axit amin hàng ngày cho sự phát triển tối ưu.[26][27]
Thuật ngữ amino acid sử dụng trong tiếng Anh xuất hiện từ năm 1898.[28] Các nhà hóa học tìm thấy protein cho thu được các axit amin từ các enzim tiêu hóa hoặc thủy phân axit. Năm 1902, Emil Fischer và Franz Hofmeister đề xuất protein hình thành từ liên kết giữa nhóm amin của một axit amin với nhóm cacboxyl của axit amin bên cạnh, tạo thành mạch thẳng mà Fischer đặt tên là "peptit".[29]
Tổng quan
Amino acid là đơn vị cấu trúc cơ bản của protein. Chúng tạo thành các xích polymer ngắn gọi là peptide hay polypeptides để rồi tạo thành cấu trúc gọi là protein. Quá trình tạo thành từ mARN làm mẫu gọi là dịch mã, là một phần của tổng hợp protein.

Có 20 loại amino acid được mã hóa bởi mã di truyền chuẩn và được gọi là proteinogenic hay amino acid chuẩn. Việc kết hợp các amino acid này tạo ra protein thiết yếu cho việc cấu thành cơ thể người. Có ít nhất hai loại khác được mã hóa bởi DNA theo một cách khác (không chuẩn):
- Selenocysteine kết hợp với một vài protein ở UGA codon, thường gọi là stop codon.
- Pyrrolysine được sử dụng bởi một vài methanogen trong các enzyme mà được dùng để sản xuất ra methane. Nó được mã hóa giống với của selenocysteine nhưng mà bằng codon UAG.
Các loại amino acid khác chứa trong protein thường được tạo thành bởi bằng cách chỉnh sửa sau khi dịch mã. Việc chỉnh sửa này thường rất cần thiết cho chức năng của protein.
Trong proline chỉ có proteinogenic amino acid là có các nhóm cyclizes nằm trên khung xương: nó liên kết với nhóm α-amino, vì thế cũng chỉ có proteinogenic amino acid là có chứa amin thứ cấp ở vị trí này. Đôi khi proline còn được gọi là imino acid, nhưng mà acid này không tuân theo các quy tắc nomenclature.
Có hơn 100 amino acid đã được tìm thấy trong tự nhiên. Một trong số chúng đã được tìm thấy trong các thiên thạch, đặc biệt trong các dạng được biết nhiều như carbonaceous chondrite. Vi sinh vật và thực vật có thể sản xuất ra các amino acid bất thường mà thường được tìm thấy trong các peptide kháng thể (ví dụ như nisin hoặc alamethicin). Lanthionine là một alanine dimer có cầu nối sulfide, thường được tìm thấy chung với các unsaturated amino acid trong lantibiotics (là các peptide kháng thể của microbial origin). 1-Aminocyclopropane-1-carboxylic acid (ACC) là một disubstituted cyclic amino acid nhỏ và là một chất trung gian quan trọng trong việc tạo ra các hormone ethylene thực vật.
Ngoài việc tổng hợp protein, các amino acid còn có các vai trò sinh học quan trọng khác. Glycine và glutamate là các chất truyền dẫn thần kinh cũng như các amino acid chuẩn mực khác trong các protein. Nhiều amino acid được dùng để tổng hợp các phân tử khác, ví dụ như:
- tryptophan là tiền chất của chất truyền thần kinh serotonin
- glycine là một trong số các chất phản ứng trong quá trình tổng hợp porphyrins như heme
- arginine được dùng để tổng hợp hormone nitric oxide
Phần lớn các amino acid không chuẩn mực cũng có một số chức năng sinh học quan trọng: Gamma-aminobutyric acid là một chất truyền thần kinh khác nữa, carnitine được sử dụng trong việc chuyển lipid vào bên trong cell, ornithine, citrulline, homocysteine, hydroxyproline, hydroxylysine, và sarcosine.
Một vài trong số 20 amino acid tiêu chuẩn được gọi là các amino acid thiết yếu do chúng không thể được tổng hợp bởi cơ thể từ các hợp chất khác thông qua các phản ứng hóa học, mà nằm trong gỗ. Ở người, các amino acid thiết yếu là lysine, leucine, isoleucine, methionine, phenylalanine, threonine, tryptophan, valine. Histidine và arginine nói chung được xem như là cần thiết ở trẻ con, do ở cơ thể trẻ con không có khả năng tổng hợp ra chúng.
Cụm từ "các amino acid trục phân nhánh (branched-chain amino acids)" đôi khi được dùng để nói tới các aliphatic amino acid: leucine, isoleucine và valine.
Cấu trúc tổng quát
Cấu trúc tổng quát của proteinogenic alpha amino acid:
H2N-CH(R)-COOH
Trong đó R là trục đặc biệt quan trọng đối với mỗi amino acid. Các amino acid thường được phân loại dựa theo đặc tính hóa học của trục (R) thành 4 nhóm. Chuỗi bên có thể xem giống như một axit yếu, base yếu, một hydrophile nếu chúng là cực, và hydrophobe nếu chúng là không cực.
Các dạng đồng phân
Hầu hết các amino acid đều có 2 dạng đồng phân lập thể đồng phân lập thể, là D và L. Dạng L gồm những amino acid có vai trò quan trọng có trong các protein. Còn dạng D chỉ gồm một số amino acid trong các protein có trong các sinh vật sống dưới nước, ví dụ ốc hình nón. Chúng cũng có nhiều các thành phần vách tế bào proteoglycan của bacteria. Đồng phân dạng D của aspartic acid có trong một số protein là kết quả của quá trình biến đổi sau dịch mã tự phát kết hợp với sự hóa già protein hoặc giống như là sản phẩm phụ của quá trình biến đổi enzyme được xúc tác bởi protein L-isoaspartyl methyltransferase.
Tham khảo
- ^ “Amino”. Dictionary.com. 2015. Truy cập ngày 3 tháng 7 năm 2015.
- ^ “amino acid”. Cambridge Dictionaries Online. Cambridge University Press. 2015. Truy cập ngày 3 tháng 7 năm 2015.
- ^ “amino”. FreeDictionary.com. Farlex. 2015. Truy cập ngày 3 tháng 7 năm 2015.
- ^ Wagner I, Musso H (tháng 11 năm 1983). “New Naturally Occurring Amino Acids”. Angewandte Chemie International Edition in English. 22 (11): 816–28. doi:10.1002/anie.198308161.
- ^ Latham, Michael C. (1997). “Chapter 8. Body composition, the functions of food, metabolism and energy”. Human nutrition in the developing world. Food and Nutrition Series - No. 29. Rome: Food and Agriculture Organization of the United Nations.
- ^ Proline là một trường hợp ngoại lệ đối với công thức này. Nó thiếu nhóm NH2 do cấu trúc vòng của nhóm thế và được biết đến như là axít imin (imino acid); nó được xếp vào nhóm axít amin có cấu trúc đặc biệt.
- ^ Clark, Jim (tháng 8 năm 2007). “an introduction to amino acids”. chemguide. Truy cập ngày 4 tháng 7 năm 2015.
- ^ Jakubke, Hans-Dieter; Sewald, Norbert (2008). “Amino acids”. Peptides from A to Z: A Concise Encyclopedia. Germany: Wiley-VCH. tr. 20. ISBN 9783527621170 – qua Google Books.
- ^ Pollegioni, Loredano; Servi, Stefano biên tập (2012). Unnatural Amino Acids: Methods and Protocols. Methods in Molecular Biology - Volume 794. Humana Press. tr. v. ISBN 978-1-61779-331-8. OCLC 756512314.
- ^ Hertweck C (2011). “Biosynthesis and Charging of Pyrrolysine, the 22nd Genetically Encoded Amino Acid”. Angewandte Chemie International Edition. 50 (41): 9540–1. doi:10.1002/anie.201103769. PMID 21796749.
- ^ “Chapter 1: Proteins are the Body's Worker Molecules”. The Structures of Life. National Institute of General Medical Sciences. 27 tháng 10 năm 2011. Truy cập ngày 20 tháng 5 năm 2008.
- ^ Michal, Gerhard; Schomburg, Dietmar biên tập (2012). Biochemical Pathways: An Atlas of Biochemistry and Molecular Biology (ấn bản 2). Wiley. tr. 5.
- ^ Modeling Electrostatic Contributions to Protein Folding and Binding – Tjong, p.1 footnote
- ^ Frontiers in Drug Design and Discovery ed. Atta-Ur-Rahman & others, p.299
- ^ Elzanowski A, Ostell J (7 tháng 4 năm 2008). “The Genetic Codes”. National Center for Biotechnology Information (NCBI). Truy cập ngày 10 tháng 3 năm 2010.
- ^ Xie J, Schultz PG (tháng 12 năm 2005). “Adding amino acids to the genetic repertoire”. Current Opinion in Chemical Biology. 9 (6): 548–54. doi:10.1016/j.cbpa.2005.10.011. PMID 16260173.
- ^ Wang Q, Parrish AR, Wang L (tháng 3 năm 2009). “Expanding the genetic code for biological studies”. Chem. Biol. 16 (3): 323–36. doi:10.1016/j.chembiol.2009.03.001. PMC 2696486. PMID 19318213.
- ^ Simon M (2005). Emergent computation: emphasizing bioinformatics. New York: AIP Press/Springer Science+Business Media. tr. 105–106. ISBN 0-387-22046-1.
- ^ Petroff OA (tháng 12 năm 2002). “GABA and glutamate in the human brain”. Neuroscientist. 8 (6): 562–573. doi:10.1177/1073858402238515. PMID 12467378.
- ^ Ví dụ, ở động vật nhai lại như bò lấy một số axit amin thông qua vi sinh vật trong ngăn ruột tiêu hóa của chúng.
- ^ Vauquelin LN, Robiquet PJ (1806). “The discovery of a new plant principle in Asparagus sativus”. Annales de Chimie. 57: 88–93.
- ^ a b Anfinsen CB, Edsall JT, Richards FM (1972). Advances in Protein Chemistry. New York: Academic Press. tr. 99, 103. ISBN 978-0-12-034226-6.
- ^ Wollaston WH (1810). “On cystic oxide, a new species of urinary calculus”. Philosophical Transactions of the Royal Society. 100: 223–30. doi:10.1098/rstl.1810.0015.
- ^ Baumann E (1884). “Über cystin und cystein”. Z Physiol Chem. 8 (4): 299–305. Bản gốc lưu trữ ngày 14 tháng 3 năm 2011. Truy cập ngày 28 tháng 3 năm 2011. Đã bỏ qua tham số không rõ
|deadurl=(gợi ý|url-status=) (trợ giúp) - ^ Braconnot HM (1820). “Sur la conversion des matières animales en nouvelles substances par le moyen de l'acide sulfurique”. Annales de Chimie et de Physique. 2nd Series. 13: 113–25.
- ^ Robert D. Simoni; Robert L. Hill; Martha Vaughan (13 tháng 9 năm 2002). “The Discovery of the Amino Acid Threonine: the Work of William C. Rose”. Journal of Biological Chemistry. 277 (37): 56–58. PMID 12218068.
- ^ McCoy, R. H.; Meyer, C. E.; Rose, W. C. (1935). “Feeding Experiments with Mixtures of Highly Purified Amino Acids. VIII. Isolation and Identification of a New Essential Amino Acid”. Journal of Biological Chemistry. 112: 283–302. Đã bỏ qua tham số không rõ
|last-author-amp=(gợi ý|name-list-style=) (trợ giúp) - ^ “etymonline.com entry for amino”. www.etymonline.com. Truy cập ngày 19 tháng 7 năm 2010.
- ^ Joseph S. Fruton (1990). “Chapter 5- Emil Fischer and Franz Hofmeister”. Contrasts in Scientific Style: Research Groups in the Chemical and Biochemical Sciences,. 191. American Philosophical Society. tr. 163–165. ISBN 0-87169-191-4.
Liên kết ngoài
| Wikimedia Commons có thêm hình ảnh và phương tiện truyền tải về Amino acid. |
- Molecular Expressions: The Amino Acid Collection - Chứa các thông tin chi tiết và hình vi ảnh của mỗi axít amin.
- 22nd amino acid - Bản phát hành từ Ohio State tuyên bố việc tìm ra axít amin thứ 22.
- Amino acid properties - Tính chất của axít amin (công cụ nhằm mục đích tìm hiểu ý nghĩa của việc đột biến)
- Tổng hợp axít amin và dẫn xuất
- Right-handed axít amin were left behind
