Methan
| Methan | |||
|---|---|---|---|
| |||
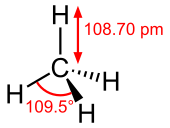 Công thức lập thể, công thức cấu tạo của methan | |||
| Tên hệ thống | Carbane (ít dùng[1]) | ||
| Tên khác |
| ||
| Nhận dạng | |||
| Số CAS | |||
| PubChem | |||
| Số EINECS | |||
| KEGG | |||
| MeSH | |||
| ChEBI | |||
| ChEMBL | |||
| Số RTECS | PA1490000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| Tham chiếu Beilstein | 1718732 | ||
| Tham chiếu Gmelin | 59 | ||
| 3DMet | |||
| UNII | |||
| Thuộc tính | |||
| Công thức phân tử | CH4 | ||
| Bề ngoài | Chất khí không màu | ||
| Mùi | Không mùi | ||
| Khối lượng riêng | |||
| Điểm nóng chảy | −182,456 °C (90,694 K; −296,421 °F)[3] | ||
| Điểm sôi | −161,5 °C (111,6 K; −258,7 °F)[3] | ||
| Độ hòa tan trong nước | 22.7 mg·L−1[4] | ||
| Độ hòa tan | Tan trong etanol, diethyl ether, benzen, toluen, methanol, aceton và ít tan trong nước | ||
| log P | 1.09 | ||
| kH | 14 nmol·Pa−1·kg−1 | ||
| MagSus | −17.4×10−6 cm³·mol−1[5] | ||
| Acid liên hợp | Methanium | ||
| Base liên hợp | Methyl anion | ||
| Cấu trúc | |||
| Hình dạng phân tử | tứ diện | ||
| Mômen lưỡng cực | 0 D | ||
| Nhiệt hóa học | |||
| Enthalpy hình thành ΔfH | −74.6 kJ·mol−1 | ||
| DeltaHc | −891 kJ·mol−1 | ||
| Entropy mol tiêu chuẩn S | 186.3 J·(K·mol)−1 | ||
| Nhiệt dung | 35.7 J·(K·mol)−1 | ||
| Các nguy hiểm | |||
| NFPA 704 |
| ||
| Giới hạn nổ | 4.4–17% | ||
| Ký hiệu GHS |  | ||
| Báo hiệu GHS | DANGER | ||
| Chỉ dẫn nguy hiểm GHS | H220 | ||
| Chỉ dẫn phòng ngừa GHS | P210 | ||
| Các hợp chất liên quan | |||
| Nhóm chức liên quan | |||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Methan (US: /ˈmɛθeɪn/ hoặc UK: /ˈmiːθeɪn/) là một hợp chất hóa học với công thức hóa học CH4 (một nguyên tử carbon và bốn nguyên tử hydro). Nó là một hydride nhóm 14 và là alkan đơn giản nhất, và là thành phần chính của khí tự nhiên. Sự phong phú tương đối của khí methan trên Trái Đất làm cho nó trở thành một loại nhiên liệu hấp dẫn, mặc dù việc thu giữ và lưu trữ nó đặt ra những thách thức do trạng thái khí của nó trong điều kiện bình thường về nhiệt độ và áp suất.
Methan xuất hiện tự nhiên được tìm thấy cả dưới mặt đất và dưới đáy biển, và được hình thành bởi cả quá trình địa chất và sinh học. Hồ chứa khí methan lớn nhất nằm dưới đáy biển dưới dạng clathrat methan. Khi khí methan đến bề mặt và khí quyển, nó được gọi là khí methan trong khí quyển.[7] Nồng độ khí methan trong khí quyển của Trái Đất đã tăng khoảng 150% kể từ năm 1750 và nó chiếm 20% tổng lượng bức xạ cưỡng bức từ tất cả các loại khí nhà kính tồn tại lâu dài và hỗn hợp trên toàn cầu.[8] Khí methan cũng đã được phát hiện trên các hành tinh khác, bao gồm Sao Hỏa, và có ý nghĩa đối với nghiên cứu sinh vật học.[9]
Thuộc tính và liên kết[sửa | sửa mã nguồn]
Methan là một phân tử tứ diện có bốn liên kết C-H tương đương. Cấu trúc điện tử của nó được mô tả bởi bốn quỹ đạo phân tử liên kết (molecular orbital) do sự chồng chéo của các quỹ đạo hóa trị trên C và H. MO năng lượng thấp nhất là kết quả của sự chồng lấp của quỹ đạo 2s trên carbon với sự kết hợp cùng pha của quỹ đạo 1s trên bốn nguyên tử hydro. Trên mức năng lượng này là một tập hợp các MO suy biến ba lần liên quan đến sự chồng chéo của các quỹ đạo 2p trên carbon với các tổ hợp tuyến tính khác nhau của các quỹ đạo 1s trên hydro. Sơ đồ liên kết "ba trên một" kết quả phù hợp với phép đo phổ quang điện tử.
Ở nhiệt độ phòng và áp suất tiêu chuẩn, methan là một loại khí không màu, không mùi.[10] Mùi khí tự nhiên quen thuộc được sử dụng trong nhà đạt được bằng cách thêm chất tạo mùi, thường là hỗn hợp có chứa tert-butylthiol, như một biện pháp an toàn. Khí methan có nhiệt độ sôi −164°C (−257,8°F) ở áp suất của một bầu khí quyển.[11] Là một chất khí, nó dễ cháy trong một phạm vi nồng độ (5,4-17%) trong không khí ở áp suất tiêu chuẩn.
Methan rắn tồn tại trong một số đa hình. Hiện tại chín thù hình của chất này được biết đến.[12] Làm lạnh methan ở áp suất bình thường dẫn đến sự hình thành methan I. Chất này kết tinh trong hệ thống khối (nhóm không gian Fm 3 m). Vị trí của các nguyên tử hydro không cố định trong methan I, tức là các phân tử methan có thể xoay tự do. Do đó, nó là một tinh thể nhựa.[13]
Tính chất hóa học[sửa | sửa mã nguồn]
Phản ứng oxy hóa hoàn toàn (Phản ứng cháy)[sửa | sửa mã nguồn]
Trong phản ứng cháy của methan có một số bước. Trước tiên, methan tạo ra gốc metyl (CH3), gốc này phản ứng với oxy sinh ra formaldehyde (HCHO) cho gốc formyl (HCO) để tạo thành carbon monoxide. Quá trình này được gọi là sự nhiệt phân oxy hóa:
- CH4 + 2O2 → CO2 + 2H2O (ΔH = −891 kJ/mol ở 25oC, 1 atm)
Sau đó, hydro bị oxy hóa tạo ra H2O và giải phóng nhiệt. Quá trình này diễn ra rất nhanh, thường chưa tới một phần nghìn giây.
- 2H2 + O2 → 2H2O
Cuối cùng, CO bị oxy hóa tạo thành CO2, và giải phóng thêm nhiệt. Quá trình này chậm hơn quá trình trên và thường mất vài phần nghìn giây để phản ứng.
- 2CO + O2 → 2CO2
Phản ứng oxy hóa không hoàn toàn[sửa | sửa mã nguồn]
Được dùng trong sản xuất formaldehyde, bột than, khí đốt,...
(đốt trong điều kiện thiếu không khí)
Phản ứng nhiệt phân methan:[sửa | sửa mã nguồn]
Methan bị nhiệt phân bằng cách nung nóng nhanh methan với 1 lượng nhỏ oxy ở nhiệt độ khoảng 1500oC:
(ΔH = 397kJ/mol)
Oxy được dùng để đốt cháy 1 phần methan, cung cấp thêm nhiệt cho phản ứng.
Hoạt hóa Hydro[sửa | sửa mã nguồn]
Liên kết cộng hóa trị giữa C-H trong methan thuộc loại bền nhất trong hydrocarbon. Tuy nhiên, methan vẫn là nguyên liệu khởi đầu chính trong sản xuất hydro. Việc tìm kiếm các xúc tác có tác dụng thúc đẩy dễ dàng sự hoạt hóa hydro trong methan và các alkan bậc thấp khác là một lĩnh vực nghiên cứu khá quan trọng trong công nghiệp.
Phản ứng thế halogen[sửa | sửa mã nguồn]
Methan phản ứng với halogen cho ra dẫn xuất halogen của methan và hydro halide.
Ví dụ: Methan phản ứng với chlor trong ánh sáng khuếch tán theo nhiều giai đoạn:
- CH4 + Cl2 → CH3Cl + HCl
- CH3Cl + Cl2 → CH2Cl2 + HCl
- CH2Cl2 + Cl2 → CHCl3 + HCl
- CHCl3 + Cl2 → CCl4 + HCl
Phản ứng phân hủy[sửa | sửa mã nguồn]
Methan có thể bị phân hủy ở nhiệt độ trên 1000oC [14]:
- CH4 → C + 2H2
hoặc khi tác dụng với Cl2 khi đun nóng hoặc fluor ở điều kiện thường, tạo thành muội than và hydro chloride [15]:
- CH4 + 2Cl2 → C + 4HCl
Phương pháp điều chế[sửa | sửa mã nguồn]
- Từ nhôm carbide Al4C3
- Al4C3 + 12H2O → 4Al(OH)3 + 3CH4↑
- Al4C3 + 12HCl → 4AlCl3 + 3CH4↑
- Từ CH3COONa (phản ứng với natri hydroxide) có xúc tác CaO ở nhiệt độ cao.
- Từ CO
- CO + 3H2 → H2O + CH4↑
- C6H12O6 → 3CO2 + 3CH4
- Từ khí thiên nhiên
- Phản ứng cracking alkan từ 3C trở lên (thường là cracking propan tại propan sẽ cho ra sản phẩm là methan trực tiếp)
Ứng dụng[sửa | sửa mã nguồn]
Nhiên liệu[sửa | sửa mã nguồn]
Methan là một nhiên liệu quan trọng. So với than đá, đốt cháy methan sinh ra ít CO2 trên mỗi đơn vị nhiệt giải phóng. Ở nhiều nơi, methan được dẫn tới từng nhà nhằm mục đích sưởi ấm và nấu ăn. Nó thường được biết tới với cái tên khí thiên nhiên.[16]
Trong công nghiệp[sửa | sửa mã nguồn]
Methan được dùng trong nhiều phản ứng hóa công nghiệp và có thể được chuyên chở dưới dạng khí hóa lỏng. Trong hóa công nghiệp, methan là nguyên liệu sản xuất hydro, methanol, acid acetic và anhydride acetic.
Methan trong khí quyển Trái Đất[sửa | sửa mã nguồn]
Methan trong khí quyển là một khí gây hiệu ứng nhà kính.[17] Mật độ của nó đã tăng khoảng 150% từ năm 1750 và đến năm 1998, mật độ trung bình của nó trên bề mặt Trái Đất là 1745 ppb. Mật độ ở bán cầu Bắc cao hơn vì ở đó có nhiều nguồn methan hơn (cả thiên nhiên lẫn nhân tạo). Mật độ của methan thay đổi theo mùa, thấp nhất vào cuối mùa hè.[18]Đ
Quá trình tiêu huỷ[sửa | sửa mã nguồn]
Cơ chế phá hủy chính của methan trong khí quyển là qua tác dụng với gốc hydroxide (OH):
- CH4 + OH → CH3 + H2O
Phản ứng này diễn ra ở trong tầng đối lưu làm cho methan tồn tại được từ 6 đến 9 năm.[19]
Sự giải phóng đột ngột của sàng methan[sửa | sửa mã nguồn]
Ở áp suất lớn, ví dụ như ở dưới đáy đại dương, methan tạo ra một dạng sàng rắn với nước, được gọi là methan hydrat.[20] Một số lượng chưa xác định nhưng có lẽ là rất nhiều methan bị giữ lại dưới dạng này ở đáy biển. Sự giải phóng đột ngột của một thể tích lớn methan từ những nơi đó vào khí quyển là một giả thuyết về nguyên nhân dẫn tới những hiện tượng Trái Đất nóng lên trong quá khứ xa, đỉnh cao là khoảng 55 triệu năm trước.
Một tổ chức đã ước tính trữ lượng quặng methan hydrat dưới đáy đại dương vào khoảng 10 triệu triệu tấn (10 exagram). Giả thuyết rằng nếu Trái Đất nóng lên đến một nhiệt độ nhất định, toàn bộ lượng methan này có thể một lần nữa bị giải phóng đột ngột vào khí quyển, khuếch đại hiệu ứng nhà kính lên nhiều lần và làm Trái Đất nóng lên đến mức chưa từng thấy.
Methan bên ngoài Trái Đất[sửa | sửa mã nguồn]
Methan đã được phát hiện hoặc tin là tồn tại ở vài nơi trong Hệ Mặt Trời. Người ta cho rằng nó được tạo ra nhờ những quá trình phản ứng vô sinh.
- Sao Mộc
- Sao Hoả [21]
- Sao Thổ
- Sao Hải Vương
- Sao Thiên Vương
- Sao chổi Halley
- Sao chổi Hyakutake
- 2003 UB313
Dấu vết của khí methan cũng được tìm thấy ở bầu khí quyển mỏng trên Mặt Trăng của Trái Đất. Methan cũng được dò thấy ở các đám mây giữa những vì sao trong vũ trụ.
Tham khảo[sửa | sửa mã nguồn]
- ^ Lỗi chú thích: Thẻ
<ref>sai; không có nội dung trong thẻ ref có têniupac2013 - ^ “Gas Encychlorpedia”. Truy cập ngày 7 tháng 11 năm 2013.[liên kết hỏng]
- ^ a b c Haynes, p. 3.344
- ^ Haynes, p. 5.156
- ^ Haynes, p. 3.578
- ^ NOAA Office of Response and Restoration, US GOV. “METHANE”. noaa.gov.
- ^ Khalil, M. A. K. (1999). “Non-Co2 Greenhouse Gases in the Atmosphere”. Annual Review of Energy and the Environment. 24: 645–661. doi:10.1146/annurev.energy.24.1.645.
- ^ “Technical summary”. Climate Change 2001. United Nations Environment Programme. Bản gốc lưu trữ ngày 4 tháng 6 năm 2011.
- ^ Etiope, Giuseppe; Lollar, Barbara Sherwood (2013). “Abiotic Methane on Earth”. Reviews of Geophysics (bằng tiếng Anh). 51 (2): 276–299. Bibcode:2013RvGeo..51..276E. doi:10.1002/rog.20011. ISSN 1944-9208.
- ^ Hensher, David A. & Button, Kenneth J. (2003). Handbook of transport and the environment. Emerald Group Publishing. tr. 168. ISBN 978-0-08-044103-0.
- ^ Methane Phase change data. NIST Chemistry Webbook.
- ^ Bini, R.; Pratesi, G. (1997). “High-pressure infrared study of solid methane: Phase diagram up to 30 GPa”. Physical Review B. 55 (22): 14800–14809. Bibcode:1997PhRvB..5514800B. doi:10.1103/physrevb.55.14800.
- ^ Wendelin Himmelheber. “Crystal structures”. Truy cập ngày 10 tháng 12 năm 2019.
- ^ George A. Olah, Alain Goeppert, G. K. Surya Prakash (2009). Beyond Oil and Gas: The Methanol Economy. John Wiley & Sons. Page 268.
- ^ George A. Olah, G. K. Surya Prakash, Robert E. Williams, Kenneth Wade & Unknown. Hypercarbon Chemistry. Publisher: Wiley; 2 edition (ngày 9 tháng 8 năm 2011). Page: 593 & 594.
- ^ Sản xuất điện từ rác thải Lưu trữ 2013-12-28 tại Wayback Machine, Trung tâm Thông tin Khoa học Công nghệ Quốc gia.
- ^ NON-CO2 GREENHOUSE GASES IN THE ATMOSPHERE, Annual Review of Energy and the Environment, Vol. 24: 645-661 (Volume publication date November 1999, DOI: 10.1146/annurev.energy.24.1.645
- ^ Carbon Dioxide, Methane Rise Sharply in 2007 Lưu trữ 2011-08-11 tại Wayback Machine. Noaanews.noaa.gov (2008-04-23). Truy cập 2012-05-24.
- ^ Drysdale, Dougal (2008). “Physics and Chemistry of Fire”. Trong Cote (biên tập). Fire Protection Handbook. 1 (ấn bản 20). Quincy, MA: National Fire Protection Association. tr. 2–18. ISBN 978-0-87765-758-3.
|editor2-first=thiếu|editor2-last=(trợ giúp) - ^ Lưu giữ khí dạng nước khô Lưu trữ 2013-12-28 tại Wayback Machine, Trung tâm Thông tin Khoa học Công nghệ Quốc gia.
- ^ Khí mê-tan trên sao Hỏa không có nguồn gốc từ núi lửa Lưu trữ 2013-12-28 tại Wayback Machine, Siêu Nhiên.
Liên kết ngoài[sửa | sửa mã nguồn]
| Tra methane trong từ điển mở tiếng Việt Wiktionary |
- Methan at The Periodic Table of Videos (University of Nottingham)
- Gavin Schmidt, Methan: A Scientific Journey from Obscurity to Climate Super-Stardom Lưu trữ 2004-09-10 tại Wayback Machine, NASA Goddard, September 2004
- Methan thermodynamics
- International Chemical Safety Card 0291
- Methan Hydrates
- Safety data for methan Lưu trữ 2007-10-11 tại Wayback Machine
- Catalytic conversion of methan to more useful chemicals and fuels
- CDC – Handbook for Methan Control in Mining




![{\displaystyle {\ce {CH4 + O2 ->[200atm, 300oC] HCHO + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d2d16e3035e8f6cd66e09a6c19e2b5a43ae631ca)
![{\displaystyle {\ce {2CH4 + O2 ->[500oC,Ni]2CO + 4H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0cfa3c575f34a34bc1a30355fef30d31429451c6)


![{\displaystyle {\ce {CH3COONa + NaOH ->[to] CH4 + Na2CO3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/84e9220c04e20f008b9c5ef57ea98525f728bd60)
![{\displaystyle {\ce {C + 2H2 ->[Ni] CH4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d688ec203ae4435d36fe00da2b1406997d8828a8)
![{\displaystyle {\ce {C3H8 ->[cracking] CH4 + C2H4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b33eb7b57ccba6e353c2b24090dd95307a920e4a)
