Khác biệt giữa bản sửa đổi của “Phân lớp (vỏ nguyên tử)”
Nội dung được xóa Nội dung được thêm vào
hehe Thẻ: Đã bị lùi lại Xóa chú thích Soạn thảo trực quan |
|||
| Dòng 1: | Dòng 1: | ||
[[Tập tin:Periodic table blocks spdf (32 column).svg|400px|right|thumb|alt=Blocks in the periodic table]] |
[[Tập tin:Periodic table blocks spdf (32 column).svg|400px|right|thumb|alt=Blocks in the periodic table]] |
||
'''Phân lớp electron''' trong [[bảng tuần hoàn]] |
'''Phân lớp electron''' trong [[bảng tuần hoàn]] cáco tính chất của orbitan của nó. Do đó, các phân lớp bao gồm: |
||
* phân lớp '''S''' |
* phân lớp '''S''' |
||
Phiên bản lúc 15:06, ngày 9 tháng 9 năm 2021
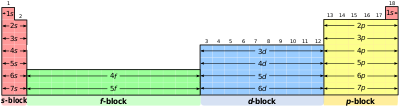
Phân lớp electron trong bảng tuần hoàn cáco tính chất của orbitan của nó. Do đó, các phân lớp bao gồm:
- phân lớp S
- phân lớp P
- phân lớp D
- phân lớp F
- phân lớp G (giả thiết)
- phân lớp H (giả thiết)
- phân lớp I (giả thiết)
Tên phân lớp (s, p, d, f, g, h, và i) xuất phát từ ký hiệu quang phổ của obitan nguyên tử tương ứng: sharp, principal, diffuse và fundamental, và cuối cùng g,h,i theo sau ký hiệu f trong bảng chữ cái.
Tham khảo
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
