Threonin
| Threonine | |
|---|---|
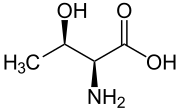 Skeletal formula | |
 Ball-and-stick model | |
| Danh pháp IUPAC | Threonine |
| Tên khác | Axit 2-amino-3-hydroxybutanoic |
| UNII | 2ZD004190S |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số EINECS | |
| DrugBank | DB00156 |
| ChEBI | |
| ChEMBL | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| Thuộc tính | |
| Điểm nóng chảy | |
| Điểm sôi | |
| Độ hòa tan trong nước | (H2O, g/dl) 10.6(30°),14.1(52°),19.0(61°) |
| Độ axit (pKa) | 2.63 (carboxyl), 10.43 (amino)[1] |
| Các nguy hiểm | |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Threonin (viết tắt là Thr hoặc T)[2] là một α-amino acid với công thức hóa học HO2CCH(NH2)CH(OH)CH3. Các codon của nó là ACU, ACA, ACC, và ACG. Threonin là một amino acid thiết yếu có phân cực. Giống như serin, threonin là một trong hai amino acid sinh protein mang một nhóm alcohol (tyrosin không phải là một alcohol mà là một phenol do nhóm hydroxyl của nó gắn trực tiếp vào vòng thơm, làm cho nó có tính oxy hóa và tính axit-base khác hẳn). Nó cũng là một trong hai amino acid thiết yếu mang nhánh bên đối xứng (giống với isoleucin).
Vị trí của các amino acid threonin trong một phân tử protein thường là nơi diễn ra các sửa đổi sau dịch mã. Tại nhánh bên hydroxyl có thể xảy ra phản ứng glycosyl hóa. Ngoài ra, threonin có thể bị phosphoryl hóa nhờ một threonin kinase. Dạng phosphoryl hóa của nó còn được gọi là phosphothreonin.
Lịch sử[sửa | sửa mã nguồn]
Ttrong 20 loại amino acid sinh protein, threonin là amino acid được phát hiện cuối cùng bởi William Cumming Rose. amino acid này được đặt tên là Threonine vì nó tương tự như trong cấu trúc để Threose (C4H8O4)[3]
Đồng phân lập thể[sửa | sửa mã nguồn]
  |
| L-Threonin (2S,3R) và D-Threonin (2R,3S) |
  |
| L-allo-Threonin (2S,3S) và D-allo-Threonin (2R,3R) |
Threonin là một trong hai trên hai mươi amino acid sinh protein có hai tâm đối xứng. Threonin có thể tồn tại dưới bốn dạng đồng phân lập thể với các cấu hình sau: (2S,3R), (2R,3S), (2S,3S) và (2R,3R).L-Threonin được dùng để chỉ đồng phân không đối quang, axit (2S,3R)-2-amino-3-hydroxybutanoic. Đồng phân lập thể thứ hai (2S,3S) hiếm khi có mặt trong tự nhiên, được gọi là L-allo-threonin. Hai đồng phân lập thể axit (2R,3S)- và (2R,3R)-2-amino-3-hydroxybutanoic có vai trò không đáng kể. [cần dẫn nguồn]
Sinh tổng hợp[sửa | sửa mã nguồn]
Do là một amino acid thiết yếu, threonin không được tổng hợp trong cơ thể, do đó phải lấy từ thức ăn chưa threonin. Trong các loài thực vật và vi sinh vật, threonin được tổng hợp từ axit aspartic, qua α-aspartyl-semialdehyde và homoserin. Homoserin trải qua sự O-phosphoryl hóa tạo thành một este phosphat, phản ứng thủy phân xảy ra ngay sau đó cùng với sự dịch chuyển nhóm OH.[4] Các enzym tham gia vào quá trình sinh tổng hợp threonin gồm:
- Aspartokinase
- ß-Aspartat semialdehyde dehydrogenase
- Homoserin dehydrogenase
- Homoserin kinase
- Threonin synthase.

Chuyển hóa[sửa | sửa mã nguồn]
Threonin được chuyển hóa qua hai con đường:
- Chuyển hóa thành pyruvat nhờ threonin dehydrogenase. Một chất trung gian trong chuyển hóa này bị lưu huỳnh phân với CoA để tạo ra acetyl-CoA và glycin.
- Ở người, threonin được chuyển hóa theo con đường ít phổ biến hơn nhờ enzym serin dehydratase để trở thành α-cetobutyrat và sau đó đi vào con đường chuyển hóa thành succinyl-CoA.
Nguồn thức ăn[sửa | sửa mã nguồn]
Các loại thức ăn giàu threonin gồm có pho mát, thịt gia cầm, cá, thịt, đậu lăng, hạt mè...
Điều chế[sửa | sửa mã nguồn]
Hỗn hợp racemic của threonin có thể được điều chế từ axit crotonic và thủy ngân(II) acetat.[5]
Tham khảo[sửa | sửa mã nguồn]
- ^ Dawson, R.M.C., et al., Data for Biochemical Research, Oxford, Clarendon Press, 1959.
- ^ Bản mẫu:IUPAC-IUB amino acids 1983.
- ^ Meyer, Curtis (ngày 20 tháng 7 năm 1936). "The Spatial Configuation of Alpha-Amino-Beta-Hydroxy-n-Butyric Acid" (PDF). Journal of Biological Chemistry 115 (3).
- ^ Bản mẫu:Lehninger3rd.
- ^ Carter, Herbert E.; West, Harold D. (1940). “dl-Threonine”. Organic Syntheses. 20: 101.; Collective Volume, 3, tr. 813.

