Lubiprostone
 | |
| Dữ liệu lâm sàng | |
|---|---|
| Tên thương mại | Amitiza |
| Đồng nghĩa | Amitiza RU-0211 SPI-0211 |
| AHFS/Drugs.com | Chuyên khảo |
| MedlinePlus | a607034 |
| Giấy phép |
|
| Danh mục cho thai kỳ |
|
| Dược đồ sử dụng | Oral |
| Mã ATC | |
| Tình trạng pháp lý | |
| Tình trạng pháp lý |
|
| Dữ liệu dược động học | |
| Sinh khả dụng | Negligible |
| Liên kết protein huyết tương | 94% |
| Chuyển hóa dược phẩm | Extensive, CYP not involved |
| Chu kỳ bán rã sinh học | Unknown (lubiprostone) 0.9–1.4 hours (main metabolite) |
| Bài tiết | Thận (60%) and fecal (30%) |
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| Định danh thành phần duy nhất | |
| KEGG | |
| ChEMBL | |
| ECHA InfoCard | 100.107.168 |
| Dữ liệu hóa lý | |
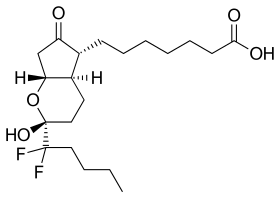
| Công thức hóa học | C20H32F2O5 |
| Khối lượng phân tử | 390.462 g/mol |
| Mẫu 3D (Jmol) | |
SMILES
| |
Định danh hóa học quốc tế
| |
| (kiểm chứng) | |
Lubiprostone (rINN, được sử dịng dưới tên thương mại Amitiza với các tên khác) là một loại thuốc được sử dụng để điều trị táo bón vô căn mãn tính, chủ yếu là hội chứng ruột kích thích - táo bón liên quan đến phụ nữ và táo bón do opioid.
Nó ban đầu được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt vào năm 2006 và được Viện Y tế Quốc gia về Chăm sóc Sức khỏe và Chăm sóc (NICE) phê duyệt sử dụng ở Anh vào năm 2014.[1] Nó đắt như năm 2017, với chi phí cho NHS là 29,68 bảng mỗi 24 gói mg 28 nắp kể từ tháng 4 năm 2017.
Sử dụng trong y tế[sửa | sửa mã nguồn]
Lubiprostone được sử dụng để điều trị táo bón mạn tính không rõ nguyên nhân ở người lớn, cũng như hội chứng ruột kích thích liên quan đến táo bón ở phụ nữ.[2]
Lubiprostone được phê duyệt để điều trị táo bón vô căn mãn tính (CIC) ở người lớn.
Lubiprostone cũng được phê duyệt để điều trị táo bón do opioid, ở người lớn bị đau không ung thư mãn tính. Hiệu quả của Lubiprostone chưa được thiết lập ở những bệnh nhân đang sử dụng diphenylheptane opioid (ví dụ, methadone).
Lubiprostone được phê duyệt để điều trị hội chứng ruột kích thích với táo bón (IBS-C) ở phụ nữ từ 18 tuổi trở lên.
Kể từ ngày 12 tháng 11 năm 2014, Lubiprostone chưa được nghiên cứu ở trẻ em. Có nghiên cứu hiện tại đang tiến hành để xác định sự an toàn và hiệu quả trong rối loạn chức năng ruột sau phẫu thuật.
Tác dụng phụ[sửa | sửa mã nguồn]
Trong các thử nghiệm lâm sàng, tác dụng phụ phổ biến nhất là buồn nôn (31%). Các tác dụng phụ khác (≥5% bệnh nhân) bao gồm tiêu chảy (13%), đau đầu (13%), trướng bụng (5%), đau bụng (5%), đầy hơi (6%), viêm xoang (5%) nôn (5%) 5%) và đại tiện không tự chủ (1%).
Chống chỉ định[sửa | sửa mã nguồn]
Không có dữ liệu hiện tại về việc sử dụng ở những người bị biến chứng gan hoặc thận. Những ảnh hưởng đối với thai kỳ chưa được nghiên cứu ở người nhưng thử nghiệm ở lợn Guinea dẫn đến mất thai. Amitiza không được chấp thuận cho sử dụng ở trẻ em. Lubiprostone chống chỉ định ở những bệnh nhân có biểu hiện tiêu chảy mãn tính, tắc ruột hoặc hội chứng ruột kích thích tiêu chảy chiếm ưu thế.
Cơ chế hoạt động[sửa | sửa mã nguồn]
Lubiprostone là một axit béo bicyclic có nguồn gốc từ tuyến tiền liệt E1 hoạt động bằng cách kích hoạt đặc biệt các kênh chloride ClC-2 trên khía cạnh đỉnh của các tế bào biểu mô đường tiêu hóa, tạo ra dịch tiết giàu chloride. Những chất tiết này làm mềm phân, tăng nhu động và thúc đẩy nhu động ruột tự phát (SBM).
Các triệu chứng táo bón như đau và đầy hơi thường được cải thiện trong vòng một tuần và SBM có thể xảy ra trong vòng một ngày.
Dược động học[sửa | sửa mã nguồn]
Không giống như nhiều sản phẩm nhuận tràng, mỡ bôi trơn không có dấu hiệu dung nạp, phụ thuộc hoặc thay đổi nồng độ chất điện giải trong huyết thanh. Không có tác dụng hồi phục sau khi ngừng điều trị, nhưng nên quay lại dần dần tần suất đi tiêu trước điều trị.
Phân phối tối thiểu của thuốc xảy ra ngoài các mô đường tiêu hóa ngay lập tức. Lubiprostone được chuyển hóa nhanh chóng bằng cách khử/oxy hóa, qua trung gian là carbonyl reductase. Không có sự tham gia trao đổi chất của hệ thống cytochrom P450 ở gan. Chất chuyển hóa có thể đo được, M3, tồn tại ở mức rất thấp trong huyết tương và chiếm chưa đến 10% tổng liều dùng.
Dữ liệu chỉ ra rằng sự trao đổi chất xảy ra cục bộ trong dạ dày và hỗng tràng.
Xã hội và văn hoá[sửa | sửa mã nguồn]
Tình trạng pháp lý[sửa | sửa mã nguồn]
Lubiprostone đã nhận được sự chấp thuận của Cục Quản lý Thực phẩm và Dược phẩm năm 2008 để điều trị hội chứng ruột kích thích với táo bón (IBS-C) và chỉ có sẵn thông qua đơn thuốc. Tính đến năm 2014[cập nhật], thuốc có sẵn ở Hoa Kỳ, Nhật Bản, Thụy Sĩ, Ấn Độ và Vương quốc Anh; đánh giá của Bộ Y tế Canada bắt đầu vào cuối năm 2014.[3]
Tên thương hiệu[sửa | sửa mã nguồn]
Tại Bangladesh và Ấn Độ, Lubiprostone được bán trên thị trường dưới tên thương mại Lubilax bởi Beacon Cosmetics Limited và dưới tên thương mại Lubowel của SunPharma.
Tham khảo[sửa | sửa mã nguồn]
- ^ “Lubiprostone for treating chronic idiopathic constipation - Technology appraisal guidance [TA318]”. NICE. ngày 23 tháng 7 năm 2014. Truy cập ngày 13 tháng 4 năm 2017.[liên kết hỏng]
- ^ “Amitiza”. The American Society of Health-System Pharmacists. Truy cập ngày 3 tháng 4 năm 2011.
- ^ House, Douglas W. (ngày 31 tháng 12 năm 2014). “Canada accepts Sucampo's NDS for constipation med”. Seeking Alpha.
Liên kết ngoài[sửa | sửa mã nguồn]
| Acid và base |
|---|
| Các dạng acid |
| Các dạng base |
