Thành viên:Mongrangvebet/Phi kim
Trong hóa học, phi kim là một nguyên tố hóa học mà tính kim loại của những nguyên tố này không chiếm ưu thế. Ở điều kiện tiêu chuẩn (298K và 1 bar), trạng thái vật chất của phi kim đa dạng, từ khí không màu (như hydro) đến chất rắn ánh kim có nhiệt độ nóng chảy cao (như bor). Các electron trong phi kim hoạt động khác với các electron trong kim loại. Trừ một số ngoại lệ, thông thường electron các phi kim được cố định tại chỗ, do đó tính dẫn nhiệt và dẫn điện kém và phi kim ở trạng thái rắn thường giòn hoặc vỡ vụn. Còn electron trong kim loại nói chung chuyển động tự do và đây là lý do vì sao mà kim loại là chất dẫn điện tốt và hầu hết dễ dàng có thểkéo sợi. Các nguyên tử phi kim có độ âm điện từ trung bình đến cao; chúng có xu hướng nhận electron trong các phản ứng hóa học và tạo thành các hợp chất có tính acid .
Hai phi kim, hydro và heli, chiếm khoảng 99% vật chất thông thường trong vũ trụ quan sát được (tính theo khối lượng). Vỏ Trái Đất, khí quyển Trái Đất, đại dương và sinh quyển được cấu tạo phần lớn từ năm nguyên tố phi kim gồm hydro, carbon, nitơ, oxy và silic.
Hầu hết các phi kim có vai trò trong sinh học, công nghệ hoặc ngành nông nghiệp. Các sinh vật sống được cấu tạo gần như hoàn toàn từ các phi kim hydro, oxy, carbon và nitơ. Gần như tất cả các phi kim đều có những ứng dụng riêng trong y học và dược phẩm; laser và ánh sáng; đồ gia dụng trong gia đình.
Thuật ngữ phi kim loại (non-metallic) có từ ít nhất là năm 1566, cho đến nay chưa có định nghĩa chính xác nào được thống nhất rộng rãi về phi kim. Một số nguyên tố có sự pha trộn rõ rệt của tính chất kim loại và phi kim; các nguyên tố nằm giữa ranh giới phi kim-kim loại có thể xếp vào các nhóm khác nhau tùy thuộc vào tiêu chí phân loại. Có 14 nguyên tố luôn được công nhận là phi kim và có 9 nguyên tố nữa có thể xếp vào phi kim hay kim loại tùy thuộc vào tiêu chí xếp loại của bảng tuần hoàn.
Định nghĩa[sửa | sửa mã nguồn]
Phi kim là một nguyên tố hóa học có khối lượng riêng tương đối thấp và độ âm điện từ trung bình đến cao. Nhìn chung, các nguyên tố này không có hoặc ít tính chất của một kim loại hơn như ánh kim, khả năng uốn dẻo kéo sợi, dẫn nhiệt và điện tốt, và độ âm điện thấp. [1] Vì không có định nghĩa chặt chẽ về phi kim[2][3][4] nên có thể gặp nhiều biến thể phân loại các nguyên tố là phi kim hay kim loại, phụ thuộc vào tính chất của nguyên tố và quan điểm tính chất đó được coi là biểu hiện của tính chất phi kim hoặc kim loại.[5]
Năm 2020, mặc dù Steudel[6] đã công nhận 23 nguyên tố là phi kim, nhưng vẫn còn nhiều quan điểm gây tranh cãi. 14 chất được chấp nhận một cách rộng rãi gồm hydro, oxy, nitơ, lưu huỳnh; các halogen như fluor, chlor, brom và iod; khí hiếm như heli, neon, argon, krypton, xenon và radon; (Larrañaga và cộng sự). Các tác giả này công nhận carbon, phosphor và seleni là phi kim, tuy nhiên Vernon [7] trước đó cho rằng ba nguyên tố này được tính là nguyên tố á kim. Các nguyên tố thường được công nhận là á kim gồm bor ; silic; germani ; arsen; antimon và teluri do các tiêu chí được sử dụng để phân biệt giữa kim loại và phi kim không đủ để đưa đi đến kết luận. Dưới góc nhìn theo tính chất hóa học, các nguyên tố á kim nêu trên được xếp vào nguyên tố phi kim.
Trong số 118 nguyên tố đã biết,[8] chỉ có 23 nguyên tố có thể được coi là phi kim. [9] Astatin, halogen thứ năm, thường bị bỏ qua do tính hiếm và tính phóng xạ mạnh; [10] Bằng chứng lý thuyết gián tiếp và bằng chứng thực nghiệm cho thấy astatin là một kim loại. [11] Các nguyên tố siêu nặng như copernici ( Z = 112) và oganesson (118) có thể là phi kim; nhưng quan điểm này chưa được xác nhận. [12]
Tính chất chung[sửa | sửa mã nguồn]
Tính chất vật lý[sửa | sửa mã nguồn]
Khoảng một nửa số nguyên tố phi kim là khí có màu hoặc không màu; phần còn lại phần lớn là chất rắn có tính ánh kim. Brom là chất lỏng duy nhất dễ bay hơi đến nỗi khi đựng brom thì thường thấy lớp khói của nó bao phủ xung quanh. Lưu huỳnh là phi kim rắn có màu duy nhất. Các phi kim lỏng có tỷ trọng, nhiệt độ nóng chảy và nhiệt độ sôi rất thấp, và là chất dẫn nhiệt và dẫn điện kém. [13] Các nguyên tố phi kim rắn có khối lượng riêng thấp, giòn hoặc dễ gãy, vỡ vụn với độ bền cơ học và cấu trúc thấp.[14] Có thể dẫn điện kém, có thể dẫn điện tốt, tùy vào từng nguyên tố.
Cấu trúc đa dạng và sự sắp xếp liên kết của các phi kim giải thích sự khác biệt về trạng thái vật chất. Những nguyên tử tồn tại dưới dạng nguyên tử rời rạc (ví dụ: xenon) hoặc phân tử (ví dụ: oxy, lưu huỳnh, brom) có xu hướng có nhiệt độ nóng chảy và nhiệt độ sôi thấp khi chúng được giữ với nhau bởi lực phân tán London (London dispersion forces, [15]) . Đây là lực tương tác yếu các nguyên tử hoặc phân tử của chúng,[16] do vậy ở nhiệt độ phòng là chất khí. Các phi kim tạo thành cấu trúc khổng lồ, chẳng hạn như chuỗi có tới 1.000 nguyên tử (ví dụ: selen), [17] dạng lớp (ví dụ: carbon) hoặc mạng lưới ba chiều (ví dụ: silic), có điểm nóng chảy và sôi cao hơn, vì cần nhiều năng lượng hơn để phá vỡ liên kết cộng hóa trị; do vậy ở nhiệt độ phòng chúng đều là chất rắn. Những nguyên ở gần bên trái của bảng tuần hoàn, hoặc xa hơn một cột, thường có một số tương tác á kim yếu giữa các phân tử hay các nguyên tử của nhau, phù hợp với tính chất vừa kim loại, vừa phi kim của chúng; gồm bor, [18] carbon, [19] phosphor, [20] arsen, [21] seleni, [22] antimon, [23] teluri, [24] và iod. [25]
Tính dẫn điện, dẫn nhiệt và tính dẻo của phi kim rắn cũng liên quan đến sự sắp xếp bên trong. Trong khi độ dẫn điện tốt và tính dẻo (tính dễ uốn, tính dẻo) thường liên quan đến sự hiện diện của các electron chuyển động tự do và phân bố đồng đều trong kim loại [26] thì các electron trong phi kim thường thiếu tính linh động như vậy. [27] Các nguyên tố phi kim dẫn điện và dẫn nhiệt tốt chỉ có ở carbon, arsenic và antimon. Mặt khác, tính dẫn nhiệt tốt chỉ có ở các nguyên tố bor, silic, phosphor và germani, dựa trên độ dao động của tinh thể. [28] Độ dẫn điện trung bình có ở nguyên tố bor, silic, phosphor, germani, seleni, teluri và iod. Tính dẻo có ở carbon, phospho, lưu huỳnh, seleni và á kim.
Sự khác biệt về tính chất vật lý giữa kim loại và phi kim là do từ các lực nguyên tử bên trong và bên ngoài. Bên trong, điện tích dương có nguồn gốc từ proton trong hạt nhân nguyên tử có tác dụng giữ các electron của vỏ nguyên tử tại chỗ. Bên ngoài, các electron chịu lực hấp dẫn từ proton trong các nguyên tử lân cận. Khi ngoại lực lớn hơn hoặc bằng nội lực, các electron bên ngoài được cho là sẽ chuyển động tự do giữa các nguyên tử và mang đặc tính của kim loại, nếu không xảy ra điều này thì nguyên tố mang đặc tính của phi kim. [29]
Tính chất hóa học[sửa | sửa mã nguồn]
| Khía cạnh so sánh | Kim loại | Phi kim |
|---|---|---|
| Độ âm điện | Thấp hơn phi kim với một số ngoại lệ [31] | Trung bình đến rất cao |
| Liên kết hóa học | ||
| liên kết cộng hóa trị (ít gặp) | thường gặp liên kết cộng hóa trị | |
| Liên kết kim loại (hợp kim) giữa các nguyên tử kim loại | Liên kết cộng hóa trị giữa các nguyên tử phi kim | |
| Liên kết ion giữa phi kim và kim loại | ||
| Trạng thái oxy hóa | số oxy hóa dương | số oxy hóa âm hoặc dương |
| Oxide | Base và acid | acid, không có base.[32] |
| Dung dịch (nước) [33] | Tồn tại dưới dạng cation | Tồn tại dưới dạng anion hoặc oxyanion |
Các phi kim có giá trị độ âm điện từ trung bình đến cao [34] và, trong các phản ứng hóa học, có xu hướng tạo thành các hợp chất có tính acid. Ví dụ, các phi kim rắn (bao gồm cả các kim loại) phản ứng với acid nitric để tạo thành một acid hoặc một oxide có tính acid hoặc có tính acid chiếm ưu thế.
Chúng có xu hướng nhận hoặc chia sẻ electron khi chúng phản ứng, không giống như kim loại có xu hướng tặng electron. Cụ thể hơn, với sự ổn định của cấu hình electron của các khí hiếm (có lớp vỏ bên ngoài), các phi kim nói chung thu được một số electron đủ để tạo cho chúng cấu hình electron của khí hiếm sau trong khi các kim loại có xu hướng mất các electron đủ để rời chúng với cấu hình electron của khí hiếm trước. Đối với các nguyên tố phi kim xu hướng này được tóm tắt trong quy tắc nhị tử và bát tử (và đối với kim loại thì quy tắc 18 electron ít được tuân thủ chặt chẽ hơn). [35]
Về mặt định lượng, các phi kim hầu hết có năng lượng ion hóa, ái lực electron, giá trị độ âm điện và thế khử chuẩn hơn kim loại. Nói chung, các giá trị này càng cao thì nguyên tố đó càng có nhiều đặc tính của phi kim. [36]
Sự khác biệt hóa học giữa kim loại và phi kim phần lớn phát sinh từ lực hấp dẫn giữa điện tích hạt nhân dương của một nguyên tử riêng lẻ và các electron bên ngoài mang điện tích âm của nó. Từ trái sang phải qua mỗi chu kỳ của bảng tuần hoàn, điện tích hạt nhân tăng khi số proton trong hạt nhân nguyên tử tăng lên. [37] Bán kính nguyên tử giảm đi kèm theo [38] khi điện tích hạt nhân tăng lên kéo các electron bên ngoài lại gần lõi hơn. [39] Trong kim loại, ảnh hưởng của điện tích hạt nhân nói chung yếu hơn so với phi kim. Trong liên kết hóa học, các kim loại có xu hướng mất electron và hình thành các nguyên tử hoặc ion mang điện tích dương hoặc phân cực trong khi các phi kim có xu hướng giành được cùng các electron đó do điện tích hạt nhân mạnh hơn và hình thành các ion mang điện tích âm hoặc nguyên tử phân cực. [40]
Số lượng các hợp chất được tạo thành bởi phi kim là rất lớn. [41] Mười vị trí đầu tiên trong bảng "top 20" các nguyên tố thường gặp nhất trong 895.501.834 hợp chất, như được liệt kê trong sổ đăng ký Dịch vụ Tóm tắt Hóa học vào ngày 2 tháng 11 năm 2021, đã bị chiếm bởi các phi kim. Hyđrô, carbon, oxy và nitơ được tìm thấy chung trong phần lớn (80%) các hợp chất. Silic, một loại kim loại, đứng ở vị trí thứ 11. Kim loại được xếp hạng cao nhất, với tần suất xuất hiện 0,14%, là sắt, ở vị trí thứ 12. [42] Một vài ví dụ về các hợp chất phi kim là: acid boric ( H
3BO
3), được sử dụng trong men gốm ; selenocysteine ( C
3H
7NO
2Se), acid amin thứ 21 của sự sống; [43] phosphor sesquisulfide (P4S3) có trong diêm ; và teflon ((C
2F
4)n), [44] được sử dụng trong lớp phủ chống dính cho chảo và các dụng cụ nấu nướng khác.
Các biến thể[sửa | sửa mã nguồn]
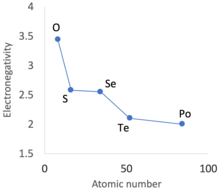
Tính chất hóa học phức tạp của phi kim là những dị thường được nhìn thấy ở hàng đầu tiên của mỗi khối trong bảng tuần hoàn . Những dị thường này nổi bật ở hydro, bo (cho dù là phi kim hay kim loại), carbon, nitơ, oxy và fluor. Ở các hàng sau, chúng biểu hiện dưới dạng chu kỳ thứ cấp hoặc xu hướng tuần hoàn không đồng nhất đi xuống hầu hết các nhóm khối p, [45] và trạng thái oxy hóa bất thường trong các phi kim nặng hơn.
Chu kỳ 1[sửa | sửa mã nguồn]
Chu kỳ 1 có nhiều khác biệt với các chu kỳ còn lại là do cấu hình electron của các nguyên tố. Hydro thường hình thành liên kết cộng hóa trị. Dung dịch có dung môi là nước, nguyên tử hydro mất electron độc thân để tồn tại dưới dạng ion hydro, để lại một proton trần có tính phân cực lớn.[46] Do đó, ion hydro này tự gắn vào cặp electron không liên kết của nguyên tử oxy trong phân tử nước, hình thành nên tính chất của acid và base. [47] Nguyên tử hydro trong phân tử có thể tạo liên kết hydro (một loại liên kết yếu), với nguyên tử hoặc nhóm nguyên tử trong phân tử khác. Sự liên kết như vậy "định hình tính đối xứng lục giác của bông tuyết , hình thành chuỗi xoắn kép của DNA; quy định cấu trúc 3 chiều của protein; và thậm chí còn làm tăng nhiệt độ sôi của nước lên đủ cao để pha một tách trà ngon".[48]
Hydro, heli, và các nguyên tử từ bor đến neon trong bảng tuần hoàn có bán kính nguyên tử nhỏ bất thường. Nguyên nhân là do các phân lớp electron 1s và 2p không có phân lớp 0s và 1p và do đó chúng không chịu lực đẩy electron, không giống như các phân lớp 3p, 4p và 5p của các nguyên tố nặng hơn. [49] Hậu quả, năng lượng ion hóa và độ âm điện của nguyên tố này cao bất thường. Bán kính nguyên tử của carbon, nitơ và oxy tạo điều kiện thuận lợi cho việc hình thành liên kết đôi hoặc liên kết ba . [50]
Mặc dù trên cơ sở nhất quán về cấu hình electron thì vị trí của hydro và heli trong bảng tuần hoàn sẽ nằm trên vị trí của nguyên tố s. Đôi khi vị trí hydro ở trên trên flour, ở nhóm 17 (nhóm VIIA) hơn là trên lithi ở nhóm 1 (nhóm IA). vị trí của nguyên tố heli thường ở trên neon ở nhóm 18 (nhóm VIIIA), thay vì trên beryl ở nhóm 2 (nhóm IIA).[51]
Chu kỳ 2[sửa | sửa mã nguồn]
Ngay sau hàng thứ nhất của các kim loại khối d, scandium đến kẽm, các electron 3d trong các nguyên tố khối p tức là gali (một kim loại), germani, arsenic, seleni và brom, không hiệu quả trong việc che chắn tính dương tăng lên. điện tích hạt nhân. Một hiệu ứng tương tự đi kèm với sự xuất hiện của mười bốn kim loại khối f giữa bari và luteti, cuối cùng dẫn đến bán kính nguyên tử nhỏ hơn dự kiến cho các nguyên tố từ hafni (Hf) trở đi. [52] Kết quả ròng, đặc biệt là đối với các nguyên tố nhóm 13–15, là có sự thay đổi trong một số xu hướng tuần hoàn đi xuống các nhóm từ 13 đến 17. [53]
Trạng thái oxy hóa bất thường[sửa | sửa mã nguồn]
Bán kính nguyên tử lớn hơn của phi kim nhóm 15-18 nặng hơn cho phép số lượng phối trí lớn hơn, và dẫn đến các giá trị độ âm điện thấp hơn, chịu đựng tốt hơn các điện tích dương cao hơn. Do đó, các nguyên tố liên quan có thể thể hiện trạng thái oxy hóa khác với trạng thái thấp nhất đối với nhóm của chúng (nghĩa là 3, 2, 1, hoặc 0), ví dụ trong phosphor pentachloride (PCl 5 ), lưu huỳnh hexafluoride (SF 6 ), iod heptafluoride ( IF 7 ), và xenon difluoride (XeF 2 ). [54]
Dưới lớp[sửa | sửa mã nguồn]
Các cách tiếp cận để phân loại phi kim loại có thể bao gồm từ ít nhất hai phân lớp cho đến sáu hoặc bảy. Ví dụ, bảng tuần hoàn Encyclopædia Britannica công nhận các khí hiếm, halogen và các phi kim khác, đồng thời phân chia các nguyên tố thường được công nhận là kim loại giữa "kim loại khác" và "phi kim khác". [55] Thay vào đó, bảng tuần hoàn của Hiệp hội Hóa học Hoàng gia sử dụng một màu khác cho mỗi nhóm trong số tám nhóm chính của nó, và các phi kim có thể được tìm thấy trong bảy trong số này. [56]
Từ phải sang trái trong các thuật ngữ của bảng tuần hoàn, ba hoặc bốn loại phi kim thường ít nhiều được phân biệt rõ ràng. Đó là:
Vì các kim loại chiếm "lãnh thổ biên giới", [57] nơi kim loại gặp phi kim, cách xử lý của chúng khác nhau giữa các tác giả. Một số coi chúng tách biệt với cả kim loại và phi kim; một số coi chúng là phi kim [58] hoặc như một phân nhóm của phi kim. [59] Các tác giả khác coi một số trong số chúng là kim loại, ví dụ như asen và antimon, do chúng tương tự như kim loại nặng . [60] [n 17] Các kim loại ở đây được coi là phi kim theo đặc tính hóa học của chúng và cho các mục đích so sánh.
Ngoài các kim loại, một số mờ ranh giới và chồng lấn (như xảy ra với các sơ đồ phân loại nói chung) có thể được phân biệt giữa các phân lớp phi kim loại khác. Carbon, phosphor, seleni, iốt tạo thành viền các kim loại và thể hiện một số đặc tính kim loại, cũng như hydro. Trong số các khí hiếm, radon là kim loại nhất và bắt đầu thể hiện một số hành vi cation, điều này không bình thường đối với phi kim. [61]
Khí hiếm[sửa | sửa mã nguồn]

Sáu phi kim được phân loại là khí hiếm: heli, neon, argon, krypton, xenon và radon phóng xạ. Trong bảng tuần hoàn thông thường, chúng chiếm cột ngoài cùng bên phải. Chúng được gọi là khí hiếm do đặc tính phản ứng hóa học rất thấp. [62]
Chúng có các đặc tính rất giống nhau, đều là không màu, không mùi và không cháy. Với lớp vỏ electron bên ngoài khép kín của chúng, các khí hiếm có lực hút liên nguyên tử yếu dẫn đến nhiệt độ nóng chảy và điểm sôi rất thấp. [63] Đó là lý do tại sao chúng đều là chất khí ở điều kiện tiêu chuẩn, thậm chí là chất khí có khối lượng nguyên tử lớn hơn nhiều nguyên tố rắn bình thường. [64]
Về mặt hóa học, các khí hiếm này có năng lượng ion hóa tương đối cao, ái lực electron không hoặc âm, và độ âm điện tương đối cao. Các hợp chất của khí hiếm có số lượng lên đến hàng trăm mặc dù danh sách vẫn tiếp tục tăng lên, [65] với hầu hết các hợp chất này liên quan đến oxy hoặc fluor kết hợp với krypton, xenon hoặc radon. [66]
Theo thuật ngữ của bảng tuần hoàn, có thể rút ra sự tương tự giữa khí hiếm và kim loại quý như bạch kim và vàng, với loại sau tương tự không muốn tham gia vào sự kết hợp hóa học. [67] Ví dụ thêm, xenon, ở trạng thái oxy hóa +8, tạo thành một oxide nổ màu vàng nhạt, XeO <sub id="mwAh8">4</sub>, trong khi osmi, một kim loại quý khác, tạo thành một oxide có tính oxi hóa mạnh màu vàng, OsO 4 . Cũng có những điểm tương đồng trong công thức của oxyfluorid: XeO 2 F 4 và OsO 2 F 4, và XeO 3 F 2 và OsO 3 F 2 . [68]
Khoảng 10 15 tấn khí hiếm có trong bầu khí quyển của Trái đất. [69] Heli cũng được tìm thấy trong khí tự nhiên với mức lên tới 7%. [70] Radon khuếch tán ra khỏi đá, nơi nó được hình thành trong quá trình phân rã tự nhiên của uranium và thorium . [71] Vào năm 2014, người ta đã báo cáo rằng lõi Trái đất có thể chứa khoảng 10 13 tấn xenon, ở dạng các hợp chất liên kim XeFe 3 và XeNi 3 ổn định. Điều này có thể giải thích tại sao "các nghiên cứu về bầu khí quyển của Trái đất đã chỉ ra rằng hơn 90% lượng Xe dự kiến bị cạn kiệt." [72]
Các halogen phi kim[sửa | sửa mã nguồn]

2 màu tímCaF
2</br> CaF
2, một khoáng chất fluor, giữa hai phần tư
Trong khi các halogen phi kim là các nguyên tố phản ứng và ăn mòn rõ rệt, chúng có thể được tìm thấy trong các hợp chất trần tục như kem đánh răng ( NaF ); muối ăn thông thường (NaCl); chất khử trùng bể bơi ( NaBr ); hoặc thực phẩm bổ sung ( KI ). Từ "halogen" có nghĩa là " muối trước đây". [73]
Về mặt vật lý, fluor và clo là những chất khí có màu vàng nhạt và vàng lục; brom là chất lỏng màu nâu đỏ (thường được phủ lên trên bởi một lớp khói của nó); và iod, dưới ánh sáng trắng, là chất rắn nhìn như kim loại. Về mặt điện, ba chất đầu tiên là chất cách điện trong khi iốt là chất bán dẫn (dọc theo các mặt phẳng của nó). [74]
Về mặt hóa học, chúng có năng lượng ion hóa, ái lực electron và giá trị độ âm điện cao, và hầu hết là chất oxy hóa tương đối mạnh. [75] Biểu hiện của tình trạng này bao gồm tính chất ăn mòn của chúng. [76] Cả bốn đều có xu hướng tạo thành các hợp chất ion chủ yếu với kim loại [77] trong khi các phi kim còn lại, oxy thanh, có xu hướng tạo thành các hợp chất cộng hóa trị chủ yếu với kim loại. [n 18] Bản chất phản ứng và mang tính âm điện mạnh của các halogen phi kim thể hiện đặc tính thu nhỏ của phi kim. [78]
Theo thuật ngữ bảng tuần hoàn, các đồng phân của các halogen có tính phi kim cao trong nhóm 17 là các kim loại kiềm có phản ứng mạnh, chẳng hạn như natri và kali, ở nhóm 1. [79] Hầu hết các kim loại kiềm, giống như giả của các halogen phi kim, được biết là tạo thành các anion –1 (điều hiếm khi xảy ra giữa các kim loại). [80]
Các halogen của phi kim được tìm thấy trong các khoáng chất liên quan đến muối. Fluor xuất hiện trong fluorit (CaF 2 ), một khoáng chất phổ biến. Clo, brom và iod được tìm thấy trong nước muối . Đặc biệt, một nghiên cứu năm 2012 báo cáo sự hiện diện của 0,04% fluor bản địa ( F
2</br> F
2 ) tính theo trọng lượng là antozonit, cho rằng những tạp chất này là kết quả của bức xạ từ sự hiện diện của một lượng nhỏ uranium . [81]
Phi kim chưa được phân loại[sửa | sửa mã nguồn]
Sau khi các nguyên tố phi kim được phân loại là khí hiếm, halogen hoặc kim loại (sau đây), bảy phi kim còn lại là hydro, carbon, nitơ, oxy, phosphor, lưu huỳnh và seleni. Ở dạng ổn định nhất của chúng, ba là khí không màu (H, N, O); ba có dạng kim loại (C, P, Se); và một màu vàng (S). Về mặt điện, carbon graphit là một bán kim loại nằm dọc theo mặt phẳng của nó [82] và chất bán dẫn theo phương vuông góc với mặt phẳng của nó; [83] phosphor và seleni là chất bán dẫn; [84] và hydro, nitơ, oxy và lưu huỳnh là chất cách điện. [n 19]
Chúng thường được coi là quá đa dạng để có thể xứng đáng cho một cuộc kiểm tra tập thể, [85] và được gọi là các phi kim khác, [86] hoặc đơn giản hơn là phi kim, nằm giữa các kim loại và halogen. [87] Do đó, hóa học của họ có xu hướng được giảng dạy không giống nhau, theo bốn nhóm bảng tuần hoàn tương ứng, [88] ví dụ: hydro ở nhóm 1; phi kim nhóm 14 (carbon, và có thể cả silic và germani); phi kim nhóm 15 (nitơ, phosphor, và có thể cả arsenic và antimon); và phi kim nhóm 16 (oxy, lưu huỳnh, seleni, và có thể là Teluri). Có thể chia nhỏ khác theo sở thích cá nhân của tác giả. [n 20]
Đặc biệt, ở một số khía cạnh, hydro hoạt động giống như kim loại và ở một số khía cạnh khác như phi kim. [89] Giống như một kim loại, nó có thể (đầu tiên) mất đi electron độc thân của mình; [90] nó có thể thay thế kim loại kiềm trong cấu trúc kim loại kiềm điển hình; [91] và có khả năng tạo thành các hydride dạng hợp kim, có liên kết kim loại với một số kim loại chuyển tiếp . [92] Mặt khác, nó là một khí điatomic cách nhiệt, giống như một phi kim điển hình, và trong các phản ứng hóa học có xu hướng cuối cùng đạt được cấu hình electron của heli. [93] Nó thực hiện điều này bằng cách hình thành liên kết cộng hóa trị hoặc liên kết ion [92] hoặc, nếu nó bị mất electron, tự gắn vào một cặp electron duy nhất. [94]
Tuy nhiên, một số hoặc tất cả các phi kim này có một số thuộc tính chung. Hầu hết chúng, ít phản ứng hơn các halogen, [95] có thể xuất hiện tự nhiên trong môi trường. [96] Chúng có vai trò sinh học [97] [98] và địa hóa nổi bật. [85] Mặc dù đặc tính vật lý và hóa học của chúng là "phi kim loại ở mức độ vừa phải", nhưng trên cơ sở thực tế, [85] tất cả chúng đều có các khía cạnh ăn mòn. Hiđro có thể ăn mòn kim loại . Ăn mòn carbon có thể xảy ra trong pin nhiên liệu . [99] Mưa acid là do nitơ hoặc lưu huỳnh hòa tan. Oxy ăn mòn sắt qua quá trình rỉ sét . phosphor trắng, dạng không bền nhất, bốc cháy trong không khí và tạo ra dư lượng acid phosphorric . [100] seleni chưa được xử lý trong đất có thể làm phát sinh khí hydro selenua ăn mòn. [101] Khi kết hợp với kim loại, các phi kim chưa được phân loại có thể tạo thành các hợp chất có độ cứng cao ( kẽ hoặc chịu lửa ), [102] do bán kính nguyên tử tương đối nhỏ và giá trị năng lượng ion hóa đủ thấp. [85] Chúng có xu hướng liên kết với nhau, đặc biệt là trong các hợp chất rắn. [103] [85] Mối quan hệ trong bảng tuần hoàn đường chéo giữa các phi kim này lặp lại mối quan hệ tương tự giữa các kim loại. [104] [105]
Theo thuật ngữ bảng tuần hoàn, sự tương tự về mặt địa lý được thấy giữa các phi kim chưa được phân loại và các kim loại chuyển tiếp. Các phi kim chưa được phân loại chiếm lãnh thổ giữa các halogen của phi kim mạnh ở bên phải và phi kim yếu ở bên trái. Các kim loại chuyển tiếp chiếm lãnh thổ, "giữa các kim loại độc và mạnh ở bên trái bảng tuần hoàn, và các kim loại nhẹ nhàng và vừa đủ ở bên phải ... [và] ... tạo thành cầu nối chuyển tiếp giữa hai bên ”. [106]
Các phi kim chưa được phân loại thường xuất hiện ở dạng nguyên tố (oxy, lưu huỳnh) hoặc được tìm thấy cùng với một trong hai nguyên tố sau: [107]
- Hydro xuất hiện trong các đại dương trên thế giới như một thành phần của nước, và trong khí tự nhiên như một thành phần của metan và hydro sulfide . [108]
- Carbon xuất hiện trong đá vôi, đá dolomit và đá cẩm thạch, dưới dạng carbonat. [109] Ít được biết đến hơn là carbon ở dạng than chì, chủ yếu xuất hiện trong đá silicat biến chất [110] do quá trình nén và đốt nóng các hợp chất carbon trầm tích . [111]
- oxy được tìm thấy trong khí quyển; trong các đại dương như một thành phần của nước; và trong lớp vỏ như các khoáng chất oxide .
- Các khoáng chất phosphor phổ biến rộng rãi, thường là phốt phát phosphor oxy. [112]
- Lưu huỳnh nguyên tố có thể được tìm thấy trong hoặc gần các suối nước nóng và các vùng núi lửa ở nhiều nơi trên thế giới; khoáng chất lưu huỳnh phổ biến rộng rãi, thường là sulfide hoặc oxy-lưu huỳnh sulfat . [113]
- seleni xuất hiện trong quặng sulfide kim loại, nơi nó thay thế một phần lưu huỳnh; seleni nguyên tố đôi khi được tìm thấy. [114]
Metalloids[sửa | sửa mã nguồn]

Sáu nguyên tố thường được công nhận là kim loại kim loại là bo, silic, germani, arsenic, antimon và Teluri, mỗi nguyên tố đều có vẻ ngoài như kim loại. Trên một bảng tuần hoàn tiêu chuẩn, chúng chiếm một khu vực đường chéo trong khối p kéo dài từ bo ở phía trên bên trái đến teluri ở phía dưới bên phải, dọc theo đường phân chia giữa kim loại và phi kim được hiển thị trên một số bảng. [7]
Chúng giòn và kém dẫn nhiệt và dẫn điện tốt. Boron, silicon, germani và Teluri là những chất bán dẫn. Arsenic và antimon có cấu trúc electron của bán kim loại mặc dù cả hai đều có dạng bán dẫn kém ổn định hơn. [7]
Về mặt hóa học, các kim loại thường hoạt động giống như phi kim (yếu). Trong số các nguyên tố phi kim, chúng có xu hướng có năng lượng ion hóa, ái lực electron và giá trị độ âm điện thấp nhất và là chất oxi hóa tương đối yếu. Chúng chứng minh thêm xu hướng tạo hợp kim với kim loại. [7]
Theo thuật ngữ bảng tuần hoàn, bên trái của các phi kim loại yếu là một tập hợp các kim loại yếu không xác định (chẳng hạn như thiếc, chì và bismuth ) [115] đôi khi được gọi là các kim loại sau chuyển tiếp . [116] Dingle giải thích tình huống theo cách này:
- ... với kim loại 'không nghi ngờ gì' ở ngoài cùng bên trái của bảng và chắc chắn là phi kim loại ở ngoài cùng bên phải ... khoảng cách giữa hai thái cực được bắc cầu trước tiên bởi các kim loại nghèo ( sau chuyển tiếp ), và sau đó là các kim loại - mà có lẽ theo cùng một dấu hiệu, có thể được đổi tên chung là 'các phi kim loại nghèo'. [117]
Các kim loại có xu hướng được tìm thấy ở dạng kết hợp với oxy hoặc lưu huỳnh hoặc (trong trường hợp là Teluri) vàng hoặc bạc. [107] Boron được tìm thấy trong các khoáng chất borat boron-oxy, bao gồm cả trong nước suối núi lửa. Silic xuất hiện trong silic khoáng silic-oxy (cát). Germani, arsenic và antimon chủ yếu được tìm thấy như các thành phần của quặng sulfide . Teluri xuất hiện trong các khoáng chất teluride bằng vàng hoặc bạc. Các dạng tự nhiên của arsenic, antimon và teluri đã được báo cáo. [118]
Allotropes[sửa | sửa mã nguồn]
Hầu hết các nguyên tố phi kim đều tồn tại ở dạng dị hướng. Ví dụ, carbon xuất hiện dưới dạng than chì và kim cương. Các dạng thù hình như vậy có thể thể hiện các tính chất vật lý là kim loại hơn hoặc ít phi kim hơn. [119]
Trong số các halogen của phi kim, và các phi kim chưa được phân loại:
- Iốt được biết đến ở dạng vô định hình bán dẫn. [120]
- Graphit, trạng thái tiêu chuẩn của carbon, là chất dẫn điện khá tốt. Dạng kim cương của carbon rõ ràng là phi kim loại, trong mờ và là chất dẫn điện cực kỳ kém. [121] Carbon được biết đến ở một số dạng dị hướng khác, bao gồm buckminsterfullerene bán dẫn, [122] và vô định hình [123] và paracrystalline (hỗn hợp vô định hình và tinh thể) [124] .
- Nitơ có thể tạo thành tetranitơ ở thể khí (N 4 ), một phân tử đa nguyên tử không ổn định với thời gian tồn tại khoảng một micro giây. [125]
- Oxy là một phân tử diatomic ở trạng thái tiêu chuẩn của nó; nó cũng tồn tại dưới dạng ôzôn (O 3 ), một dạng phi kim không ổn định với chu kỳ bán rã "trong nhà" khoảng nửa giờ, so với khoảng ba ngày trong không khí xung quanh ở 20 ° C. [126]
- phosphor, duy nhất, tồn tại ở một số dạng dị hướng ổn định hơn trạng thái tiêu chuẩn của nó là phosphor trắng (P 4 ). Các dạng thù hình trắng, đỏ và đen có lẽ được biết đến nhiều nhất; đầu tiên là chất cách điện; hai cái sau là chất bán dẫn. [127] phosphor cũng tồn tại dưới dạng diphosphorus (P 2 ), một dạng thù hình tảo cát không ổn định. [128]
- Lưu huỳnh có nhiều dạng thù hình hơn bất kỳ nguyên tố nào khác. [129] Lưu huỳnh vô định hình, một hỗn hợp bền vững của các dạng thù hình như vậy, được ghi nhận về tính đàn hồi của nó. [130]
- seleni có một số dạng phi kim, tất cả đều dẫn điện kém hơn nhiều so với trạng thái tiêu chuẩn của nó là seleni "kim loại" màu xám. [131]
Tất cả các nguyên tố phổ biến nhất được công nhận là kim loại đều tạo thành các dạng thù hình:
- Boron được biết đến ở một số dạng tinh thể và vô định hình . [132]
- Silicon có thể tạo thành tinh thể (giống như kim cương); vô định hình; và các dạng thù hình Si 24 trực thoi . [133]
- Ở áp suất khoảng 10-11 GPa, germani chuyển thành pha kim loại có cấu trúc tứ giác giống như thiếc. Khi bị giải nén - và tùy thuộc vào tốc độ giải phóng áp suất - germani kim loại tạo thành một loạt các dạng thù hình có thể di chuyển trong điều kiện môi trường xung quanh. [134]
- Arsenic và antimon tạo thành một số dạng thù hình nổi tiếng (vàng, xám và đen). [135]
- Teluri được biết đến ở dạng tinh thể và vô định hình. [136]
Mức độ phổ biến và quyền truy cập[sửa | sửa mã nguồn]
Dồi dào[sửa | sửa mã nguồn]
| Miền | Các thành phần chính | Tiếp theo hầu hết </br> dồi dào |
|---|---|---|
| vỏ trái đất | O 61%, Si 20% | H 2,9% |
| Khí quyển | N 78%, O 21% | Ar 0,5% |
| Thủy quyển | O 66,2%, H 33,2% | Cl 0,3% |
| Sinh khối | O 63%, C 20%, H 10% | N 3,0% |
Hyđrô và heli được ước tính chiếm khoảng 99% tất cả các vật chất thông thường trong vũ trụ và hơn 99,9% nguyên tử của nó. [138] Oxy được cho là nguyên tố phong phú nhất tiếp theo, vào khoảng 0,1%. [139] Ít hơn 5% vũ trụ được cho là được tạo ra từ vật chất thông thường, đại diện là các ngôi sao, hành tinh và sinh vật sống. Sự cân bằng được tạo nên từ năng lượng tối và vật chất tối, cả hai đều hiện chưa được hiểu rõ. [140]
Năm phi kim là hydro, carbon, nitơ, oxy và silicon tạo thành phần lớn của vỏ Trái đất, khí quyển, thủy quyển và sinh khối, với số lượng được hiển thị trong bảng.
Khai thác[sửa | sửa mã nguồn]

Các phi kim và kim loại, được chiết xuất ở dạng thô từ: [96]
- nước muối — clo, brom, iốt;
- không khí lỏng —nitơ, oxy, neon, argon, krypton, xenon;
- khoáng chất —boron ( khoáng chất borat ); carbon (than đá; kim cương; than chì); fluor ( fluorrit ); silic ( silica ); phosphor (phốt phát); antimon ( stibnit, tetrahedrit ); iốt (trong natri iodat và natri iodua );
- khí tự nhiên - hydro, heli, lưu huỳnh; và
- quặng, như là phụ phẩm chế biến — germani (quặng kẽm ); arsenic ( quặng đồng và chì ); seleni, Teluri (quặng đồng); và radon (quặng sinh uranium ).
Phí tổn[sửa | sửa mã nguồn]
Vào tháng 1 năm 2022, trong khi các phi kim không phóng xạ tương đối rẻ [n 23] thì vẫn có một số ngoại lệ. Boron, germani, arsenic và brom có thể có giá từ khoảng 3 đô la Mỹ đến 11 đô la Mỹ mỗi gam (xem bạc khoảng 0,75 đô la Mỹ mỗi gam). Giá có thể giảm đáng kể nếu tham gia số lượng lớn. phosphor ở dạng đen ổn định nhất của nó, "có thể lên đến 1.000 đô la mỗi gam" [142] (khoảng 15 lần giá vàng) trong khi phosphor trắng thông thường có giá 30 đô la trên 100 gam. Các nhà nghiên cứu hy vọng có thể giảm giá thành của phosphor đen xuống thấp nhất là 1 đô la cho mỗi gam. [142] Cho đến năm 2013, radon có sẵn từ Viện Tiêu chuẩn và Công nghệ Quốc gia với giá $ 1,636 cho mỗi 0,2 đơn vị phát hành ml, tương đương khoảng 86.000.000 đô la mỗi gam, không có dấu hiệu giảm giá cho số lượng lớn. [143]
Sử dụng chung[sửa | sửa mã nguồn]
Gần như tất cả các phi kim đều có các ứng dụng khác nhau trong các vật dụng gia đình; ánh sáng và laser; và thuốc và dược phẩm . Ví dụ, nitơ được tìm thấy trong một số phương pháp xử lý vườn; tia laze ; và thuốc chữa bệnh tiểu đường . Germanium, arsenic và radon đều có công dụng trong một hoặc hai trong số các lĩnh vực này nhưng không phải cả ba. [96] Ngoài các khí hiếm, hầu hết các phi kim còn lại đều có, hoặc đã có, sử dụng trong hóa chất nông nghiệp và thuốc nhuộm . [96] Trong phạm vi mà các kim loại thể hiện đặc tính kim loại, chúng có các công dụng đặc biệt mở rộng cho (ví dụ) thủy tinh oxide, các thành phần hợp kim và chất bán dẫn. [144]
Việc sử dụng được chia sẻ nhiều hơn của các tập hợp con khác nhau của phi kim xảy ra trong hoặc thay thế không khí; chất lạnh và chất làm lạnh ; phân bón ; chất chống cháy hoặc chất chữa cháy ; acid khoáng ; xe plug-in hybrid ; khí hàn ; và điện thoại thông minh . [96]
Lịch sử, bối cảnh và phân loại học[sửa | sửa mã nguồn]
Khám phá[sửa | sửa mã nguồn]

The majority of nonmetals were discovered in the 18th and 19th centuries. Before then carbon, sulfur and antimony were known in antiquity; arsenic was discovered during the Middle Ages (by Albertus Magnus); and Hennig Brand isolated phosphorus from urine in 1669. Helium (1868) holds the distinction of being the only element not first discovered on Earth.[n 1] Radon is the most recently discovered nonmetal, being found only at the end of the 19th century.
Các kỹ thuật dựa trên hóa học hoặc vật lý được sử dụng trong các nỗ lực phân lập là quang phổ, chưng cất phân đoạn, phát hiện bức xạ, điện phân, acid hóa quặng, đốt cháy, phản ứng chuyển vị và nung nóng: một số phi kim xuất hiện tự nhiên dưới dạng nguyên tố tự do
Trong số các khí hiếm, heli được phát hiện qua vạch màu vàng của nó trong quang phổ của mặt trời, và sau đó bằng cách quan sát các bong bóng thoát ra từ uranit UO 2 hòa tan trong acid. Neon thông qua xenon thu được thông qua quá trình chưng cất phân đoạn không khí. Radon lần đầu tiên được quan sát phát ra từ các hợp chất của thorium, ba năm sau khi Henri Becquerel phát hiện ra bức xạ vào năm 1896. [146]
Các halogen phi kim thu được từ halogenua của chúng thông qua điện phân, thêm acid hoặc chuyển vị . Một số nhà hóa học đã chết do các thí nghiệm của họ cố gắng phân lập fluor. [147]
Trong số các phi kim chưa được phân loại, carbon đã được biết đến (hoặc được sản xuất) như than củi, bồ hóng, than chì và kim cương; nitơ được quan sát thấy trong không khí mà từ đó oxy đã được loại bỏ; oxy thu được bằng cách đun nóng thủy ngân oxide ; phosphor được giải phóng bằng cách đun nóng amoni natri hydro photphat (Na (NH 4 ) HPO 4 ), như được tìm thấy trong nước tiểu ; [148] lưu huỳnh xuất hiện tự nhiên như một nguyên tố tự do; và seleni [n 25] được phát hiện dưới dạng cặn trong acid sulfuric . [149]
Hầu hết các nguyên tố thường được công nhận là kim loại đều được phân lập bằng cách nung nóng các oxide của chúng ( bo, silic, arsenic, teluri ) hoặc sulfide ( germani ). [96] Antimon đã được biết đến ở dạng nguyên bản cũng như có thể đạt được bằng cách đun nóng sulfide của nó. [150]
Nguồn gốc của khái niệm[sửa | sửa mã nguồn]
Sự phân biệt giữa kim loại và phi kim nảy sinh, một cách phức tạp, từ sự nhận biết thô sơ về các loại vật chất khác nhau, cụ thể là các chất, hỗn hợp, hợp chất và nguyên tố tinh khiết. Do đó, vật chất có thể được chia thành các chất tinh khiết (như muối, bicarb sôđa, hoặc lưu huỳnh) và hỗn hợp ( nước cường toan, thuốc súng, hoặc đồng, chẳng hạn) và các chất tinh khiết cuối cùng có thể được phân biệt thành các hợp chất và nguyên tố. [151] Khi đó, các nguyên tố "kim loại" dường như có các thuộc tính dễ phân biệt mà các nguyên tố khác không có, chẳng hạn như khả năng dẫn nhiệt hoặc cho " đất " ( oxide ) của chúng tạo thành các dung dịch base trong nước, ví dụ như xảy ra với vôi sống (CaO). [152]
Sử dụng thuật ngữ[sửa | sửa mã nguồn]
Thuật ngữ phi kim loại có từ năm 1566. Trong một chuyên luận y học xuất bản năm đó, Loys de L'Aunay (một bác sĩ người Pháp) đã đề cập đến các đặc tính của các chất thực vật từ các vùng đất kim loại và "phi kim loại". [153]
Trong hóa học ban đầu, Wilhelm Homberg (một nhà triết học tự nhiên người Đức) đã đề cập đến lưu huỳnh "phi kim loại" trong Des Essais de Chimie (1708). [154] Ông đặt câu hỏi về sự phân chia năm lần của tất cả vật chất thành lưu huỳnh, thủy ngân, muối, nước và đất, như định đề của Étienne de Clave (1641) trong Ánh sáng triết học mới về các nguyên tắc đích thực và các yếu tố của tự nhiên . [155] Cách tiếp cận của Homberg đại diện cho "một bước tiến quan trọng đối với khái niệm hiện đại về một phần tử". [156]
Lavoisier, trong tác phẩm "cách mạng" [157] năm 1789 Traité élémentaire de chimie , đã công bố danh sách các nguyên tố hóa học hiện đại đầu tiên, trong đó ông phân biệt giữa khí, kim loại, phi kim và đất (oxide chịu nhiệt). [158] Trong mười bảy năm đầu tiên, tác phẩm của Lavoisier đã được tái bản thành hai mươi ba ấn bản bằng sáu thứ tiếng, và "mang ... hóa học mới của [anh ấy] ở khắp Châu Âu và Châu Mỹ. " [159]
Các tiêu chí phân biệt được đề xuất[sửa | sửa mã nguồn]
Năm 1809, khám phá của Humphry Davy về natri và kali đã "hủy diệt" [160] đường phân giới giữa kim loại và phi kim. Trước đó, kim loại đã được phân biệt dựa trên độ nguy hiểm hoặc mật độ tương đối cao của chúng. [161] Mặt khác, natri và kali nổi trên mặt nước nhưng rõ ràng là kim loại dựa trên đặc tính hóa học của chúng. [162]
Ngay từ năm 1811, các tính chất khác nhau - liên quan đến vật lý, hóa học và electron - đã được sử dụng trong nỗ lực cải thiện sự phân biệt giữa kim loại và phi kim. Bảng kèm theo đưa ra 22 thuộc tính như vậy, theo loại và thứ tự ngày.
Có lẽ tính chất được biết đến nhiều nhất là độ dẫn điện của kim loại tăng khi nhiệt độ giảm trong khi độ dẫn điện của phi kim loại tăng lên. Tuy nhiên, chương trình này không hoạt động đối với plutoni, carbon, arsenic và antimon. Plutonium, là một kim loại, tăng tính dẫn điện của nó khi được nung nóng trong khoảng nhiệt độ khoảng –175 đến +125 ° C. [163] Carbon, mặc dù được coi là một phi kim loại, nhưng cũng làm tăng độ dẫn điện của nó khi bị nung nóng. [164] Arsenic và antimon đôi khi được phân loại là phi kim nhưng hoạt động tương tự như carbon. [165]
Emsley lưu ý rằng, "Không có tài sản riêng lẻ nào ... có thể được sử dụng để phân loại tất cả các nguyên tố là kim loại hoặc phi kim. " [166] Kneen và cộng sự. gợi ý rằng các phi kim có thể được phân biệt sau khi một tiêu chí [duy nhất] về tính kim loại được chọn, thêm rằng, "có thể có nhiều cách phân loại tùy ý, hầu hết trong số đó, nếu được chọn hợp lý, sẽ tương tự nhưng không nhất thiết phải giống hệt nhau." [5] Ngược lại, Jones quan sát thấy rằng "các lớp thường được xác định bởi nhiều hơn hai thuộc tính". [167]
Johnson gợi ý rằng các tính chất vật lý có thể chỉ ra tốt nhất các đặc tính kim loại hoặc phi kim loại của một nguyên tố, với điều kiện là các thuộc tính khác sẽ cần thiết trong những trường hợp không rõ ràng. Cụ thể hơn, ông quan sát thấy rằng tất cả các nguyên tố thể khí hoặc không dẫn điện đều là phi kim; kim loại phi kim rắn cứng và giòn hoặc mềm và dễ vỡ trong khi kim loại thường dễ uốn và dễ uốn; và các oxide của phi kim có tính acid. [168]
Một khi cơ sở để phân biệt giữa "hai nhóm nguyên tố lớn" [169] được thiết lập, các phi kim được coi là những phi kim thiếu các thuộc tính của kim loại, [170] ở mức độ lớn hơn hoặc nhỏ hơn. [171] Một số tác giả tiếp tục chia các nguyên tố thành kim loại, kim loại và phi kim mặc dù Odberg lập luận rằng bất cứ thứ gì không phải kim loại, trên cơ sở phân loại, đều là phi kim. [172]
Phát triển các lớp con[sửa | sửa mã nguồn]
Một phân loại cơ bản của phi kim được đặt ra vào năm 1844, bởi Alphonse Dupasquier, một bác sĩ, dược sĩ và nhà hóa học người Pháp. [173] Để tạo điều kiện thuận lợi cho việc nghiên cứu các phi kim, ông đã viết: [174]
- Phi kim được chia làm 4 nhóm hay 4 phần như sau:
- Organogen gồm O, N, H, C
- Sulphuroid gồm S, Se, P
- Chloroide gồm F, Cl, Br, I
- Boroid gồm B, Si.
Một tiếng vang của phân loại gấp bốn lần của Dupasquier được nhìn thấy trong các phân lớp hiện đại. Các organogens và sulphuroids đại diện cho tập hợp các phi kim chưa được phân loại. Các cấu hình thay đổi của bảy phi kim này đã được gọi là, ví dụ, các phi kim cơ bản; [175] chất sinh học; [176] phi kim trung tâm; [177] CHNOPS; [178] yếu tố thiết yếu; [179] "phi kim"; [180] [n 27] phi kim mồ côi; [181] hoặc phi kim oxi hóa khử. [182] Các phi kim chloroide được gọi một cách độc lập là các halogen. [183] Các phi kim loại boroid mở rộng thành các kim loại, bắt đầu từ đầu năm 1864. [184] Các khí hiếm, như một nhóm rời rạc, đã được tính trong số các phi kim từ đầu năm 1900. [185]
So sánh[sửa | sửa mã nguồn]
Some properties of metals, and of metalloids, unclassified nonmetals, nonmetal halogens, and noble gases are summarized in the table.[n 2] Physical properties apply to elements in their most stable forms in ambient conditions, and are listed in loose order of ease of determination. Chemical properties are listed from general to descriptive, and then to specific. The dashed line around the metalloids denotes that, depending on the author, the elements involved may or may not be recognized as a distinct class or subclass of elements. Metals are included as a reference point.
Hầu hết các thuộc tính cho thấy sự tiến triển từ trái sang phải theo ký tự kim loại sang phi kim loại hoặc các giá trị trung bình. Do đó, bảng tuần hoàn có thể được chia thành kim loại và phi kim, với sự phân cấp ít nhiều khác biệt giữa các phi kim. [186]
Xem thêm[sửa | sửa mã nguồn]
- CHON (carbon, hydro, oxy, nitơ)
- Danh sách các chuyên khảo về phi kim
- Áp suất kim loại hóa
- Nguyên tố chu kỳ 1 (hydro, heli)
- Tính chất của phi kim (và kim loại) theo nhóm
[[Thể loại:Thể loại:Bảng tuần hoàn]] [[Thể loại:Thể loại:Phi kim]] [[Thể loại:Trang có bản dịch chưa được xem lại]]
- ^ Glinka 1959, p. 77;Oxtoby, Gillis & Butler 2015, p. I.23
- ^ Godovikov & Nenasheva 2020, p. 4
- ^ Sanderson 1957, p. 229
- ^ Morely & Muir 1892, p. 241
- ^ a b Kneen, Rogers & Simpson 1972, pp. 218–219
- ^ Steudel 2020, p. 43
- ^ a b c d Vernon 2013
- ^ IUPAC Periodic Table of the Elements
- ^ Johnson 2007, p. 13
- ^ Bodner & Pardue 1993, p. 354; Cherim 1971, p. 98
- ^ Restrepo et al. 2006, p. 411; Thornton & Burdette 2010, p. 86; Hermann, Hoffmann & Ashcroft 2013, pp. 11604‒1‒11604‒5
- ^ Mewes et al. 2019; Smits et al. 2020
- ^ Kneen, Rogers & Simpson 1972, pp. 261–264
- ^ Phillips 1973, p. 7
- ^ Danh pháp lấy từ: https://vdocs.pl/download-file/c1-cac-khai-niem-co-ban-printpdf-41zgpo2vg3?hash=aeff99b054392fe70695533026b52434
- ^ Zumdahl & DeCoste 2010, pp. 455, 456, 469, A40
- ^ Still 2016, p. 120
- ^ Siekierski & Burgess 2002, p. 86
- ^ Charlier, Gonze & Michenaud 1994
- ^ Taniguchi et al. 1984, p. 867: "... black phosphorus ... [is] characterized by the wide valence bands with rather delocalized nature."; Morita 1986, p. 230; Carmalt & Norman 1998, p. 7: "Phosphorus ... should therefore be expected to have some metalloid properties."; Du et al. 2010. Interlayer interactions in black phosphorus, which are attributed to van der Waals-Keesom forces, are thought to contribute to the smaller band gap of the bulk material (calculated 0.19 eV; observed 0.3 eV) as opposed to the larger band gap of a single layer (calculated ~0.75 eV).
- ^ Wiberg 2001, pp. 742
- ^ Evans 1966, pp. 124–25
- ^ Wiberg 2001, pp. 758
- ^ Stuke 1974, p. 178; Donohue 1982, pp. 386–87; Cotton et al. 1999, p. 501
- ^ Steudel 1977, p. 240: "... considerable orbital overlap must exist, to form intermolecular, many-center ... [sigma] bonds, spread through the layer and populated with delocalized electrons, reflected in the properties of iodine (lustre, color, moderate electrical conductivity)."; Segal 1989, p. 481: "Iodine exhibits some metallic properties ..."
- ^ Kneen, Rogers & Simpson 1972, pp. 85–86, 237
- ^ Salinas 2019, p. 379
- ^ Yang 2004, p. 9
- ^ Herzfeld 1927, pp. 701–705; Edwards 2000, pp. 100–103
- ^ Kneen, Rogers & Simpson 1972, pp. 263‒264
- ^ Langley & Hattori 2014, p. 214
- ^ Abbott 1966, p. 18
- ^ Brown et al. 2014, p. 237
- ^ Ebbing & Wrighton 2007 p. 868
- ^ Matson & Orbaek 2013, p. 85
- ^ Yoder, Suydam & Snavely 1975, p. 58
- ^ Young et al. 2018, p. 753
- ^ Brown et al. 2014, p. 227
- ^ Siekierski & Burgess 2002, pp. 21, 133, 177
- ^ Moore 2016; Burford, Passmore & Sanders 1989, p. 54
- ^ King & Caldwell 1954, p. 17; Brady & Senese 2009, p. 69
- ^ Chemical Abstracts Service 2021
- ^ Cockell 2019, p. 210
- ^ Emsley 2011, pp. 81, 181; Scott 2014, p. 3
- ^ Kneen, Rogers & Simpson 1972, pp. 226, 360
- ^ Lee 1996, p. 240
- ^ Greenwood & Earnshaw 2002, p. 43
- ^ Cressey 2010
- ^ Siekierski & Burgess 2002, pp. 24–25
- ^ Siekierski & Burgess 2002, p. 23
- ^ Petruševski & Cvetković 2018; Grochala 2018
- ^ Greenwood & Earnshaw 2002, pp. 27, 1232, 1234
- ^ Siekierski & Burgess 2002, pp. 52, 101, 111, 124, 194
- ^ Cox 2004, p. 146
- ^ Encyclopædia Britannica 2021
- ^ Royal Society of Chemistry 2021
- ^ Russell & Lee 2005, p. 419
- ^ Hampel & Hawley 1976, p. 174;
- ^ Goodrich 1844, p. 264; The Chemical News 1897, p. 189; Hampel & Hawley 1976, p. 191; Lewis 1993, p. 835; Hérold 2006, pp. 149–50
- ^ Tyler 1948, p. 105; Reilly 2002, pp. 5–6
- ^ Stein 1983, p. 165
- ^ Matson & Orbaek 2013, p. 203
- ^ Jolly 1966, p. 20
- ^ Clugston & Flemming 2000, pp. 100–101, 104–105, 302
- ^ Maosheng 2020, p. 962
- ^ Mazej 2020
- ^ Wiberg 2001, p. 1131
- ^ Vernon 2020, p. 229
- ^ Cox 2000, pp. 258–259; Möller 2003, p. 173; Trenberth & Smith 2005, p. 864
- ^ Emsley 2011, p. 220
- ^ Emsley 2011, p. 440
- ^ Zhu et al. 2014, pp. 644–648
- ^ Wiberg 2001, pp. 4022
- ^ Greenwood & Earnshaw 2002, p. 804
- ^ Rudolph 1973, p. 133: "Oxygen and the halogens in particular ... are therefore strong oxidizing agents."
- ^ Daniel & Rapp 1976, p. 55
- ^ Cotton et al. 1999, p. 554
- ^ Lanford 1959, p. 176
- ^ Rayner-Canham 2020, p. 92, 139
- ^ Massey 2000, p. 113
- ^ Schmedt, Mangstl & Kraus 2012, p. 7847‒7849
- ^ Greenwood & Earnshaw 2002, p. 277
- ^ Atkins et al. 2006, p. 320
- ^ Greenwood & Earnshaw 2002, p. 482; Berger 1997, p. 86
- ^ a b c d e Cao et al. 2021, pp. 20–21
- ^ Challoner 2014, p. 5; Government of Canada 2015; Gargaud et al. 2006, p. 447
- ^ Crichton 2012, p. 6; Scerri 2013; Los Alamos National Laboratory 2021
- ^ Vernon 2020, p. 218
- ^ Seese & Daub 1985, p. 65
- ^ MacKay, MacKay & Henderson 2002, p. 209
- ^ Cousins, Davidson & García-Vivó 2013, pp. 11809–11811
- ^ a b Wiberg 2001, pp. 255–257
- ^ Liptrot 1983, p. 161
- ^ Scott & Kanda 1962, p. 153
- ^ Taylor 1960, p. 316
- ^ a b c d e f Emsley 2011, passim
- ^ Crawford 1968, p. 540
- ^ Benner, Ricardo & Carrigan 2018, pp. 167—168: "The stability of the carbon—carbon bond ... has made it the first choice element to scaffold biomolecules. Hydrogen is need for many reasons; at the very least, it terminates C–C chains. Heteroatoms (atoms that are neither carbon nor hydrogen) determine the reactivity of carbon-scaffolded biomolecules. In ... life, these are oxygen, nitrogen and, to a lesser extent, sulfur, phosphorus, selenium, and an occasional halogen."
- ^ Zhao, Tu & Chan 2021
- ^ Kosanke et al. 2012, p. 841
- ^ Wasewar 2021, pp. 322–323
- ^ Messler 2011, p. 10
- ^ King et al. 1994, p. 1344; Powell & Tims 1974, pp. 189–191
- ^ Vernon 2020, pp. 221–223
- ^ Rayner-Canham 2020, p. 216
- ^ Atkins 2001, pp. 24–25
- ^ a b Cox 1997, pp. 130–132; Emsley 2011, passim
- ^ National Center for Biotechnology Information 2021
- ^ Emsley 2011, p. 113
- ^ Greenwood & Earnshaw 2002, p. 270–271
- ^ Khan 2001, p. 59
- ^ Cox 1997, pp. 130; Emsley 2011, p. 393
- ^ Cox 1997, pp. 130; Emsley 2011, pp. 515–516, 518
- ^ Boyd 2011, p. 570
- ^ Masterton, Hurley & Neth 2011, p. 38
- ^ McCue 1963, p. 264
- ^ Dingle 2017, p. 101
- ^ Hurlbut 1961, p. 132
- ^ Barton 2021, p. 200
- ^ Shanabrook, Lannin & Hisatsune 1981, pp. 130‒133
- ^ Borg & Dienes 1992, p. 26
- ^ Wiberg 2001, p. 796
- ^ Shang et al. 2021
- ^ Tang et al. 2021
- ^ Cacace, de Petris & Troiani 2002, pp. 480‒481
- ^ Koziel 2002, p. 18
- ^ Gusmão, Sofer & Pumera 2017, p. 8052–8053; Berger 1997, p. 84; Vernon 2013, pp. 1704‒1705
- ^ Piro et al. 2006, pp. 1276‒1279
- ^ Steudel & Eckert 2003, p. 1
- ^ Greenwood & Earnshaw 2002, pp. 659–660
- ^ Moss 1952, p. 192; Greenwood & Earnshaw 2002, p. 751
- ^ Donohue 1982, pp. 48–81
- ^ Shiell at al. 2021
- ^ Zhao et al. 2017
- ^ Donohue 1982, pp. 302–310
- ^ Brodsky et al. 1972, p. 609–614
- ^ Nelson 1987, p. 732: crust, atmosphere, hydrosphere; Fortescue 2012, pp. 56, 65: biomass
- ^ MacKay, MacKay & Henderson 2002, p. 200
- ^ Cox 1997, pp. 17, 19
- ^ Ostriker & Steinhardt 2001, pp. 46‒53
- ^ Höll et al. 2007
- ^ a b Boise State University 2020
- ^ National Institute of Standards and Technology 2013
- ^ Gaffney & Marley 2017, p. 27
- ^ Labinger 2019, p. 305
- ^ Emsley 2011, pp. 42–43, 219–220, 263–264, 341, 441–442, 596, 609
- ^ Emsley 2011, pp. 84, 128, 180–181, 247
- ^ Cook 1923, p. 124
- ^ Emsley 2011, pp. 113, 363, 378, 477, 514–515
- ^ Weeks 1945, p. 22; Emsley 2011, p. 40
- ^ Klein 1994, p. 168
- ^ Lidin 1996, pp. 64‒65
- ^ de L'Aunay 1566, p. 7)
- ^ Homberg 1708, p. 350; vide Kim 2000
- ^ de Clave 1641
- ^ Schlager & Lauer 2000, p. 370
- ^ Strathern 2000, p. 239
- ^ Criswell p. 1140
- ^ Salzberg 1991, p. 204
- ^ Hare & Bache 1836, p. 310
- ^ Chambers 1743: "That which distinguishes metals from all other bodies ... is their heaviness ..."
- ^ Edwards 2000, p. 85
- ^ Russell & Lee 2005, p. 466
- ^ Atkins et al. 2006, pp. 320–21
- ^ Zhigal'skii & Jones 2003, p. 66
- ^ Emsley 1971, p. 1
- ^ Jones 2010, p. 169
- ^ Johnson 1966, pp. 3–5, 15
- ^ Leach & Ewing 1966, p. 47
- ^ Brady & Senese 2009, p. 52
- ^ Zumdahl & DeCoste 2019, p. 90
- ^ Oderberg 2007, p. 97
- ^ Bertomeu-Sánchez, Garcia-Belmar & Bensaude-Vincent 2002, pp. 248–249
- ^ Dupasquier 1844, pp. 66–67
- ^ Williams 2007, pp. 1550–1561
- ^ Wächtershäuser 2014
- ^ Hengeveld & Fedonkin, pp. 181–226
- ^ Wakeman 1899, p. 562
- ^ Fraps 1913, p. 11
- ^ Parameswaran at al. 2020, p. 210
- ^ Knight 2002, p. 148
- ^ Fraústo da Silva & Williams 2001, p. 500
- ^ Berzelius 1832, pp. 248–276
- ^ The Chemical News 1864, p. 22
- ^ Renouf 1901, pp. 268
- ^ Vernon 2020, pp. 217–225
Lỗi chú thích: Đã tìm thấy thẻ <ref> với tên nhóm “n”, nhưng không tìm thấy thẻ tương ứng <references group="n"/> tương ứng, hoặc thẻ đóng </ref> bị thiếu
