Chlormadinone acetate
 | |
 | |
| Dữ liệu lâm sàng | |
|---|---|
| Tên thương mại | Belara, Lutéran, Prostal, others |
| Đồng nghĩa | CMA; RS-1280; ICI-39575; STG-155; NSC-92338; 17α-Acetoxy-6-chloro-6-dehydroprogesterone; 17α-Acetoxy-6-chloropregna-4,6-diene-3,20-dione |
| Dược đồ sử dụng | By mouth[1] |
| Mã ATC | |
| Tình trạng pháp lý | |
| Tình trạng pháp lý |
|
| Dữ liệu dược động học | |
| Sinh khả dụng | 100%[1][3][2] |
| Liên kết protein huyết tương | 96.6–99.4% (to albumin and not to SHBG or CBG)[1][3] |
| Chuyển hóa dược phẩm | Gan (reduction, hydroxylation, deacetylation, conjugation)[1][2] |
| Chất chuyển hóa | • 3α-Hydroxy-CMA[1][4] • 3β-Hydroxy-CMA[1][4] • Others[1] |
| Chu kỳ bán rã sinh học | 25–89 hours[1][3][5][6] |
| Bài tiết | Urine: 33–45%[3][6] Feces: 24–41%[3][6] |
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS |
|
| PubChem CID | |
| ChemSpider | |
| Định danh thành phần duy nhất | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| ECHA InfoCard | 100.005.563 |
| Dữ liệu hóa lý | |
| Công thức hóa học | C23H29ClO4 |
| Khối lượng phân tử | 404.931 g/mol |
| Mẫu 3D (Jmol) | |
SMILES
| |
Định danh hóa học quốc tế
| |
Chlormadinone acetate (CMA), được bán dưới tên thương hiệu Belara, Lutéran, và Prostal số những người khác, là một progestin và antiandrogen thuốc được sử dụng trong thuốc tránh thai để ngăn ngừa mang thai, như một thành phần của liệu pháp hormon mãn kinh, trong điều trị rối loạn phụ khoa, và trong điều trị tình trạng nội tiết tố androgen phụ thuộc vào giống như tuyến tiền liệt mở rộng và ung thư tuyến tiền liệt ở nam giới và mụn trứng cá và rậm lông ở phụ nữ.[1][3][5][7][8][9][10] Nó có sẵn ở cả liều thấp kết hợp với estrogen trong thuốc tránh thai và, ở một số quốc gia như Pháp và Nhật Bản, ở liều thấp, trung bình và liều cao đơn thuần cho các chỉ định khác nhau.[11] Nó được dùng bằng đường uống.[1]
Tác dụng phụ của sự kết hợp giữa estrogen và CMA bao gồm kinh nguyệt không đều, đau đầu, buồn nôn, đau vú, tiết dịch âm đạo và những thứ khác.[3] Ở liều lượng cao, CMA có thể gây ra rối loạn chức năng tình dục, mất chất, suy tuyến thượng thận và thay đổi chuyển hóa carbohydrate trong số các tác dụng phụ khác.[12][13] Thuốc là một proestin, hoặc proestogen tổng hợp, và do đó là một chất chủ vận của thụ thể progesterone, mục tiêu sinh học của proestogen như progesterone.[1] Nó cũng là một antiandrogen, và do đó là một chất đối kháng của thụ thể androgen, mục tiêu sinh học của androgen như testosterone và dihydrotestosterone.[1] Do hoạt động proestogen của nó, CMA có tác dụng antigonadotropic.[1][14][15] Thuốc có hoạt tính glucocorticoid yếu và không có hoạt động nội tiết tố quan trọng khác.[1]
CMA được phát hiện vào năm 1959 và được giới thiệu cho mục đích y tế vào năm 1965.[16][17][18] Nó có thể được coi là một proestin "thế hệ đầu tiên".[19] Thuốc đã bị thu hồi ở một số quốc gia vào năm 1970 do lo ngại về độc tính ở vú quan sát thấy ở chó, nhưng điều này hóa ra không áp dụng cho con người.[7][20][21][22][23] CMA có mặt rộng rãi trên toàn thế giới trong các loại thuốc tránh thai, nhưng đáng chú ý là không được bán trên thị trường ở bất kỳ quốc gia chủ yếu là tiếng Anh.[11][24] Nó chỉ có sẵn ở một số quốc gia, bao gồm Pháp, México, Nhật Bản và Hàn Quốc.[11][24]
Sử dụng trong y tế[sửa | sửa mã nguồn]
CMA được sử dụng với liều thấp kết hợp với ethinylestradiol (EE), một loại estrogen, trong thuốc tránh thai kết hợp.[5][25] Nó cũng đã được sử dụng trong việc điều trị các điều kiện phụ khoa bao gồm chảy máu âm đạo, Kinh thưa, polymenorrhea, hypermenorrhea, đau bụng kinh, vô kinh thứ phát, và màng trong dạ con và ở Pháp (dưới tên thương hiệu Lutéran) trong liệu pháp hormon mãn kinh kết hợp với một estrogen.[5][7][25] CMA được sử dụng ở liều lượng từ 1 đến 2 mg/ngày trong thuốc tránh thai kết hợp và với liều lượng từ 2 đến 10 mg/ngày trong điều trị rối loạn phụ khoa.[24] Thuốc tránh thai kết hợp có chứa EE và CMA đã được tìm thấy là hữu ích trong việc giảm các triệu chứng phụ thuộc androgen như tình trạng da và tóc.[3][26][27] Liều dùng CMA từ 15 đến 20 mg/ngày đã được tìm thấy để cải thiện các cơn bốc hỏa.[1]
CMA đã được sử dụng rộng rãi như một phương pháp điều trị thiếu hụt androgen trong điều trị ung thư tuyến tiền liệt và tăng sản tuyến tiền liệt lành tính ở Nhật Bản và Hàn Quốc, nhưng ít được sử dụng cho các chỉ định này ở những nơi khác trên thế giới.[8][9][10][11][13] Nó được sử dụng ở liều lượng từ 50 đến 100 mg / ngày trong điều trị bệnh tuyến tiền liệt.[24] Tương tự như cyproterone axetat (CPA), CMA cho thấy nguy cơ bốc hỏa thấp hơn so với các chất tương tự hormone giải phóng gonadotropin (chất tương tự GnRH).[13] Thuốc này là thuốc chống ung thư steroid duy nhất khác ngoài CPA đã được phê duyệt và sử dụng để điều trị ung thư tuyến tiền liệt; megestrol axetat cũng đã được nghiên cứu, nhưng chưa được phê duyệt.[7][28]
CMA cũng đã được tìm thấy là có hiệu quả trong điều trị các tình trạng phụ thuộc androgen khác như mụn trứng cá, bã nhờn, rậm lông và rụng tóc ở phụ nữ, tương tự như CPA.[3][7][27][29] Nó đã được nghiên cứu ở liều lượng vừa phải từ 4 đến 12 mg/ngày trong điều trị dậy thì sớm ở trẻ gái.[7] Nó cho thấy những lợi ích tương tự như của medroxyprogesterone axetat ở những cô gái này và được tìm thấy để giảm, nhưng không xóa bỏ sự phát triển sớm như tăng trưởng vú và kinh nguyệt.[7] Chỉ có sự phát triển lông nhẹ hoặc không ở nách ở các cô gái.[7] CMA cũng đã được sử dụng như một thành phần của liệu pháp hormone cho phụ nữ chuyển giới, tương tự như CPA và spironolactone, mặc dù chủ yếu chỉ có ở Nhật Bản.[30]
CMA đã được sử dụng để ngăn chặn sự bùng phát testosterone khi bắt đầu điều trị bằng chất chủ vận hormone giải phóng gonadotropin ở nam giới bị ung thư tuyến tiền liệt.[31]
Các dạng có sẵn[sửa | sửa mã nguồn]
CMA có sẵn trong các hình thức uống thuốc ở liều thấp (2 mg) kết hợp với EE trong thuốc tránh thai (ví dụ như Belara ở Đức),[32] với liều thấp đến trung bình (2, 5, 10, 25 mg) một mình (ví dụ, như Lutéran ở Pháp và Lutoral ở México),[33][34] và ở liều cao (50 mg) một mình (ví dụ, như Prostal ở Nhật Bản và Prostal-L ở Hàn Quốc).[11][35]
Chống chỉ định[sửa | sửa mã nguồn]
Chống chỉ định của thuốc tránh thai kết hợp, chẳng hạn như thuốc có chứa EE và CMA, bao gồm mang thai hoặc nghi ngờ có thai, cho con bú và cho con bú, có tiền sử hoặc đã biết nhạy cảm với huyết khối, ứ mật (nhưng không phải là xơ gan hoặc viêm gan mạn tính) và ung thư vú.[36] CMA là một teratogen ở động vật và có thể có khả năng gây hại cho thai nhi, chẳng hạn như nữ tính hóa thai nhi trong số các khuyết tật khác.[37][38]
Tác dụng phụ[sửa | sửa mã nguồn]
Các tác dụng phụ phổ biến nhất của thuốc tránh thai có EE và CMA liều thấp đã được tìm thấy bao gồm bất thường về kinh nguyệt, đau đầu (37%), buồn nôn (23%), đau vú (22%) và tiết dịch âm đạo (19%) trong số những người khác.[3] Các công thức này không ảnh hưởng xấu đến ham muốn hoặc chức năng tình dục ở phụ nữ và cho thấy ít hoặc không có nguy cơ trầm cảm, thay đổi tâm trạng hoặc tăng cân.[5][25] CMA liều cao có liên quan đến rối loạn chức năng tình dục (ví dụ, giảm ham muốn tình dục, rối loạn cương dương), giảm lông trên cơ thể, suy tuyến thượng thận và thay đổi chuyển hóa carbohydrate.[12][13] Ngược lại, nó không chia sẻ tác dụng phụ của estrogen như khó chịu ở vú và gynecomastia.[7] CMA không làm tăng nguy cơ huyết khối tĩnh mạch.[5][25] Có một báo cáo trường hợp viêm da progesterone tự miễn với CMA.[23] Tương tự như các proestin khác nhưng trái ngược với progesterone, CMA đã được tìm thấy làm tăng đáng kể nguy cơ ung thư vú khi được sử dụng kết hợp với estrogen trong liệu pháp hormone mãn kinh.[39] Không có bất thường trong xét nghiệm chức năng gan đã được quan sát thấy ở những phụ nữ dùng thuốc tránh thai kết hợp có chứa CMA hoặc CPA.[3] Không giống như CPA, CMA liều cao dường như không liên quan đến nhiễm độc gan.[13]
Tương tự như vậy để megestrol axetat và medroxyprogesterone axetat, CMA xuất hiện hiển thị ít tiềm năng cho gan và gây ung thư hơn so với CPA trong sinh trắc nghiệm.[40][41][42][43][44] Điều này dường như có liên quan đến việc thiếu nhóm methylene C1α, 2α trong các steroid này.[41][42][45] Một trường hợp ung thư biểu mô tế bào gan đã được báo cáo ở một phụ nữ dùng thuốc tránh thai có chứa CMA.[40][43] Tuy nhiên, tỷ lệ mắc khối u gan ở phụ nữ kết hợp với thuốc tránh thai có chứa CMA dường như tương tự như đối với thuốc tránh thai có chứa các proestin khác.[43]
Quá liều[sửa | sửa mã nguồn]
CMA đã được nghiên cứu ở những người đàn ông bị ung thư tuyến tiền liệt tiến triển với liều lượng lớn từ 1.000 đến 2.000 mg / ngày uống và 100 đến 500 mg/ngày qua tiêm bắp, không có tác dụng phụ nghiêm trọng hoặc độc tính được mô tả.[7][46]
Tương tác[sửa | sửa mã nguồn]
Vì CMA không ức chế enzyme cytochrome P450, nó có thể có nguy cơ thấp hơn của tương tác thuốc hơn 19 nortestosterone progestin.[3][5]
Dược lý[sửa | sửa mã nguồn]
Dược lực học[sửa | sửa mã nguồn]
CMA có hoạt động progestogen, antigonadotropic, kháng androgen, và hoạt động glucocorticoid yếu.[1][3]
| Hợp chất | PR | AR | ER | GR | MR | SHBG | CBG | |
|---|---|---|---|---|---|---|---|---|
| CMA | 67 con172 | 3 Led76 | 0 | số 8 | 0 | 0 | 0 | |
| 3α-Hydroxy-CMA | 33 | 4 | ? | 2 | ? | ? | ? | |
| 3β-Hydroxy-CMA | 72 | 15 | ? | 6 | ? | ? | ? | |
| Ghi chú: Giá trị là tỷ lệ phần trăm (%). Phối tử tham chiếu (100%) là promegstone cho PR, metribolone cho AR, <abbr about="#mwt296" data-mw="{"parts":[{"template":{"target":{"wt":"abbr","href":"./Template:Abbr"},"params":{"1":{"wt":"E2"},"2":{"wt":"estradiol"}},"i":0}}]}" data-ve-no-generated-contents="true" id="mwAQI" title="estradiol" typeof="mw:Transclusion mw:ExpandedAttrs">E2</abbr> cho ER, DEXA cho GR, aldosterone cho MR, DHT cho SHBG và cortisol cho CBG. Nguồn: [1][3][4] | ||||||||
Hoạt động sinh sản[sửa | sửa mã nguồn]
CMA là một proestogen, hoặc một chất chủ vận của thụ thể progesterone.[1][3] Nó rất mạnh trong hoạt động proogenogen của nó, với khoảng 330 nhân với hiệu lực của progesterone trong xét nghiệm Clauberg và khoảng 2.000 đến 10.000 nhân với hiệu lực của progesterone trong xét nghiệm McPhail.[3][7] Để so sánh, hiệu lực của medroxyprogesterone axetat và CPA trong xét nghiệm Clauberg lần lượt là khoảng 330 và 1.000 lần so với progesterone.[7] Hoạt động với progestogen của CMA là chịu trách nhiệm về chức năng của nó antigonadotropic và antiestrogenic hiệu ứng và cho mình biện pháp tránh thai hiệu quả.[1][7][25] Liều dùng rụng trứng của CMA ở phụ nữ là 1,7 mg / ngày và liều chuyển đổi nội mạc tử cung của nó là 25 mg/chu kỳ.[1] Liều dùng hiệu quả của CMA là thuốc tránh thai chỉ có proestogen là 0,5 mg / ngày.[47][48] Sự ức chế rụng trứng không đầy đủ ở liều này và tác dụng tránh thai thay vào đó chủ yếu đạt được thông qua những thay đổi proogenogen ở nội mạc tử cung và cổ tử cung.[48]
Trong sinh học thỏ, hoạt hóa PR tương tự đối với CMA và các chất chuyển hóa hoạt động chính của nó là 3α-hydroxychlormadinone acetate (3α-OH-CMA) và 3β-hydroxychlormadinone acetate (3β-OH-CMA).[4]
Tác dụng antigonadotropic[sửa | sửa mã nguồn]

Do hoạt động với progestogen của nó, CMA có antigonadotropic hiệu ứng, và do đó có thể ức chế sự bài tiết của gonadotropins hormone luteinizing (LH) và hormone kích thích nang (FSH) từ tuyến yên.[3][12][49] Kết quả là, CMA ngăn chặn sự rụng trứng và tuyến sinh dục hormone giới tính sản xuất và mạnh mẽ có thể làm giảm lưu lượng testosterone và estradiol ở liều lượng đủ cao.[3][12][49] Thuốc với liều 50 mg/ngày đã được tìm thấy để ức chế nồng độ testosterone khoảng 76 đến 85% (khoảng 50 ng / dL) và mức estradiol khoảng 55 đến 59% (khoảng 7 Lời8 pg / mL) ở nam giới mắc bệnh HA.[12] Như vậy, CMA có chức năng mạnh mẽ kháng androgen và antiestrogenic hiệu ứng thông qua các hiệu ứng antigonadotropic của nó.[3][14][15]
Hoạt động antiandrogen[sửa | sửa mã nguồn]
CMA là một antiandrogen mạnh, hoặc chất đối kháng của thụ thể androgen (AR), với khoảng 30 đến 40% ái lực của CPA đối với thụ thể.[1] Giống như progestin khác với hoạt động kháng androgen như CPA, megestrol acetate, và spironolactone, nhưng không giống như antiandrogens không steroid như flutamide và bicalutamide, CMA không phải là một nhân vật phản diện im lặng của AR mà là một yếu chủ vận từng phần với công suất để kích hoạt các thụ thể trong không có chất chủ vận hiệu quả hơn như testosterone.[25][50] Trong sinh học thỏ, sự đối kháng AR tương tự đối với CMA và 3α-OH-CMA nhưng thấp hơn đối với 3β-OH-CMA.[4] Cả hai hành động antigonadotropic và antiandrogenic của CMA được cho là có liên quan đến hiệu quả của nó trong điều trị ung thư tuyến tiền liệt.[13]
Khi CMA liều thấp được kết hợp với EE, như trong thuốc tránh thai kết hợp, hoạt tính chống ung thư của CMA được củng cố, do sự gia tăng lớn nồng độ globulin gắn với hormone giới tính (SHBG) và do đó giảm nồng độ testosterone tự do do EE gây ra.[25][51] Không giống như proestin 19-nortestosterone như levonorgestrel, CMA không đối kháng với sự gia tăng do EEB gây ra ở mức SHBG.[25][51]
Các hoạt động khác[sửa | sửa mã nguồn]
Tương tự như vậy để dẫn xuất 17α-hydroxyprogesterone khác như CPA, medroxyprogesterone acetate, và megestrol acetate, CMA có ái lực yếu cho các thụ thể glucocorticoid (tương đương với progesterone) và yếu glucocorticoid hoạt động, và có khả năng gây suy thượng thận khi ngưng đột ngột tại đủ liều lượng.[25][52][53] Tuy nhiên, thuốc cho thấy hoạt động glucocorticoid đáng kể chỉ với liều lượng cao hơn nhiều so với những thuốc có trong thuốc tránh thai.[3] Trong sinh trắc nghiệm thỏ, GR kích hoạt là cao nhất đối với CMA nhưng ít hơn cho 3α-OH-CMA và không quan sát với 3β-OH-CMA (gợi ý rằng nó có thể, ngược lại, là một thấp hiệu quả chủ vận từng phần hoặc chất đối kháng của GR).[4] CMA không có ái lực với các thụ thể estrogen hoặc mineralocorticoid và không có hoạt tính estrogen hoặc antimineralocorticoid.[1][3][5] Không giống như progesterone nhưng tương tự như các proestin khác, CMA không có hoạt tính neurosteroid đã biết (ví dụ, điều chế thụ thể GABAA) hoặc tác dụng an thần.[1]
CMA đã được báo cáo là một chất ức chế cạnh tranh của 5α-reductase.[25][54] Tuy nhiên, nó dường như cho thấy tiềm năng rất thấp trong hành động này, với sự ức chế 0,0% của enzyme ở nồng độ 1 Tổ hợp, và liên quan đến điều này, được cho là không có ảnh hưởng quan trọng đến enzyme.[1][5] CMA cũng có thể hoạt động yếu như một chất ức chế sinh tổng hợp testosterone ở liều cao.[3] Không giống như proestin 19-nortestosterone, CMA không ức chế các enzyme trong hệ thống cytochrom P450, điều này có thể làm cho nó có nguy cơ tương tác thuốc thấp hơn.[3][5]
Dược động học[sửa | sửa mã nguồn]
Sinh khả dụng đường uống của CMA là 100%, đó là do sự trao đổi chất đầu tiên thấp.[1][3][2] Kết hợp với 30 EEg EE, một đơn 2 mg uống CMA tạo ra nồng độ tối đa trong huyết thanh là 1,6 ng/mL sau khoảng 1 đến 2 giờ và quản trị mãn tính tạo ra mức độ ổn định 2.0 ng/mL.[1][3][5] Nồng độ CMA ở trạng thái ổn định đạt được sau 7 đến 15 ngày [3][5] Thời gian bán hủy phân phối của CMA là khoảng 2,5 giờ [1][2][6] Thuốc rất ưa lipid và được hấp thụ và tích lũy trong chất béo và một số mô sinh sản nữ, mặc dù điều này chỉ có thể xảy ra ở liều cao (ví dụ, ≥10 mg / ngày.[1][3] Khối lượng phân phối của CMA chưa được biết, nhưng CPA của steroid liên quan chặt chẽ rất lớn ở mức 1.300 L.[3] Liên kết protein huyết tương của CMA là 96,6 đến 99,4%, với khoảng 1 đến 3% tự do.[1][3] Nó liên kết với albumin, không có ái lực với SHBG hoặc globulin gắn với corticosteroid.[1]
CMA được chuyển hóa rộng rãi ở gan bằng cách khử, hydroxyl hóa, khử acetyl và liên hợp.[1][3] Sự khử xảy ra ở ketone C3 với sự bảo toàn của liên kết đôi δ 4 (5), hydroxyl hóa ở các vị trí C2α, C3α, C3, và C15 C, và liên hợp bao gồm glucuronid hóa và sunfat hóa.[1] Các chất chuyển hóa chính của CMA là 2α-OH-CMA, 3α-OH-CMA và 3β-OH-CMA, với hai chất sau là các chất chuyển hóa hoạt động quan trọng.[3][4] Các chất chuyển hóa khác của CMA không hoạt động.[3] Thời gian bán hủy của CMA đã được báo cáo là từ 25 đến 34 giờ sau một liều duy nhất và 34 đến 39 vài giờ sau khi dùng nhiều liều, mặc dù một số ấn phẩm đã báo cáo thời gian bán hủy của nó dài tới 80 đến 89 giờ [1][3][5][6][25] Tái hấp thu đường ruột của CMA xảy ra.[3] Thuốc đã được tìm thấy được bài tiết 33 đến 45% qua nước tiểu và 24 đến 41% qua phân, cũng như qua mật.[1][3][6] Chỉ 74% liều dùng được bài tiết 7 ngày sau khi dùng, đó là do sự tích lũy CMA trong các mô và độ thanh thải thấp.[1]
Hóa học[sửa | sửa mã nguồn]
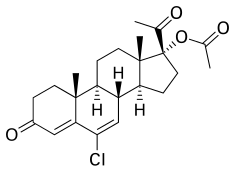
CMA, còn được gọi là 17α-acetoxy-6-chloro-6-dehydroprogesterone hoặc 17α-acetoxy-6-chloropregna-4,6-diene-3,20-dione, là một steroid mang thai tổng hợp và dẫn xuất của progesterone.[55][56] Nó đặc biệt là một dẫn xuất của 17α-hydroxyprogesterone với một nguyên tử clo ở vị trí C6, liên kết đôi giữa vị trí C6 và C7 và este axetat ở vị trí C17α.[55][56] CMA là este acetate C17α của chlormadinone, trái ngược với CMA, không bao giờ được bán trên thị trường.[55][56] Các chất tương tự của CMA bao gồm các dẫn xuất 17α-hydroxyprogesterone khác như CPA, delmadinone axetat, hydroxyprogesterone caproate, medroxyprogesterone axetat, megestrol axetat và osaterone axetat.[55][56] CMA có cấu trúc hóa học giống hệt với CPA ngoại trừ việc nó thiếu sự thay thế 1α, 2α- methylene của CPA.[55][56] Cấu trúc của CMA cũng gần giống với cấu trúc của delmadinone acetate và osaterone acetate, tương tự có sửa đổi vòng A.[55][56]
Tổng hợp[sửa | sửa mã nguồn]
Tổng hợp hóa học của CMA đã được công bố.[35][57][58][59]
Tham khảo[sửa | sửa mã nguồn]
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai Kuhl H (2005). “Pharmacology of estrogens and progestogens: influence of different routes of administration” (PDF). Climacteric. 8 Suppl 1: 3–63. doi:10.1080/13697130500148875. PMID 16112947.
- ^ a b c d Roger Lobo; P.G. Crosignani; Rodolfo Paoletti (ngày 31 tháng 10 năm 2002). Women's Health and Menopause: New Strategies - Improved Quality of Life. Springer Science & Business Media. tr. 94–. ISBN 978-1-4020-7149-2. Lỗi chú thích: Thẻ
<ref>không hợp lệ: tên “LoboCrosignani2002” được định rõ nhiều lần, mỗi lần có nội dung khác - ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai Raudrant D, Rabe T (2003). “Progestogens with antiandrogenic properties”. Drugs. 63 (5): 463–92. doi:10.2165/00003495-200363050-00003. PMID 12600226.
- ^ a b c d e f g Schneider J, Kneip C, Jahnel U (2009). “Comparative effects of chlormadinone acetate and its 3alpha- and 3beta-hydroxy metabolites on progesterone, androgen and glucocorticoid receptors”. Pharmacology. 84 (2): 74–81. doi:10.1159/000226601. ISSN 1423-0313. PMID 19590256.
- ^ a b c d e f g h i j k l m Bouchard P (2005). “Chlormadinone acetate (CMA) in oral contraception--a new opportunity”. The European Journal of Contraception & Reproductive Health Care. 10 Suppl 1: 7–11. doi:10.1080/13625180500434889. PMID 16356876.
- ^ a b c d e f Fotherby K (1974). “Metabolism of synthetic steroids by animals and man”. Acta Endocrinol Suppl (Copenh). 185: 119–47. doi:10.1530/acta.0.075S119. PMID 4206183.
- ^ a b c d e f g h i j k l m A. Hughes; S. H. Hasan; G. W. Oertel; H. E. Voss; F. Bahner; F. Neumann; H. Steinbeck; K.-J. Gräf; J. Brotherton (ngày 27 tháng 11 năm 2013). Androgens II and Antiandrogens / Androgene II und Antiandrogene. Springer Science & Business Media. tr. 490, 508, 516–517, 524, 531. ISBN 978-3-642-80859-3.
- ^ a b Jack H. Mydlo; Ciril J. Godec (ngày 11 tháng 7 năm 2003). Prostate Cancer: Science and Clinical Practice. Academic Press. tr. 437–. ISBN 978-0-08-049789-1.
- ^ a b Kanimoto Y, Okada K (tháng 11 năm 1991). “[Antiandrogen therapy of benign prostatic hyperplasia--review of the agents evaluation of the clinical results]”. Hinyokika Kiyo (bằng tiếng Nhật). 37 (11): 1423–8. PMID 1722627.
- ^ a b Ishizuka O, Nishizawa O, Hirao Y, Ohshima S (tháng 11 năm 2002). “Evidence-based meta-analysis of pharmacotherapy for benign prostatic hypertrophy”. Int. J. Urol. 9 (11): 607–12. doi:10.1046/j.1442-2042.2002.00539.x. PMID 12534901.
- ^ a b c d e “Chlormadinone”.
- ^ a b c d e f Kumamoto Y, Yamaguchi Y, Sato Y, Suzuki R, Tanda H, Kato S, Mori K, Matsumoto H, Maki A, Kadono M (tháng 2 năm 1990). “[Effects of anti-androgens on sexual function. Double-blind comparative studies on allylestrenol and chlormadinone acetate Part I: Nocturnal penile tumescence monitoring]” (PDF). Hinyokika Kiyo (bằng tiếng Nhật). 36 (2): 213–26. PMID 1693037.
- ^ a b c d e f Fourcade RO, Chatelain C (tháng 7 năm 1998). “Androgen deprivation for prostatic carcinoma: a rationale for choosing components”. Int. J. Urol. 5 (4): 303–11. doi:10.1111/j.1442-2042.1998.tb00356.x. PMID 9712436.
- ^ a b H.J.T. Coelingh Benni; H.M. Vemer (ngày 15 tháng 12 năm 1990). Chronic Hyperandrogenic Anovulation. CRC Press. tr. 151–. ISBN 978-1-85070-322-8.
- ^ a b Chassard D, Schatz B (2005). “[The antigonadrotropic activity of chlormadinone acetate in reproductive women]”. Gynécologie, Obstétrique & Fertilité (bằng tiếng Pháp). 33 (1–2): 29–34. doi:10.1016/j.gyobfe.2004.12.002. PMID 15752663.
- ^ Howard J.A. Carp (ngày 9 tháng 4 năm 2015). Progestogens in Obstetrics and Gynecology. Springer. tr. 37–38. ISBN 978-3-319-14385-9.
The first progesterone derivative 17-acetoxyprogesterone was developed by Schering in 1954 followed by medroxyprogesterone acetate in 1957. This was followed by [megestrol] acetate and chlormadinone acetate in 1959.
- ^ Richard Patterson (ngày 21 tháng 12 năm 2012). Drugs in Litigation: Damage Awards Involving Prescription and Nonprescription Drugs. LexisNexis. tr. 184–. ISBN 978-0-327-18698-4.
- ^ Robert Bud; Bernard S. Finn; Helmuth Trischler (1999). Manifesting Medicine: Bodies and Machines. Taylor & Francis. tr. 113–. ISBN 978-90-5702-408-5.
- ^ John David Gordon (2007). Obstetrics, Gynecology & Infertility: Handbook for Clinicians. Scrub Hill Press, Inc. tr. 229–. ISBN 978-0-9645467-7-6.
- ^ C.H. Lingeman (ngày 6 tháng 12 năm 2012). Carcinogenic Hormones. Springer Science & Business Media. tr. 149–. ISBN 978-3-642-81267-5.
- ^ Christian Streffer; H. Bolt; D. Follesdal; P. Hall; J.G. Hengstler; P. Jacob; D. Oughton; K. Prieß; E. Rehbinder (ngày 11 tháng 11 năm 2013). Low Dose Exposures in the Environment: Dose-Effect Relations and Risk Evaluation. Springer Science & Business Media. tr. 135–. ISBN 978-3-662-08422-9.
- ^ Gisela Dallenbach-Hellweg (ngày 9 tháng 3 năm 2013). Histopathology of the Endometrium. Springer Science & Business Media. tr. 183–. ISBN 978-3-662-07788-7.
- ^ a b S D Gangolli (ngày 31 tháng 10 năm 2007). The Dictionary of Substances and their Effects (DOSE). Royal Society of Chemistry. tr. 250–251. ISBN 978-1-84755-754-4.
- ^ a b c d Sweetman, Sean C. biên tập (2009). “Sex hormones and their modulators”. Martindale: The Complete Drug Reference (ấn bản 36). London: Pharmaceutical Press. tr. 2084. ISBN 978-0-85369-840-1.
- ^ a b c d e f g h i j k Druckmann R (tháng 4 năm 2009). “Profile of the progesterone derivative chlormadinone acetate - pharmocodynamic properties and therapeutic applications”. Contraception. 79 (4): 272–81. doi:10.1016/j.contraception.2008.10.017. PMID 19272496.
- ^ Jeffrey K. Aronson (ngày 21 tháng 2 năm 2009). Meyler's Side Effects of Endocrine and Metabolic Drugs. Elsevier. tr. 214–. ISBN 978-0-08-093292-7.
- ^ a b Caruso S, Rugolo S, Agnello C, Romano M, Cianci A (tháng 12 năm 2009). “Quality of sexual life in hyperandrogenic women treated with an oral contraceptive containing chlormadinone acetate”. J Sex Med. 6 (12): 3376–84. doi:10.1111/j.1743-6109.2009.01529.x. PMID 19832931.
- ^ Venner P (1992). “Megestrol acetate in the treatment of metastatic carcinoma of the prostate”. Oncology. 49 Suppl 2 (2): 22–7. doi:10.1159/000227123. PMID 1461622.
- ^ B. Gabard; P. Elsner; C. Surber; P. Treffel (ngày 28 tháng 6 năm 2011). Dermatopharmacology of Topical Preparations: A Product Development-Oriented Approach. Springer Science & Business Media. tr. 279–. ISBN 978-3-642-57145-9.
- ^ Masumori N (tháng 5 năm 2012). “Status of sex reassignment surgery for gender identity disorder in Japan”. Int. J. Urol. 19 (5): 402–14. doi:10.1111/j.1442-2042.2012.02975.x. PMID 22372595.
- ^ Kotake T, Usami M, Akaza H, Koiso K, Homma Y, Kawabe K, Aso Y, Orikasa S, Shimazaki J, Isaka S, Yoshida O, Hirao Y, Okajima E, Naito S, Kumazawa J, Kanetake H, Saito Y, Ohi Y, Ohashi Y (tháng 11 năm 1999). “Goserelin acetate with or without antiandrogen or estrogen in the treatment of patients with advanced prostate cancer: a multicenter, randomized, controlled trial in Japan. Zoladex Study Group”. Jpn. J. Clin. Oncol. 29 (11): 562–70. doi:10.1093/jjco/29.11.562. PMID 10678560.
- ^ IARC Working Group on the Evaluation of Carcinogenic Risks to Humans; World Health Organization; International Agency for Research on Cancer (2007). Combined Estrogen-progestogen Contraceptives and Combined Estrogen-progestogen Menopausal Therapy. World Health Organization. tr. 44, 434. ISBN 978-92-832-1291-1.
- ^ William Berrebi (ngày 20 tháng 11 năm 2009). Diagnostics et thérapeutique de poche: Guide pratique du symptôme à la prescription. Armando Editore. tr. 534–. ISBN 978-2-84371-485-6.
- ^ Besnard–Charvet Christelle (ngày 21 tháng 10 năm 2014). Homeopatie & perimenopauza. Grada Publishing, a.s. tr. 61–. ISBN 978-80-247-5191-7.
- ^ a b Jürgen Engel; Axel Kleemann; Bernhard Kutscher; Dietmar Reichert (ngày 14 tháng 5 năm 2014). Pharmaceutical Substances, 5th Edition, 2009: Syntheses, Patents and Applications of the most relevant APIs. Thieme. tr. 273–274. ISBN 978-3-13-179275-4.
- ^ A. Labhart (ngày 6 tháng 12 năm 2012). Clinical Endocrinology: Theory and Practice. Springer Science & Business Media. tr. 575–. ISBN 978-3-642-96158-8.
- ^ Gómez Vázquez M, Navarra Amayuelas R, Lamarca M, Baquedano L, Romero Ruiz S, Vilar-Checa E, Iniesta MD (tháng 9 năm 2011). “Ethinylestradiol/Chlormadinone acetate for use in dermatological disorders”. Am J Clin Dermatol. 12 Suppl 1: 13–9. doi:10.2165/1153875-S0-000000000-00000. PMID 21895045.
- ^ Thomas H. Shepard; Ronald J. Lemire (2004). Catalog of Teratogenic Agents. JHU Press. tr. 80–. ISBN 978-0-8018-7953-1.
- ^ Sturdee DW (2013). “Are progestins really necessary as part of a combined HRT regimen?”. Climacteric. 16 Suppl 1: 79–84. doi:10.3109/13697137.2013.803311. PMID 23651281.
- ^ a b Rabe T, Feldmann K, Heinemann L, Runnebaum B (tháng 1 năm 1996). “Cyproterone acetate: is it hepato- or genotoxic?”. Drug Saf. 14 (1): 25–38. doi:10.2165/00002018-199614010-00004. PMID 8713486.
In principle, DNA adduct formation is not unique for CPA. DNA adducts in the rat liver were also found after in vitro incubation with megestrol and chlormadinone, as well as after in vivo exposure with both these compounds and with ethinylestradiol. [8-11] However, the adduct level generated by chlormadinone and megestrol is about 30 to 50 times lower than that after CPA.[12] [...] with chlormadinone [acetate] we found 5 liver cell adenomas, 5 focal nodular hyperplasias and 1 liver cell carcinoma.
- ^ a b Brambilla G, Martelli A (tháng 12 năm 2002). “Are some progestins genotoxic liver carcinogens?”. Mutat. Res. 512 (2–3): 155–63. doi:10.1016/S1383-5742(02)00047-9. PMID 12464349.
- ^ a b Werner S, Kunz S, Beckurts T, Heidecke CD, Wolff T, Schwarz LR (tháng 12 năm 1997). “Formation of DNA adducts by cyproterone acetate and some structural analogues in primary cultures of human hepatocytes”. Mutat. Res. 395 (2–3): 179–87. doi:10.1016/S1383-5718(97)00167-8. PMID 9465929.
- ^ a b c Martelli A, Brambilla Campart G, Ghia M, Allavena A, Mereto E, Brambilla G (tháng 3 năm 1996). “Induction of micronuclei and initiation of enzyme-altered foci in the liver of female rats treated with cyproterone acetate, chlormadinone acetate, or megestrol acetate”. Carcinogenesis. 17 (3): 551–4. doi:10.1093/carcin/17.3.551. PMID 8631143.
- ^ Martelli A, Mattioli F, Ghia M, Mereto E, Brambilla G (tháng 5 năm 1996). “Comparative study of DNA repair induced by cyproterone acetate, chlormadinone acetate and megestrol acetate in primary cultures of human and rat hepatocytes”. Carcinogenesis. 17 (5): 1153–6. doi:10.1093/carcin/17.5.1153. PMID 8640927.
- ^ Siddique, Y.H., T. Beg and M. Afzal, 2008. Structural Relationships of Some Synthetic Progestins and their Genotoxic Effects. In: Recent Trends in Toxicology, Siddique, Y.H. (Ed.). Transworld Research Network, Trivandrum, Kerala, India, pp: 75-84. 978-81-7895-384-7
- ^ Popelier G (tháng 5 năm 1973). “[Treatment of the carcinoma of the prostate with gestagens (author's transl)]”. Urologe A (bằng tiếng Đức). 12 (3): 134–9. PMID 4127418.
- ^ Edgren RA, Sturtevant FM (tháng 8 năm 1976). “Potencies of oral contraceptives”. Am. J. Obstet. Gynecol. 125 (8): 1029–38. doi:10.1016/0002-9378(76)90804-8. PMID 952300.
- ^ a b Bingel AS, Benoit PS (tháng 2 năm 1973). “Oral contraceptives: therapeutics versus adverse reactions, with an outlook for the future I”. J Pharm Sci. 62 (2): 179–200. doi:10.1002/jps.2600620202. PMID 4568621.
- ^ a b Katayama T, Umeda K, Kazama T (tháng 11 năm 1986). “[Hormonal environment and antiandrogenic treatment in benign prostatic hypertrophy]”. Hinyokika Kiyo (bằng tiếng Nhật). 32 (11): 1584–9. PMID 2435122.
- ^ Luthy IA, Begin DJ, Labrie F (1988). “Androgenic activity of synthetic progestins and spironolactone in androgen-sensitive mouse mammary carcinoma (Shionogi) cells in culture”. J. Steroid Biochem. 31 (5): 845–52. doi:10.1016/0022-4731(88)90295-6. PMID 2462135.
- ^ a b Curran MP, Wagstaff AJ (2004). “Ethinylestradiol/chlormadinone acetate”. Drugs. 64 (7): 751–60, discussion 761–2. doi:10.2165/00003495-200464070-00005. PMID 15025547.
- ^ John A. Thomas (ngày 12 tháng 3 năm 1997). Endocrine Toxicology, Second Edition. CRC Press. tr. 152–. ISBN 978-1-4398-1048-4.
- ^ Nick Panay (ngày 31 tháng 8 năm 2015). Managing the Menopause. Cambridge University Press. tr. 126–. ISBN 978-1-107-45182-7.
- ^ Thomas L. Lemke; David A. Williams (ngày 24 tháng 1 năm 2012). Foye's Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. tr. 1404–. ISBN 978-1-60913-345-0.
- ^ a b c d e f J. Elks (ngày 14 tháng 11 năm 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. tr. 247–. ISBN 978-1-4757-2085-3.
- ^ a b c d e f Index Nominum 2000: International Drug Directory. Taylor & Francis US. 2000. tr. 215. ISBN 978-3-88763-075-1. Truy cập ngày 29 tháng 5 năm 2012.
- ^ William Andrew Publishing (ngày 22 tháng 10 năm 2013). Pharmaceutical Manufacturing Encyclopedia, 3rd Edition. Elsevier. tr. 966–967. ISBN 978-0-8155-1856-3.
- ^ Ringold, H. J.; Batres, E.; Bowers, A.; Edwards, J.; Zderic, J. (1959). “Steroids. CXXVII.16-Halo Progestational Agents”. Journal of the American Chemical Society. 81 (13): 3485–3486. doi:10.1021/ja01522a090. ISSN 0002-7863.
- ^ Langbein, G., Menzer, E., Meyer, M., & Wesemann, R. (1973). New Synthesis of 17alpha Acetoxy-6-Chloro-6-Dehydroprogesterone (Chlormadinone) on 3, 5, 6, 7-Tetrasubstituted Intermediates. Journal Fur Praktische Chemie, 315(1), 8-22.
Đọc thêm[sửa | sửa mã nguồn]
- Furuya S, Furuya R, Ogura H, Shimamura S, Araki T (tháng 3 năm 2005). “[Transurethral resection for prostatic adenoma larger than 100 ml--preoperative treatment with interstitial laser coagulation of the prostate plus chlormadinone acetate as a treatment maneuver for safer operations]”. Hinyokika Kiyo (bằng tiếng Nhật). 51 (3): 159–64. PMID 15852668.
- Bouchard P (2005). “Chlormadinone acetate (CMA) in oral contraception--a new opportunity”. Eur J Contracept Reprod Health Care. 10 Suppl 1: 7–11. doi:10.1080/13625180500434889. PMID 16356876.
- Druckmann R (tháng 4 năm 2009). “Profile of the progesterone derivative chlormadinone acetate - pharmocodynamic properties and therapeutic applications”. Contraception. 79 (4): 272–81. doi:10.1016/j.contraception.2008.10.017. PMID 19272496.
- Guerra-Tapia A, Sancho Pérez B (tháng 9 năm 2011). “Ethinylestradiol/Chlormadinone acetate: dermatological benefits”. Am J Clin Dermatol. 12 Suppl 1: 3–11. doi:10.2165/1153874-S0-000000000-00000. PMID 21895044.
- Barriga PP, Ambrosi Penazzo N, Franco Finotti M, Celis AA, Cerdas O, Chávez JA, Cuitiño LA, Fernandes CE, Plata MA, Tirán-Saucedo J, Vanhauwaert PS (tháng 7 năm 2016). “At 10 years of chlormadinone use in Latin America: a review”. Gynecol. Endocrinol. 32 (7): 517–20. doi:10.3109/09513590.2016.1153059. PMID 27113551.
