Bromoform
| Bromoform | |||
|---|---|---|---|
| |||
 | |||
| Danh pháp IUPAC | Tribromomethane[1] | ||
| Tên khác | |||
| Nhận dạng | |||
| Viết tắt |
| ||
| Số CAS | |||
| PubChem | |||
| Số EINECS | |||
| DrugBank | DB03054 | ||
| KEGG | |||
| MeSH | |||
| ChEBI | |||
| Số RTECS | PB5600000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| InChI | đầy đủ
| ||
| ChemSpider | |||
| Tham chiếu Beilstein | 1731048 | ||
| Tham chiếu Gmelin | 49500 | ||
| Thuộc tính | |||
| Công thức phân tử | CHBr3 | ||
| Bề ngoài | Chất lỏng không màu | ||
| Khối lượng riêng | 2,89 g mL−1 | ||
| Điểm nóng chảy | −4 đến 16 °C; 269 đến 289 K; 25 đến 61 °F | ||
| Điểm sôi | 147 đến 151 °C; 420 đến 424 K; 296 đến 304 °F | ||
| Độ hòa tan trong nước | 3,2 g L−1 (ở 30 °C) | ||
| log P | 2,435 | ||
| Áp suất hơi | 670 Pa (ở 20 °C) | ||
| kH | 17 μmol Pa−1 kg−1 | ||
| Độ axit (pKa) | 13,7 | ||
| MagSus | -82,60·10−6 cm3/mol | ||
| Chiết suất (nD) | 1,595 | ||
| Nhiệt hóa học | |||
| Enthalpy hình thành ΔfH | 6,1–12,7 kJ mol−1 | ||
| DeltaHc | −549,1–−542,5 kJ mol−1 | ||
| Nhiệt dung | 130,5 J K−1 mol−1 | ||
| Các nguy hiểm | |||
| NFPA 704 |
| ||
| PEL | TWA 0,5 ppm (5 mg/m3) [da][2] | ||
| LC50 | 1151 ppm (động vật có vú)[3] | ||
| LD50 | 933,0 mg kg−1 (miệng, chuột) | ||
| REL | TWA 0,5 ppm (5 mg/m3) [da][2] | ||
| IDLH | 850 ppm[2] | ||
| Ký hiệu GHS |   | ||
| Báo hiệu GHS | DANGER | ||
| Chỉ dẫn nguy hiểm GHS | H302, H315, H319, H331, H411 | ||
| Chỉ dẫn phòng ngừa GHS | P261, P273, P305+P351+P338, P311 | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Bromoform (CHBr3) là một dung môi hữu cơ brom hóa và là chất lỏng không màu ở nhiệt độ phòng, có chiết suất cao, tỷ trọng rất cao và mùi ngọt tương tự như mùi của chloroform. Nó là một trong bốn dạng trihalogenomethan, những dạng khác là fluoroform, chloroform và iodoform. Bromoform có thể được điều chế bằng phản ứng halogenoform sử dụng aceton và natri hypobromit, bằng cách điện phân kali bromide trong ethanol, hoặc bằng cách xử lý chloroform bằng nhôm bromide. Hiện tại công dụng chính của nó là làm thuốc thử trong phòng thí nghiệm.

Cấu trúc
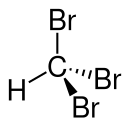
[sửa | sửa mã nguồn]Phân tử có cấu trúc tứ diện với đối xứng C3v.
Sử dụng
[sửa | sửa mã nguồn]Hiện chỉ có một lượng nhỏ bromoform được sản xuất công nghiệp ở Hoa Kỳ. Trong quá khứ, nó được sử dụng như một dung môi, thuốc an thần và chất chống cháy, nhưng bây giờ nó chủ yếu được sử dụng như một chất phản ứng trong phòng thí nghiệm, ví dụ như một dung môi chiết xuất[4].
Bromoform cũng có công dụng trong y tế, thuốc tiêm bromoform đôi khi được sử dụng thay cho adrenalin để điều trị các trường hợp hen suyễn nặng.
Khối lượng riêng lớn của bromoform làm cho nó hữu ích để tách các khoáng vật theo tỉ trọng[5]. Khi trộn hai mẫu với bromoform và sau đó để lắng, lớp trên cùng sẽ chứa các khoáng chất ít đậm đặc hơn bromoform, và lớp dưới cùng sẽ chứa các khoáng chất đậm đặc hơn. Các khoáng chất ít đậm đặc hơn một chút có thể được tách theo cách tương tự bằng cách trộn bromoform với một lượng nhỏ dung môi ít đặc hơn và có thể trộn lẫn.
Bromoform được biết đến như một chất ức chế quá trình tạo methanogenesis và là một thành phần phổ biến của rong biển. Sau nghiên cứu của CSIRO và FutureFeed, một số công ty hiện đang trồng rong biển, đặc biệt là từ chi Măng tây, để sử dụng làm phụ gia thực phẩm cho vật nuôi nhằm giảm lượng khí thải methan từ động vật nhai lại[6].
Vấn đề môi trường và độc tính
[sửa | sửa mã nguồn]Bromoform được sản xuất tự nhiên bởi thực vật phù du và rong biển ở đại dương và được cho là nguồn gốc chủ yếu của nó trong môi trường[7]. Tuy nhiên, một lượng đáng kể bromoform xâm nhập vào môi trường được hình thành dưới dạng phụ phẩm khử trùng là các trihalogenomethan khi chlor được thêm vào nước uống để tiêu diệt vi khuẩn. Nó hòa tan trong nước và dễ dàng bay hơi vào không khí. Bromoform là trihalogenomethan chính được tạo ra trong các bể bơi nước mặn bên bờ biển với nồng độ cao tới 1,2 ppm (phần triệu). Nồng độ trong các bể bơi nước ngọt thấp hơn 1000 lần[8]. Giới hạn phơi nhiễm da nghề nghiệp được đặt ở mức 0,5 ppm[9].
Chất này có thể nguy hiểm cho môi trường và cần đặc biệt chú ý đến các sinh vật sống dưới nước. Tính dễ bay hơi và tính bền vững trong môi trường của nó làm cho việc giải phóng bromoform, ở dạng lỏng hoặc hơi, rất khó nhận thấy.
Bromoform có thể được hấp thụ vào cơ thể thông qua đường hô hấp và qua da. Chất này gây khó chịu cho đường hô hấp, mắt và da, có thể gây ảnh hưởng đến hệ thần kinh trung ương và gan, làm suy giảm các chức năng. Nó có thể hòa tan với khoảng 800 phần nước và có thể trộn lẫn với rượu, benzen, chloroform, ether, xăng ether, aceton và các loại dầu. LD50 của nó là 7,2 mmol/kg ở chuột, hoặc 1,8g/kg. Cơ quan Nghiên cứu Ung thư Quốc tế (IARC) kết luận rằng bromoform không thể phân loại được về khả năng gây ung thư ở người. EPA đã phân loại bromoform là chất có thể gây ung thư ở người[10][11].
Tham khảo
[sửa | sửa mã nguồn]- Betterton E. A.; Arnold R. G.; Kuhler R. J.; Santo G. A. (tháng 6 năm 2005). “Reductive dehalogenation of bromoform in aqueous solution”. Environ. Health Perspect. Brogan &. 103: 89–91(3). doi:10.2307/3432487. JSTOR 3432487. PMC 1519304. PMID 8565919. PDF
- U.S. Department of Health and Human Services. Toxicological Profile for Bromoform and Dibromochloromethane [1]. August 2005.
- ^ a b Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. tr. 661. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
The retained names ‘bromoform’ for HCBr3, ‘chloroform’ for HCCl3, and ‘iodoform’ for HCI3 are acceptable in general nomenclature. Preferred IUPAC names are substitutive names.
- ^ a b c d e “NIOSH Pocket Guide to Chemical Hazards #0066”. Viện An toàn và Sức khỏe Nghề nghiệp Quốc gia Hoa Kỳ (NIOSH).
- ^ “Bromoform”. Nguy hiểm ngay lập tức đến tính mạng hoặc sức khỏe. Viện An toàn và Sức khỏe Nghề nghiệp Quốc gia Hoa Kỳ (NIOSH).
- ^ “What is the use of bromoform?”. actingcollegeses.com. Lưu trữ bản gốc ngày 29 tháng 8 năm 2022. Truy cập ngày 28 tháng 8 năm 2022.
- ^ Betterton E. A., Arnold R. G. (tháng 6 năm 2005). “Reductive dehalogenation of bromoform in aqueous solution”. Environ Health Perspect. 103: 89–91(3). Bản gốc lưu trữ ngày 1 tháng 8 năm 2013. Truy cập ngày 29 tháng 8 năm 2022.
- ^ “Is seaweed the solution to agriculture's methane problem?”. Phyconomy (bằng tiếng Anh). Lưu trữ bản gốc ngày 9 tháng 11 năm 2020. Truy cập ngày 13 tháng 11 năm 2020.
- ^ Palmer C J and Reason C J (2009), Relationships of surface bromoform concentrations with mixed layer depth and salinity in the tropical oceans (2009), Global Biogeochemical Cycles, 23, GB2014.
- ^ Beech AJ et al (1980) Nitrates, Chlorates and Trihalomethanes in Swimming Pool Water. Am J Public Health, 70(1), 79-82
- ^ “CDC - NIOSH Pocket Guide to Chemical Hazards - Bromoform”. www.cdc.gov. Lưu trữ bản gốc ngày 23 tháng 4 năm 2022. Truy cập ngày 28 tháng 8 năm 2022.
- ^ “BROMOFORM” (PDF). 15 tháng 6 năm 2009. Lưu trữ (PDF) bản gốc ngày 28 tháng 8 năm 2022. Truy cập Ngày 28 tháng 8 năm 2022.
- ^ “ToxFAQs™ - Letter A | Toxic Substance Portal | ATSDR”. wwwn.cdc.gov. Lưu trữ bản gốc ngày 13 tháng 8 năm 2022. Truy cập ngày 28 tháng 8 năm 2022.
Liên kết ngoài
[sửa | sửa mã nguồn]- Thẻ an toàn hóa chất quốc tế 0108
- “NIOSH Pocket Guide to Chemical Hazards #0066”. Viện An toàn và Sức khỏe Nghề nghiệp Quốc gia Hoa Kỳ (NIOSH).
- Entry at chemicalland21.com
- Toxicological profile for bromoform and dibromochlormethane
- Toxicity summary
- IARC Summaries & Evaluations: Vol. 62 (1991), Vol. 71 (1999)
- ChemSub Online: Bromoform