Osmi(VIII) oxide
| Osmi(VIII) oxide | |||
|---|---|---|---|
| |||
 | |||
| Tên hệ thống | Tetraoxoosmium | ||
| Tên khác | Osmi tetroxide | ||
| Nhận dạng | |||
| Số CAS | |||
| PubChem | |||
| Số EINECS | |||
| MeSH | |||
| ChEBI | |||
| Số RTECS | RN1140000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| InChI | đầy đủ
| ||
| ChemSpider | |||
| Thuộc tính | |||
| Công thức phân tử | OsO4 | ||
| Khối lượng mol | 254,2276 g/mol | ||
| Bề ngoài | chất rắn bay hơi trắng | ||
| Mùi | acid, giống mùi chlor | ||
| Khối lượng riêng | 4,9 g/cm³[1] | ||
| Điểm nóng chảy | 40,25 °C (313,40 K; 104,45 °F) | ||
| Điểm sôi | 129,7 °C (402,8 K; 265,5 °F) | ||
| Độ hòa tan trong nước | 5,7 g/100 mL (10 ℃) 6,23 g/100 mL (25 ℃) | ||
| Độ hòa tan | 375 g/100 mL (CCl4) tan trong hầu hết các dung môi hữu cơ, amoni hydroxide, phosphor oxytrichloride tạo phức với amonia | ||
| Áp suất hơi | 7 mmHg (20 ℃)[2] | ||
| Cấu trúc | |||
| Cấu trúc tinh thể | đơn nghiêng, mS20 | ||
| Nhóm không gian | C2/c | ||
| Hằng số mạng | a = 9,379 Å, b = 4,515 Å, c = 8,630 Å | ||
| Hình dạng phân tử | tứ diện | ||
| Các nguy hiểm | |||
| Phân loại của EU | |||
| Nguy hiểm chính | rất độc | ||
| NFPA 704 |
| ||
| Chỉ dẫn R | R26/27/28, R34 | ||
| Chỉ dẫn S | (S1/2), S7/9, S26, S45 | ||
| PEL | TWA 0,002 mg/m³[2] | ||
| REL | TWA 0,002 mg/m³ (0,0002 ppm) ST 0,006 mg/m³ (0,0006 ppm)[2] | ||
| IDLH | 1 mg/m³[2] | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Osmi(VIII) oxide, còn được gọi với cái tên osmi tetroxide là một hợp chất vô cơ có thành phần chính gồm hai nguyên tố là osmi và oxy có công thức hóa học OsO4. Hợp chất này đáng chú ý vì nhiều công dụng của nó, mặc dù độc tính của nó gây nguy hiểm và sự hiếm có của nguyên tố osmi. Nó cũng có một số tính chất thú vị, một trong số đó, hợp chất này tuy là chất rắn, nhưng rất dễ bay hơi. Hợp chất không màu, nhưng hầu hết các mẫu vật đều có màu vàng.[3] Điều này rất có thể do sự hiện diện của tạp chất OsO2, chất có màu nâu vàng.[4]
Điều chế
[sửa | sửa mã nguồn]Osmi(VIII) oxide có thể được hình thành một cách từ từ khi cho osmi tác dụng với oxy. Nếu sử dụng một lượng lớn chất rắn, cần nhiệt độ đến 400 °C (752 °F; 673 K).[5]
Tính chất
[sửa | sửa mã nguồn]
Osmi(VIII) oxit tạo thành các tinh thể đơn nghiêng.[6][7] Nó có mùi chlor đặc trưng. OsO4 dễ bay hơi: nó thăng hoa ở nhiệt độ phòng. Nó hòa tan trong nhiều loại dung môi hữu cơ, hòa tan vừa phải trong nước, với phản ứng thuận nghịch để tạo thành axit hyperosmic (xem bên dưới).[8] Osmi(VIII) oxide "tinh khiết" có thể không màu;[9] có ý kiến cho rằng màu vàng của nó là do tạp chất osmi(IV) oxide (OsO2).[10] Phân tử osmi(VIII) oxide có dạng tứ diện và do đó không phân cực. Tính không phân cực này giúp OsO4 xuyên qua màng tế bào tích điện.
Phản ứng
[sửa | sửa mã nguồn]Osmi(VIII) oxide tan được trong nước, kèm phản ứng tạo acid hyperosmic. Dung dịch này được coi là không màu (hầu như không có màu vàng đặc trưng).[11]
- OsO4 + H2O → H2OsO5
Các ion hyperosmat, OsO52− và bihyperosmat, HOsO5− có màu vàng cam.[12] Thực tế, công thức H2OsO5 chỉ là công thức đơn giản cho hợp chất này. Thành phần chính xác của dung dịch “acid hyperosmic” nói trên vẫn chưa được biết, do đó công thức của “acid hyperosmic” có thể được biểu diễn dưới dạng H2nOsO4 + n.[11]
Nguy hại
[sửa | sửa mã nguồn]OsO4 rất độc, thậm chí được phân vào loại hợp chất có mức phơi nhiễm thấp, và phải được xử lý với các biện pháp phòng ngừa thích hợp. Cụ thể, hít ở nồng độ thấp, thấp hơn khả năng nhận biết mùi của người, chất này đã có thể dẫn đến phù phổi và tử vong sau đó. Các triệu chứng đáng chú ý nếu bị phơi nhiễm có thể mất vài giờ để xuất hiện sau khi nhiễm độc.
OsO4 cũng làm đục giác mạc của người, có thể dẫn đến mù mắt nếu không tuân thủ các biện pháp phòng ngừa an toàn thích hợp. Giới hạn tiếp xúc cho phép đối với osmi(VIII) oxide (trung bình khoảng 8 giờ) là 200 μg/m³.[7]
Hợp chất khác
[sửa | sửa mã nguồn]OsO4 còn tạo một số hợp chất với NH3, như OsO4·NH3 là chất rắn màu cam.[13]
Tham khảo
[sửa | sửa mã nguồn]- ^ “Osmium tetroxide ICSC: 0528”. InChem.
- ^ a b c d “NIOSH Pocket Guide to Chemical Hazards #0473”. Viện An toàn và Sức khỏe Nghề nghiệp Quốc gia Hoa Kỳ (NIOSH).
- ^ Girolami, Gregory (2012). “Osmium weighs”. Nature Chemistry. 4: 954. doi:10.1038/nchem.1479.
- ^ Cotton and Wilkinson, Advanced Inorganic Chemistry, tr. 1002.
- ^ Housecroft, C. E.; Sharpe, A. G. (2004). Inorganic Chemistry (ấn bản thứ 2). Prentice Hall. tr. 671–673, 710. ISBN 978-0130399137.
- ^ a b Krebs, B.; Hasse, K. D. (1976). “Refinements of the Crystal Structures of KTcO4, KReO4 and OsO4. The Bond Lengths in Tetrahedral Oxo-Anions and Oxides of d0 Transition Metals”. Acta Crystallographica B. 32 (5): 1334–1337. doi:10.1107/S056774087600530X.
- ^ a b “Osmium tetroxide (as Os)”. Documentation for Immediately Dangerous to Life or Health Concentrations (IDLHs). Centers for Disease Control. 2 tháng 11 năm 2018.
- ^ Thompson, M. “Osmium tetroxide (OsO4)”. Bristol University. Truy cập ngày 7 tháng 4 năm 2012.
- ^ Butler, I. S.; Harrod, J. F. (1989). Inorganic Chemistry: Principles and Applications. Benjamin / Cummings. tr. 343. ISBN 978-0-8053-0247-9. Truy cập ngày 7 tháng 4 năm 2012.
- ^ Cotton, F. A. (2007). Advanced Inorganic Chemistry (ấn bản thứ 6). New Delhi, India: J. Wiley. tr. 1002. ISBN 978-81-265-1338-3.
- ^ a b Pourbaix, Marcel (1963). Atlas d'équilibres électrochimiques (bằng tiếng Pháp). Gauthier-Villars. tr. 370.
- ^ Garche, Jürgen; Dyer, Chris K.; Moseley, Patrick T.; Ogumi, Zempachi; Rand, David A. J.; Scrosati, Bruno (20 tháng 5 năm 2013). Encyclopedia of Electrochemical Power Sources (bằng tiếng Anh). Newnes. tr. 854. ISBN 978-0-444-52745-5.
- ^ Livingstone, Stanley E. (31 tháng 1 năm 2017). The Chemistry of Ruthenium, Rhodium, Palladium, Osmium, Iridium and Platinum: Pergamon Texts in Inorganic Chemistry, Volume 25 (bằng tiếng Anh). Elsevier. tr. 1233. ISBN 978-1-4831-5840-2.

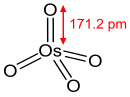


![{\displaystyle {\ce {Os + 2O2 ->[\Delta T] OsO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8d2c2ac06e64cd164869ed5506f13c3cfa320d70)