Khác biệt giữa bản sửa đổi của “DNA”
Không có tóm lược sửa đổi |
Không có tóm lược sửa đổi |
||
| Dòng 343: | Dòng 343: | ||
{{further|Công nghệ nano ADN}} |
{{further|Công nghệ nano ADN}} |
||
Công nghệ nano DNA sử dụng những tính chất tương tác của phân tử DNA và những axit nucleic khác để tạo ra những phức hợp tự lắp ráp DNA có tính năng hữu ích.<ref>{{cite journal |author= Rothemund PW |title= Folding DNA to create nanoscale shapes and patterns |journal= Nature |volume= 440 |issue= 7082 |pages= 297–302 |year= 2006 |pmid= 16541064 |doi= 10.1038/nature04586 |bibcode= 2006Natur.440..297R}}</ref> Do vậy DNA được sử dụng như là vật liệu cấu trúc hơn là vật liệu mang thông tin sinh học. Các nhà khoa học đã tạo ra những dàn mạng hai chiều tuần hoàn (bằng phương pháp lát gạch và ''[[origami DNA]]'') và cấu trúc ba chiều [[đa diện]] đều.<ref>{{cite journal |vauthors=Andersen ES, Dong M, Nielsen MM, Jahn K, Subramani R, Mamdouh W, Golas MM, Sander B, Stark H, Oliveira CL, Pedersen JS, Birkedal V, Besenbacher F, Gothelf KV, Kjems J |title= Self-assembly of a nanoscale DNA box with a controllable lid |journal= Nature |volume= 459 |issue= 7243 |pages= 73–6 |year= 2009 |pmid= 19424153 |doi= 10.1038/nature07971 |bibcode= 2009Natur.459...73A}}</ref> [[cỗ máy DNA|Thiết bị cơ nano]] và máy tính DNA have cũng được chứng minh là khả dĩ,<ref>{{cite journal |vauthors=Ishitsuka Y, Ha T |title= DNA nanotechnology: a nanomachine goes live |journal= Nat Nanotechnol |volume= 4 |issue= 5 |pages= 281–2 |year= 2009 |pmid= 19421208 |doi= 10.1038/nnano.2009.101 |bibcode= 2009NatNa...4..281I}}</ref> và những cấu trúc DNA này dùng làm khuôn mẫu để xắp sếp các phân tử khác như [[hệ keo]] nguyên tử [[vàng]] và protein [[streptavidin]] trong vi khuẩn ''Streptomyces avidinii''.<ref>{{cite journal |vauthors=Aldaye FA, Palmer AL, Sleiman HF |title= Assembling materials with DNA as the guide |journal= Science |volume= 321 |issue= 5897 |pages= 1795–9 |year= 2008 |pmid= 18818351 |doi= 10.1126/science.1154533 |bibcode= 2008Sci...321.1795A}}</ref> |
Công nghệ nano DNA sử dụng những tính chất tương tác của phân tử DNA và những axit nucleic khác để tạo ra những phức hợp tự lắp ráp DNA có tính năng hữu ích.<ref>{{cite journal |author= Rothemund PW |title= Folding DNA to create nanoscale shapes and patterns |journal= Nature |volume= 440 |issue= 7082 |pages= 297–302 |year= 2006 |pmid= 16541064 |doi= 10.1038/nature04586 |bibcode= 2006Natur.440..297R}}</ref> Do vậy DNA được sử dụng như là vật liệu cấu trúc hơn là vật liệu mang thông tin sinh học. Các nhà khoa học đã tạo ra những dàn mạng hai chiều tuần hoàn (bằng phương pháp lát gạch và ''[[origami DNA]]'') và cấu trúc ba chiều [[đa diện]] đều.<ref>{{cite journal |vauthors=Andersen ES, Dong M, Nielsen MM, Jahn K, Subramani R, Mamdouh W, Golas MM, Sander B, Stark H, Oliveira CL, Pedersen JS, Birkedal V, Besenbacher F, Gothelf KV, Kjems J |title= Self-assembly of a nanoscale DNA box with a controllable lid |journal= Nature |volume= 459 |issue= 7243 |pages= 73–6 |year= 2009 |pmid= 19424153 |doi= 10.1038/nature07971 |bibcode= 2009Natur.459...73A}}</ref> [[cỗ máy DNA|Thiết bị cơ nano]] và máy tính DNA have cũng được chứng minh là khả dĩ,<ref>{{cite journal |vauthors=Ishitsuka Y, Ha T |title= DNA nanotechnology: a nanomachine goes live |journal= Nat Nanotechnol |volume= 4 |issue= 5 |pages= 281–2 |year= 2009 |pmid= 19421208 |doi= 10.1038/nnano.2009.101 |bibcode= 2009NatNa...4..281I}}</ref> và những cấu trúc DNA này dùng làm khuôn mẫu để xắp sếp các phân tử khác như [[hệ keo]] nguyên tử [[vàng]] và protein [[streptavidin]] trong vi khuẩn ''Streptomyces avidinii''.<ref>{{cite journal |vauthors=Aldaye FA, Palmer AL, Sleiman HF |title= Assembling materials with DNA as the guide |journal= Science |volume= 321 |issue= 5897 |pages= 1795–9 |year= 2008 |pmid= 18818351 |doi= 10.1126/science.1154533 |bibcode= 2008Sci...321.1795A}}</ref> |
||
===Lịch sử và nhân chủng học=== |
|||
{{further|Phát sinh chủng loài học|Phả hệ di truyền}} |
|||
Bởi vì theo thời gian DNA tích lũy các đột biến, do vậy chúng được di truyền lại, nó chứa thông tin lịch sử, và bằng cách so sánh các trình tự DNA, các nhà di truyền học có thể suy luận ra lịch sử tiến hóa của mỗi loài sinh vật, hay phát sinh chủng loài của chúng.<ref>{{cite journal |author= Wray GA |title= Dating branches on the Tree of Life using DNA |journal= Genome Biol |volume= 3 |issue= 1 |pages= reviews0001.1–reviews0001.7 |year= 2002 |pmid= 11806830 |pmc= 150454 |doi= 10.1046/j.1525-142X.1999.99010.x |nopp= true}}</ref> Lĩnh vực phát sinh chủng loài học là một công cụ mạnh của [[sinh học tiến hóa]]. Nếu so sánh những trình tự DNA của một loài với nhau, các nhà di truyền quần thể có thể biết được lịch sự phát triển của một quần thể đang nghiên cứu. Kết quả nghiên cứu của ngành này được áp dụng sang cho di truyền sinh thái (ecological genetics) và [[nhân chủng học]]; Ví dụ, các nhà khoa học sử dụng bằng chứng DNA để nghiên cứu Mười bộ tộc biến mất (Ten Lost Tribes) của Israel.<ref>''Lost Tribes of Israel'', Nova, PBS airdate: 22 February 2000. Transcript available from [http://www.pbs.org/wgbh/nova/transcripts/2706israel.html PBS.org]. Retrieved 4 March 2006.</ref><ref>Kleiman, Yaakov. [http://www.aish.com/societywork/sciencenature/the_cohanim_-_dna_connection.asp "The Cohanim/DNA Connection: The fascinating story of how DNA studies confirm an ancient biblical tradition".] ''aish.com'' (13 January 2000). Retrieved 4 March 2006.</ref> |
|||
== Chú thích == |
== Chú thích == |
||
Phiên bản lúc 15:09, ngày 8 tháng 11 năm 2016
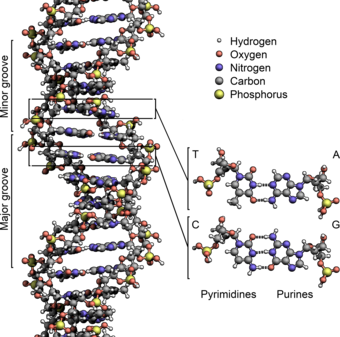

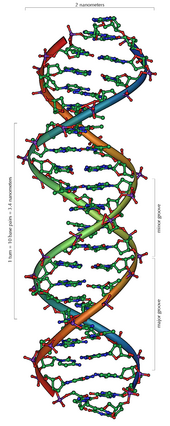
Axit đêoxiribonucleic (viết tắt ADN theo tiếng Pháp hay DNA theo tiếng Anh) là một phân tử mang thông tin di truyền mã hóa cho hoạt động sinh sản, sinh trưởng và phát triển của các sinh vật và nhiều loài virus. ADN và ARN là những axit nucleic; cùng với protein và phức hệ cacbohydrat (polysaccharide), chúng là một trong ba loại đại phân tử chính có vai trò quan trọng đối với mọi dạng sống được biết đến. Các phân tử ADN chứa hai mạch polyme sinh học xoắn đều quanh một trục tạo thành sợi xoắn kép.
Hai mạch ADN này là những phân tử polynucleotide vì thành phần của chúng bao gồm các đơn phân gọi là nucleotide.[1][2] Mỗi nucleotide bao gồm một nucleobase chứa nitơ—hoặc là cytosine (C), guanine (G), adenine (A), hay thymine (T)—liên kết với đường deoxyribose và một nhóm phosphat. Các nucleotide trong 1 sợi đơn liên kết với nhau bởi liên kết cộng hóa trị từ phân tử đường của một nucleotide với nhóm phosphat của nucleotide tiếp theo, tạo thành "khung xương sống" đường-phosphat luân phiên vững chắc. Theo nguyên tắc ghép cặp bazơ (A liên kết với T, và C liên kết với G), liên kết giữa 2 sợi đơn nhờ các mối liên kết hiđrô—giữa 1 cặp bazơ nitríc đứng đối diện ở mỗi sợi. Tổng số cặp bazơ liên quan tới DNA trên Trái Đất ước tính bằng 5,0 x 1037, và nặng khoảng 50 tỷ tấn.[3] Để so sánh, tổng khối lượng của sinh quyển xấp xỉ bằng 4 nghìn tỷ tấn cacbon.[4]
ADN chứa thông tin sinh học, các mã di truyền đến các thế hệ tiếp theo và để chỉ dẫn cho quá trình sinh tổng hợp protein. Mạch đơn DNA có liên kết hóa học vững chắc chống lại sự chia cắt, và 2 sợi đơn của chuỗi xoắn kép lưu trữ thông tin sinh học như nhau. Thông tin này được sao chép nhờ sự tách ra của 2 sợi. Một tỷ lệ đáng kể của axit đêoxiribonucleic (hơn 98% ở người) là các đoạn ADN không mã hóa (non-coding), do chúng không phục vụ cho việc tổng hợp protein.
Hai mạch DNA đối song chạy theo hướng ngược chiều nhau. Gắn với mỗi nhóm đường là một trong bốn loại nucleobase (hay các bazơ). Thông tin sinh học được mã hóa bởi trình tự của bốn nucleobase gắn trên mỗi mạch đơn ADN. Các sợi RNA được tổng hợp từ những khuôn mẫu DNA trong quá trình phiên mã. Tuân theo mã di truyền, phân tử RNA được diễn dịch để xác định lên trình tự các axit amin ở cấu trúc của protein trong quá trình dịch mã.
ADN ở tế bào nhân thực (động vật, thực vật, nấm, và sinh vật nguyên sinh) được lưu trữ bên trong nhân tế bào và tại một số bào quan, như ti thể hoặc lục lạp.[5] Ngược lại, ở sinh vật nhân sơ (vi khuẩn và vi khuẩn cổ), do không có nhân tế bào, DNA nằm trong tế bào chất. Bên trong tế bào, ADN tổ chức thành cấu trúc dài gọi là chất nhiễm sắc (chromatin). Trong giai đoạn phân bào các nhiễm sắc thể hình thành được nhân đôi bằng cơ chế tự nhân đôi ADN, mang lại cho mỗi tế bào có một bộ nhiễm sắc thể hoàn chỉnh. Ở sinh vật nhân thực, chất nhiễm sắc thường cấu tạo từ các nucleosome, bao gồm những đơn vị ADN nhất định quấn quanh một lõi gồm các protein histon. Cấu trúc compact này hướng dẫn sự tương tác giữa DNA với các protein khác, quy định phần nào của DNA sẽ được phiên mã.
Friedrich Miescher đã cô lập được ADN lần đầu tiên vào năm 1869. Francis Crick và James Watson nhận ra cấu trúc phân tử sợi xoắn kép của nó vào năm 1953, dựa trên mô hình xây dựng từ dữ liệu thu thập qua chụp ảnh nhiễu xạ tia X do Rosalind Franklin thực hiện. DNA trở thành công cụ phân tử giúp các nhà nghiên cứu khám phá các lý thuyết và định luật vật lý sinh học, như định lý ergodic và lý thuyết đàn hồi. Các tính chất vật liệu độc đáo của DNA biến nó trở thành phân tử hữu ích đối với các nhà khoa học vật liệu quan tâm trong lĩnh vực lắp ráp cỡ micro và nano, như trong công nghệ nano ADN. Các tiến bộ trong lĩnh vực này bao gồm phương pháp origami ADN và vật liệu lai dựa trên DNA.[6]
Tính chất
ADN là một polyme dài cấu tạo bởi các đơn phân nucleotide lặp lại.[7][8] Cấu trúc ADN của mọi loài là không tĩnh (non-static),[9] chứa hai sợi polynucleotide xoắn đều xung quanh một trục theo chiều từ trái sang phải (xoắn phải), mỗi một vòng xoắn (khoảng 10,4 cặp nucleotide) dài 34 ångström (3,4 nm) và có bán kính 10 ångströms (1,0 nm).[10] Theo một nghiên cứu khác, khi đo trong những dung dịch đặc biệt, chuỗi phân tử DNA rộng từ 22 đến 26 ångströms (2,2 đến 2,6 nano mét), và một đơn vị nucleotide dài 3,3 Å (0,33 nm).[11] Mặc dù mỗi đơn vị lặp lại có kích thước rất nhỏ, polyme DNA có thể là những phân tử rất lớn chứa hàng triệu nucleotide. Ví dụ, ADN trong nhiễm sắc thể lớn nhất ở người, nhiễm sắc thể số 1, chứa xấp xỉ 220 triệu trình tự cặp bazơ[12] và dài đến 85 mm nếu được duỗi thẳng.
Trong sinh vật sống, ADN thường không tồn tại như là một phân tử đơn lẻ nhưng là một cặp phân tử liên kết với nhau.[10][13] Hai sợi dài này quấn vào nhau như cây leo, tạo thành hình xoắn ốc kép. Một nucleobase liên kết với một phân tử đường gọi là nucleoside và một base liên kết với một phân tử đường và một hoặc nhiều nhóm photphat gọi là nucleotide. Polyme chứa nhiều nucleotide gắn kết với nhau (như trong DNA) được gọi là polynucleotide.[14] Chuỗi nucleotide chứa cả đoạn khung xương phân tử (giữ cho chuỗi liên kết với nhau) và chứa nucleobase mà tương tác với cặp khác của sợi DNA trong chuỗi xoắn ốc.
Khung xương chính của sợi ADN làm thành từ các nhóm phosphat và cacbohydrat luân phiên nhau.[15] Phân tử đường trong ADN là 2-deoxyribose, một loại đường pentose (5-cacbon). Các phân tử đường liên kết với nhau bằng nhóm phosphat tạo thành liên kết photphodieste giữa nguyên tử cacbon thứ ba với nguyên tử cacbon thứ 5 ở hai mạch vòng của hai phân tử đường kế cận. Liên kết bất đối xứng này cho phép xác định lên hướng của sợi đơn DNA. Xem xét gần hơn trên một chuỗi xoắn kép, người ta nhận thấy các nucleotide hướng theo một chiều trên một sợi và theo chiều ngược lại trên sợi kia: hai sợi hướng ngược chiều nhau hay đối song. Các đầu không đối xứng kết thúc của chuỗi DNA là đầu 5′ (năm phẩy) và đầu 3′ (ba phẩy), với đầu 5′ kết thúc bởi nhóm phosphat và đầu 3′ kết thúc bởi nhóm hydroxyl. Sự khác nhau chủ yếu giữa DNA và RNA là ở nhóm đường, với đường 2-deoxyribose trong DNA được thay thế bởi đường pentose ribose trong RNA.[13]
Hai sợi xoắn của chuỗi ADN được gắn ổn định bởi hai lực liên kết chính: liên kết hiđrô giữa các nucleotide của hai sợi và tương tác ngăn xếp (base-stacking) giữa các nucleobase thơm.[17] Trong môi trường dung dịch của tế bào, liên kết π liên hợp của các bazơ nucleotide sắp xếp vuông góc với trục của phân tử ADN, giảm thiểu tương tác của chúng với vỏ solvat hóa (solvation shell), và do vậy làm giảm năng lượng tự do Gibbs. Bốn bazơ trong DNA là adenine (viết tắt A), cytosine (C), guanine (G) và thymine (T). Bốn bazơ này gắn với nhóm đường/phosphat để tạo thành nucleotide hoàn chỉnh, như adenosine monophosphate. Adenine ghép cặp với thymine và guanine ghép cặp với cytosine, ký hiệu bằng các cặp bazơ A-T và G-C.[18][19]
Phân loại nucleobase
Các nucleobase được phân thành hai loại: purine, gồm A và G, là hợp chất dị vòng có hai vòng 5 và 6 nguyên tử cacbon gắn với nhau; và pyrimidine, gồm C và T, là hợp chất dị vòng có 6 nguyên tử cacbon.[13] Một nucleobase pyrimidine thứ năm là uracil (U), thay thế cho thymine (T) trong RNA và khác với thymine bởi thiếu nhóm methyl trên vòng của nó. Ngoài RNA và DNA, một số lượng lớn axit nucleic nhân tạo tương tự được tạo ra để nghiên cứu các tính chất của axit nucleic, hoặc sử dụng trong công nghệ sinh học.[20]
Uracil thường không có ở DNA, nó chỉ xuất hiện như là sản phẩm phân tách của cytosine. Tuy nhiên, ở một số thực khuẩn thể (bacteriophages) – thực khuẩn Bacillus subtilis PBS1 và PBS2 và thực khuẩn Yersinia piR1-37 – thymine được thay bằng uracil.[21] Một thực khuẩn thể khác - thể Staphylococcal S6 - được tìm thấy có bộ gen mà thymine thay bằng uracil.[22]
Bazơ J (beta-d-glucopyranosyloxymethyluracil), một dạng sửa đổi của uracil, cũng xuất hiện ở một số sinh vật: trùng roi Diplonema và Euglena, và mọi nhóm Kinetoplastida.[23] Sinh tổng hợp bazơ J diễn ra theo hai bước: bước thứ nhất một thymidine xác định trong DNA được biến đổi thành hydroxymethyldeoxyuridine (HOMedU); bước thứ hai HOMedU được glycoxilat (glycosylated) thành bazơ J.[24] Các nhà khoa học cũng khám phá ra những protein mà được tổng hợp từ bazơ này.[25][26][27] Những protein này dường như có họ hàng xa với gene gây ung thư (oncogene) Tet1 mà tham gia vào quá trình phát sinh bệnh bạch cầu myeloid cấp tính.[28] Bazơ J cũng có vai trò làm tín hiệu kết thúc cho enzym RNA polymerase II.[29][30]
Các rãnh
Hai sợi xoắn tạo thành bộ khung cho DNA. Ở chuỗi xoắn kép này xuất hiện những khoảng trống nằm cách nhau gọi là các rãnh. Những rãnh này nằm gần kề với các cặp bazơ và có thể hình thành lên một vị trí liên kết (binding site). Vì hai sợi này không đối xứng với nhau (do quy tắc ghép cặp bazơ) dẫn đến các rãnh có kích thước khác nhau, trong đó rãnh lớn rộng 22 Å và rãnh nhỏ rộng 12 Å.[31] Độ rộng của rãnh giúp cho cạnh của các bazơ dễ dàng tiếp cận hơn trong rãnh lớn so với rãnh nhỏ. Kết quả là, các protein của yếu tố phiên mã (transcription factor) mà liên kết với đoạn trình tự cụ thể trong chuỗi xoắn kép DNA thường thực hiện tiếp xúc với các cạnh của các bazơ ở rãnh lớn.[32] Tình huống này thay đổi tùy theo hình dáng bất thường của DNA bên trong tế bào (xem ở dưới), nhưng các rãnh lớn và rãnh nhỏ luôn luôn được đặt tên để phản ánh sự khác nhau về kích thước đo được nếu DNA vặn xoắn trở về dạng B thường gặp.
Cặp bazơ
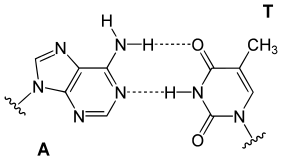
Trong chuỗi xoắn kép DNA, mỗi loại nucleobase trên một sợi chỉ liên kết với một loại nucleobase trên sợi kia, hay quy tắc ghép cặp bazơ bổ sung. Ở đây, purine hình thành liên kết hiđrô với pyrimidine, trong đó adenine chỉ ghép với thymine bằng hai liên kết hiđrô, và cytosine chỉ ghép với guanine bằng ba liên kết hiđrô. Điều này sắp xếp hai nucleotide liên kết với nhau trong toàn bộ chuỗi xoắn kép. Vì liên kết hiđrô không phải là liên kết cộng hóa trị, có thể làm đứt gẫy và nối lại chúng tương đối dễ dàng. Hai mạch của DNA trong chuỗi xoắn kép do vậy có thể tách rời nhau ra giống như khóa kéo, hoặc bằng lực cơ học hoặc bằng nhiệt độ cao.[33] Hệ quả của quy tắc bổ sung này, là mọi thông tin trong trình tự chuỗi xoắn kép DNA được lặp lại ở mỗi mạch, và có vai trò quan trọng trong giai đoạn tự sao chép DNA. Thật vậy, sự tương tác có thể đảo ngược và cụ thể này giữa các cặp bazơ bổ sung là rất quan trọng cho tất cả các chức năng của ADN ở sinh vật sống.[8]

|
|
Hai cặp bazơ khác nhau ở số liên kết hiđrô. Chuỗi ADN với nhiều cặp GC sẽ ổn định hơn so với chuỗi ADN có ít cặp GC.
Như miêu tả ở trên, hầu hết phân tử DNA bao gồm hai mạch polyme liên kết thành dạng xoắn kép bởi liên kết không phải là liên kết cộng hóa trị; cấu trúc sợi kép này (dsDNA) cũng được duy trì chủ yếu bởi tương tác ngăn xếp giữa các bazơ, mà mạnh nhất ở ngăn xếp G,C. Hai dải có thể tách nhau ra – quá trình tan chảy – để tạo thành hai phân tử DNA sợi đơn (ssDNA). Sự phân tách diễn ra ở nhiệt độ cao, độ mặn thấp và độ pH cao (độ pH thấp cũng làm tách DNA, nhưng vì DNA trở lên không ổn định trong môi trường khử purin axit, độ pH thấp ít khi được sử dụng).
Sự ổn định của dạng sợi kép dsDNA không chỉ phụ thuộc vào thành phần GC (tỷ lệ % cặp G,C) mà còn phụ thuộc vào trình tự (do ngăn xếp là một trình tự cụ thể) và độ dài (phân tử càng dài thì càng ổn định). Độ ổn định được đo bằng nhiều cách khác nhau; cách phổ biến là "nhiệt độ tan chảy", đó là nhiệt độ mà tại đấy khoảng 50% số phân tử ds biến đổi thành phân tử ss; nhiệt độ tan chảy phụ thuộc vào cường độ ion và sự tập trung của DNA. Do vậy, cả tỷ lệ phần trăm số cặp bazơ GC và chiều dài tổng thể của chuỗi xoắn kép ADN xác định cường độ liên kết giữa hai mạch của ADN. Những chuỗi xoắn kép DNA dài với thành phần nhiều GC có tương tác giữa hai mạch mạnh hơn, trong khi chuỗi xoắn kép ngắn với thành phần nhiều AT có tương tác giữa hai mạch yếu hơn.[34] Trong sinh học, các phần của chuỗi xoắn kép DNA mà khi cần thiết để tách ra dễ dàng, như hộp Pribnow TATAAT ở một số vùng khởi động, có xu thế chứa nhiều thành phần AT, làm cho các sợi tách ra khỏi nhau dễ dàng hơn.[35]
Trong phòng thí nghiệm, độ lớn của tương tác này có thể đo bằng cách tìm nhiệt độ cần thiết để tách liên kết hiđrô, hay nhiệt độ tan chảy của chúng (cũng gọi là giá trị Tm). Khi tất cả các cặp bazơ tách rời nhau ra, hai mạch của chuỗi ADN tách rời và tồn tại trong dung dịch như là các phân tử độc lập. Các phân tử sợi đơn không có hình dạng chung, mà chúng có thể thu về những dạng ổn định tùy theo độ dài và thành phần cặp bazơ.[36]
Mang nghĩa và đối nghĩa
Một trình tự DNA được gọi là "mang nghĩa" (sense) nếu trình tự của nó giống với của RNA thông tin sao chép dùng để dịch mã thành protein.[37] Trình tự trên mạch bổ sung được gọi là trình tự "đối nghĩa" (antisense). Cả trình tự mang nghĩa và đối nghĩa có thể tồn tại trên các đoạn khác nhau của cùng một sợi đơn DNA (tức là cả hai sợi có thể chứa cả trình tự có nghĩa và đối nghĩa). Ở cả tế bào nhân thực và nhân sơ, các trình tự antisense RNA đều được tạo ra, nhưng chức năng của những RNA vẫn chưa được hiểu rõ hoàn toàn.[38] Có đề xuất cho rằng các antisense RNA tham gia vào điều hòa biểu hiện gen thông qua bắt cặp base RNA-RNA.[39]
Một vài trình tự DNA ở sinh vật nhân thực và nhân sơ, và hay gặp hơn hơn ở plasmid và virus, làm mờ sự phân biệt giữa các sợi mang nghĩa và đối nghĩa (sense and antisense strands) bởi có sự hiện diện của các gen phủ lên nhau (overlapping genes).[40] Trong các trường hợp này, một số trình tự DNA thực hiện hai trách nhiệm, chúng mã hóa một protein khi đọc dọc theo một mạch, và mã hóa protein thứ hai khi đọc theo hướng ngược lại dọc theo mạch kia. Trong vi khuẩn, sự xen phủ này có thể tham gia vào điều hòa phiên mã gen,[41] trong khi ở virus, các gen phủ lên nhau làm tăng lượng thông tin được mã hóa bên trong bộ gen của virus.[42]
ADN siêu xoắn
DNA có thể xoắn lại giống như một sợi dây trong quá trình gọi là DNA siêu xoắn (DNA supercoiling). Với DNA trong trạng thái "bình thường" của nó, mội sợi thường xoắn đều quanh trục của chuỗi xoắn kép với khoảng 10,4 cặp base, nhưng nếu DNA bị vặn xoắn các sợi trở lên xếp chặt hơn hoặc cuốn lỏng lẻo hơn.[43] Nếu DNA bị xoắn theo hướng của chuỗi xoắn kép, hay siêu xoắn thuận (positive supercoiling), thì các base giữ chặt với nhau hơn. Nếu chúng bị xoắn theo hướng ngược với chuỗi xoắn kép, hay siêu xoắn nghịch (negative supercoiling), thì các base tách khỏi nhau dễ dàng hơn. Trong tự nhiên, hầu hết DNA trong tế bào ở trạng thái gần siêu xoắn nghịch do ảnh hưởng của enzyme có tên gọi topoisomerase.[44] Những enzyme cũng cần thiết để làm hạ thấp ứng suất xoắn tác động tới các sợi DNA trong các quá trình như phiên mã và sao chép DNA.[45]

Các cấu trúc ADN khác nhau
ADN có thể tồn tại dưới một số hình dạng bao gồm dạng A-DNA, B-DNA, và Z-DNA, mặc dù chỉ có dạng B-DNA và Z-DNA đã được quan sát thấy trong các tế bào sinh vật.[15] Hình dạng mà DNA tuân theo phụ thuộc vào mức độ hydrat hóa, trình tự DNA, số cặp bazơ và hướng siêu xoắn, chỉnh sửa hóa học đến các cặp bazơ, sự tập trung và loại ion kim loại, cũng như sự xuất hiện của các polyamin trong dung dịch.[46]
Báo cáo đầu tiên về ảnh chụp tán xạ tia X của dạng A-DNA và B-DNA sử dụng phân tích dựa trên biến đổi Patterson chỉ cung cấp thông tin giới hạn về cấu trúc của các sợi DNA định hướng.[47][48] Một phân tích khác, do Wilkins et al. đề xuất vào năm 1953, cho các phần chụp nhiễu xạ/tán xạ tia X đối với in vivo B-DNA của các sợi DNA bị hydrat hóa cao, theo các số hạng bình phương của hàm Bessel.[49] Trong cùng tạp chí, James Watson và Francis Crick trình bày mô hình phân tử của họ nhằm phân tích các hình ảnh nhiễu xạ tia X của DNA và gợi ra rằng cấu trúc của nó có dạng chuỗi xoắn kép.[10]
"Dạng B-DNA" hidrat cao là phổ biến nhất tìm thấy trong các điều kiện ở tế bào sống,[50] tồn tại dưới trạng thái gần giống tinh thể (paracrystalline state), đó là dạng động mặc dù tính tương đối cứng của chuỗi xoắn kép DNA giữ ổn định bởi liên kết hiđrô giữa các cặp bazơ. Để đơn giản, hầu hết các mô hình phân tử DNA bỏ qua liên kết động lực của nước và các ion đối với phân tử dạng B-DNA, và do vậy ít hữu ích khi dùng các mô hình này để hiểu các hành xử của B-DNA trong tế bào sống ở trạng thái bình thường (in vivo).[51] Phân tích vật lý và toán học của ảnh chụp tia X[52][53] và dữ liệu quang phổ thu được cho paracrystalline B-DNA do vậy phức tạp hơn so với dữ liệu nhiễu xạ tia X của ảnh chụp dạng A-DNA.
So với B-DNA, dạng A-DNA xoắn ốc theo chiều tay phải rộng hơn, với một rãnh nhỏ nông hơn và rộng hơn, trong khi rãnh lớn sâu hơn và hẹp hơn. Dạng A thường xuất hiện dưới các điều kiện phi sự sống đặc biệt trong các mẫu DNA mất nước một phần, trong khi ở tế bào nó có thể ở dạng lai ghép hai sợi đơn DNA với sợi RNA, cũng như xuất hiện ở phức hợp enzyme-DNA.[54][55] Ở đoạn DNA nơi các cặp bazơ đã bị sửa đổi hóa học bằng phương pháp metyl hóa có thể trải qua sự thay đổi lớn hơn về hình dạng và trở thành dạng Z-DNA. Ở đây, các sợi xoắn xung quanh trục theo chiều tay trái, ngược chiều với hướng của dạng phổ biến B.[56] Những cấu trúc bất thường này có thể nhận ra bằng một loại protein liên kết với Z-DNA và các protein này có thể tham gia vào mục tiêu điều hòa của quá trình phiên mã.[57]
| Dạng hình học | Dạng A | Dạng B | Dạng Z |
|---|---|---|---|
| Chiều xoắn | phải | phải | trái |
| Đơn vị lặp lại | 1 bp | 1 bp | 2 bp |
| Góc quay/bp | 32,7° | 34,3° | 60°/2 |
| Số bp trung bình/vòng xoay | 11 | 10,4 | 12 |
| Độ nghiêng của bp so với trục | +19° | -1,2° | -9° |
| Độ dài dốc/bp dọc theo trục | 0,23 nm | 0,332 nm | 0,38 nm |
| Bước/vòng xoay | 2,82 nm | 3,32 nm | 4,56 nm |
| Góc xoay trung bình giữa hai bp | +18° | +16° | 0° |
| Góc glycosyl | anti | anti | C: anti, G: syn |
| Sugar pucker | C3'-endo | C2'-endo | C: C2'-endo, G: C2'-exo |
| Đường kính | 2,3 nm | 2,0 nm | 1,8 nm |
ADN có thành phần hóa học thay thế
Trong một vài năm, các nhà sinh học vũ trụ đã đề xuất về một sinh quyển bóng tối (shadow biosphere), một sinh quyển vi sinh vật giả thuyết tồn tại trên Trái Đất mà sử dụng các quá trình phân tử và hóa học khác căn bản so với những gì đã biết về sự sống hiện tại. Một trong các đề xuất đó là sự tồn tại của dạng sinh vật sống mà nguyên tử Asen thay cho Phốtpho trong DNA. Một báo cáo năm 2010 về khả năng này trong vi khuẩn GFAJ-1,[61][61][62] mặc dù đã có những tranh cãi,[62][63] và cuối cùng năm 2012 một báo cáo khác nêu bằng chứng cho thấy các vi khuẩn này chủ động ngăn không cho asen kết hợp vào bộ xương DNA của nó và những phân tử sinh học khác.[64]
Cấu trúc bộ bốn
Tại đầu mút của mỗi nhiễm sắc thể là những vùng đặc hiệu của DNA gọi là telomere. Chức năng chính của các vùng này đó là cho phép tế bào thực hiện sao chép nhiễm sắc thể kết thúc sử dụng enzym telomerase, bởi vì bình thường các enzyme sao chép DNA không thể nhân đôi đến đầu cuối 3′ ở nhiễm sắc thể.[65] Những đầu mút đặc biệt này của nhiễm sắc thể cũng giúp bảo vệ DNA bị rút ngắn sau mỗi lần nhân đôi, và dừng hệ thống sửa chữa DNA trong tế bào khi hệ thống này coi DNA bị hỏng và cần được sửa chữa.[66] Ở tế bào của người, các telomere thường là mạch đơn DNA dài chứa vài nghìn trình tự TTAGGG lặp lại.[67]
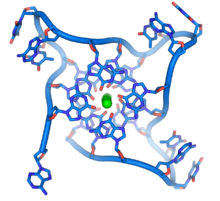
Các trình tự giàu guanine giữ ổn định đầu mút của nhiễm sắc thể bằng cách hình thành lên cấu trúc ngăn xếp của bốn đơn vị base, hơn là dạng ghép cặp thường thấy ở các phân tử ADN khác. Ở đây, bốn guanine base tạo thành một tấm phẳng và những khối phẳng chứa bốn đơn vị base này xếp xen chồng lẫn nhau hình thành lên cấu trúc G-quadruplex ổn định.[69] Sự ổn định của cấu trúc này là do liên kết hiđrô giữa các cạnh của base và tạo phức chelat (chelation) của một ion kim loại nằm ở trung tâm của khối phẳng bộ bốn base.[70] Các cấu trúc khác cũng có thể tồn tại, với trung tâm của bộ bốn bazơ hoặc là một sợi đơn gấp xung quanh các bazơ, hoặc một vài sợi song song với nhau, mỗi sợi đóng góp một base vào cấu trúc trung tâm.
Ngoài dạng cấu trúc ngăn xếp, telomere cũng có cấu trúc dạng vòng lớn gọi là vòng telomere, hay T-vòng. Trong cấu trúc này, một mạch đơn DNA quấn quanh thành một vòng tròn dài ổn định bởi các protein liên kết với telomere.[71] Tại đầu mút của T-vòng, telomere sợi đơn DNA được giữ ở một vùng bao bởi DNA sợi đôi bằng cách dải telomere làm tách sợi đôi DNA và ghép cặp base với của một trong hai sợi. Cấu trúc ba dải này (triple-stranded DNA) gọi là vòng chuyển dời hay D-vòng.[69]
ADN phân nhánh
Ở chuỗi xoắn kép DNA, hiện tượng bung sợi xuất hiện khi vùng không được bổ sung xuất hiện tại đầu mút của một sợi đơn DNA. Tuy nhiên, DNA phân nhánh có thể xảy đến nếu có một sợi DNA thứ ba và chứa những vùng liên hợp với vùng không được bổ sung của chuỗi xoắn kép đã bị bung sợi trước đó. Dạng đơn giản nhất ADN phân nhánh chỉ bao gồm ba sợi ADN, có thể tồn tại thêm nhiều nhánh khác.[72] DNA phân nhánh được ứng dụng trong công nghệ nano để lắp ráp những hình dạng phân tử mong muốn.
Những thay đổi hóa học và trình tự của ADN
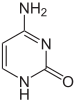
|

|

|
| cytosine | 5-methylcytosine | thymine |
Thay đổi hóa học và sửa đổi đóng gói ADN
Biểu hiện của gen bị ảnh hưởng bởi sự đóng gói của DNA trong nhiễm sắc thể thành một cấu trúc gọi là chất nhiễm sắc. Tác động chỉnh sửa bazơ có thể xảy ra ở quá trình đóng gói, với các vùng có hoặc không có mức biểu hiện gen thấp thường chứa các bazơ cytosine ở mức metyl hóa cao. Sự đóng gói DNA và ảnh hưởng của nó lên biểu hiện gen cũng xảy ra bởi hiệu ứng thay đổi liên kết cộng hóa trị ở lõi histone xung quanh protein mà DNA được bọc trong cấu trúc chất nhiễm sắc hoặc bởi sự tái cấu trúc mô hình chất nhiễm sắc (chromatin remodeling). Do vậy, tác động xen lẫn giữa metyl hóa DNA và thay đổi liên kết ở histone có ảnh hưởng phối hợp đến chất nhiễm sắc và biểu hiện gen.[73]
Ví dụ, sự metyl hóa cytosine, tạo ra 5-methylcytosine, nó có vai trò quan trọng đối với sự khử hoạt của nhiễm sắc thể X (X-chromosome inactivation).[74] Mức độ metyl hóa thay đổi giữa các sinh vật – giun tròn Caenorhabditis elegans không có phản ứng metyl hóa cytosine, trong khi ở động vật có xương sống có mức độ cao hơn, lên tới 1% số lượng DNA chứa 5-methylcytosine.[75] Tuy 5-methylcytosine có vai trò quan trọng, nó có thể bị khử amin để chuyển thành bazơ thymine, do đó cytosine metylat có khuynh hướng gây đột biến.[76] Những thay đổi base khác bao gồm sự metyl hóa adenine ở vi khuẩn, sự có mặt của 5-hydroxymethylcytosine trong não,[77] và sự glycosylat của uracil tạo thành "J-base" trong kinetoplastid.[78][79]
Phá hủy (hư hại)
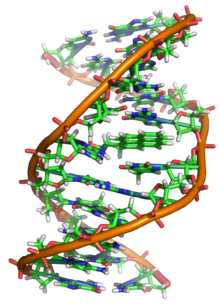
ADN có thể bị hư hại bởi nhiều tác nhân gây đột biến, làm thay đổi trình tự của ADN. Các tác nhân gây đột biết bao gồm tác nhân ô xy hóa, chất alkyl hóa và bức xạ điện từ năng lượng cao như tia cực tím và tia X. Loại ADN hư hại hình thành phụ thuộc vào loại tác nhân gây đột biến. Ví dụ, tia UV làm phá hủy ADN khi tạo ra dime thymine, hay liên kết chéo giữa các bazơ pyrimidine với nhau.[81] Mặt khác, các tác nhân ô xy hóa như gốc tự do hoặc hiđrô peroxide tạo ra nhiều dạng phá hủy, bao gồm thay đổi nhóm bazơ, đặc biệt là của guanosine, và làm đứt gãy chuỗi xoắn kép.[82] Một tế bào điển hình ở người chứa khoảng 150.000 bazơ chịu sự phá hủy của tác nhân ô xy hóa.[83] Trong những tổn thương ô xy hóa này, mức độ nguy hiểm nhất đó là chuỗi xoắn kép bị đứt gãy, vì rất khó để gắn chúng lại và dẫn tới đột biến điểm (point mutation), đột biến do chèn đoạn nucleotide và xóa đoạn nucleotide từ trình tự DNA, cũng như sự hoán vị thể nhiểm sắc (chromosomal translocation).[84] Những đột biến này có thể gây ung thư. Bởi vì những giới hạn thừa hưởng trong cơ chế sửa chữa ADN, nếu con người sống đủ lâu, những hư hại DNA này cuối cùng sẽ dẫn tới sự phát triển của ung thư.[85][86] Những phá hủy DNA mà xuất hiện một cách tự nhiên, do các quá trình bình thường bên trong tế bào tạo ra các sản phẩm phản ứng với ô xy, chẳng hạn các hoạt động thủy phân của nước trong tế bào xảy ra một cách thường xuyên. Mặc dù hầu hết những phá hủy này được sửa chữa, trong bất kỳ tế bào nào một vài DNA hư hại có thể còn tồn tại mặc cho các hoạt động sửa chữa. Những DNA bị phá hủy còn sót lại này tích tụ dần theo độ tuổi bên trong các mô sau nguyên phân ở động vật. Sự tích tụ này dường như là một nguyên nhân quan trọng dẫn tới sự già yếu.[87][88][89]
Nhiều tác nhân gây đột biến nằm gọn trong không gian giữa hai cặp bazơ cạnh nhau, hay gọi là các phân tử xen kẹp (intercalation). Hầu hết các phân tử xen kẹp là các phân tử vòng thơm có cấu trúc phẳng; ví dụ ethidium bromide, acridine, daunomycin, và doxorubicin. Để cho một phân tử xen kẹp có thể vừa vặn không gian giữa hai cặp bazơ, các bazơ phải bị tách ra, bóp méo chuỗi DNA bằng sự tháo xoắn sợi kép. Điều này ngăn cản quá trình dịch mã và phiên mã DNA, gây ra sự độc hại và đột biến.[90] Kết quả là, các phân tử xen kẹp vào DNA có thể là tác nhân gây ung thư, và trong trường hợp của thalidomide là tác nhân gây ra quái thai (teratogen).[91] Những phân tử khác như benzo[a]pyrene diol epoxide và aflatoxin tạo thành sản phẩm cộng vào DNA dẫn tới các lỗi trong quá trình sao chép.[92] Tuy thế, do khả năng ngăn cản sự phiên mã và dịch mã DNA, những độc tố tương tự khác được sử dụng trong phương pháp hóa trị liệu để ngăn chặn sự lớn lên nhanh chóng của các tế bào ung thư.[93]
Chức năng sinh học

ADN thường xuất hiện trong nhiễm sắc thể hình que ở sinh vật nhân thực, và nhiễm sắc thể hình tròn ở sinh vật nhân sơ. Nhiễm sắc thể trong nhân tế bào được gói gọn bởi protein thành cấu trúc cô đặc gọi là chất nhiễm sắc (chromatin). Điều này cho phép các phân tử DNA rất dài nằm gọn trong nhân tế bào. Cấu trúc của nhiễm sắc thể và chất nhiễm sắc thay đổi tùy thuộc vào từng giai đoạn của chu kỳ tế bào. Tập hợp các nhiễm sắc thể trong một tế bào tạo thành bộ gen của nó; bộ gen ở người có xấp xỉ 3 tỷ cặp base DNA sắp xếp trong 46 nhiễm sắc thể.[94] Thông tin chứa trong DNA được giữ bởi trình tự của các đoạn ADN gọi là gen. Sự kế thừa thông tin di truyền trong gen được thực hiện thông qua các cặp base bổ sung. Ví dụ, trong phiên mã, khi một tế bào sử dụng thông tin ở một gen, trình tự DNA được sao chép vào trình tự bổ sung RNA thông qua lực hút giữa DNA và các nucleotide chính xác của RNA. Thông thường, bản sao chép RNA này thường được làm khuôn mẫu để tạo ra trình tự của các axit amin trong quá trình dịch mã, mà phụ thuộc vào cùng tương tác giữa các nucleotide RNA. Trong quá trình khác, một tế bào có thể tự sao chép thông tin di truyền của nó bằng quá trình tự nhân đôi DNA. Chi tiết của những chức năng này được nêu trong những bài viết khác; bài này tập trung vào tương tác giữa DNA và các phân tử khác mà điều hòa chức năng của bộ gen.
Gen và bộ gen

ADN chứa các đoạn gen được gói gọn và xếp chặt có thứ tự bởi quá trình cô đặc ADN (ADN condensation) để có thể nằm bên trong thể tích nhỏ của tế bào. Ở sinh vật nhân thực, ADN nằm trong nhân tế bào, cũng như có một ít nằm ở ti thể và lục lạp. Ở sinh vật nhân sơ, ADN nằm trong nucleoid trong chất nguyên sinh (cytoplasm).[95] Thông tin di duyền trong một bộ gen được giữ bởi các gen, và tập hợp toàn bộ các gen trong tế bào của cơ thể thuộc 1 loài sinh vật được gọi là kiểu gen. Một gen là đơn vị của tính di truyền và là một vùng của DNA có ảnh hưởng tới một đặc tính cụ thể trong cơ thể sinh vật. Các gen chứa một khung đọc mở (open reading frame) mà có thể được phiên mã, cũng như các vùng trình tự điều hòa (regulatory sequence) như promoter và enhancer mà kiểm soát quá trình phiên mã của khung đọc mở.

Ở nhiều loài, chỉ một phần nhỏ trong tổng số trình tự của bộ gen là mã hóa cho sinh tổng hợp protein. Ví dụ, chỉ khoảng 1,5% bộ gen ở người chứa các exon mã hóa cho protein, với trên 50% DNA ở người chứa các trình tự lặp lại không mã hóa (non-coding repeated sequence (DNA)).[97] Lý do cho sự có mặt của rất nhiều DNA không mã hóa ở bộ gen của sinh vật nhân thực và sự khác nhau rất lớn trong kích cỡ bộ gen, hay C-giá trị, giữa các loài đưa đến một câu hỏi mở lâu năm gọi là "nghịch lý C-giá trị".[98] Tuy nhiên, một số trình tự DNA mà không mã hóa cho protein vẫn có thể có chức năng mã hóa cho các phân tử RNA không mã hóa (non-coding RNA), mà tham gia vào điều hòa biểu hiện gen.[99]
Một số trình tự DNA không mã hóa đóng vai trò làm cấu trúc bộ khung trong nhiễm sắc thể. Telomere và centromere điển hình chỉ chứa vài gen, nhưng có vai trò quan trọng đối với chức năng và sự ổn định của nhiễm sắc thể.[66][100] Một dạng DNA không mã hóa xuất hiện ở người gọi là gen giả (pseudogene), là những bản sao của gen nhưng đã bị tắt chức năng do tác động của đột biến.[101] Những trình tự này thường chỉ là các hóa thạch phân tử, mặc dù chúng có thể phục vụ như là vật liệu di truyền dạng thô cho sản sinh gen mới thông qua quá trình nhân đôi (gene duplication) và phân ly gen.[102]
Phiên mã và dịch mã

Một gen là một trình tự của DNA chứa thông tin di truyền và ảnh hưởng tới kiểu hình của sinh vật. Bên trong một gen, trình tự của các bazơ dọc theo một mạch DNA xác định lên trình tự của RNA thông tin, mà từ đó xác định lên trình tự của một hay nhiều protein. Mối liên hệ giữa trình tự nucleotide của các gen và trình tự các axit amin của protein được xác định trong quá trình dịch mã, được biết đến với tập hợp mã di truyền. Mã di truyền chứa bộ ba 'chữ cái' gọi là codon (bộ ba mã hóa) tạo thành từ trình tự của ba nucleotide (v.d. ACT, CAG, TTT).
Trong quá trình phiên mã, các codon của một gen được sao chép sang RNA thông tin bằng RNA polymerase. RNA sao chép này sau đó được giải mã bởi ribosome mà đọc trình tự RNA bằng cách khớp cặp bazơ trong RNA thông tin với RNA vận chuyển, loại phân tử mang theo từng axit amin. Vì có 4 bazơ trong tổ hợp 3-chữ cái, do vậy có tất cả 64 codon (tổ hợp 43). Chúng mã hóa cho 20 axit amin cơ bản của sự sống, do đó một axit amin có nhiều hơn một codon mã hóa cho nó. Cũng có ba codon 'kết thúc' hoặc 'không mang nghĩa' đánh dấu điểm kết thúc của một vùng mã hóa; chúng là các codon TAA, TGA, và TAG.

Sao chép
Phân bào là quá trình cơ bản của sinh vật để có thể sinh trưởng, nhưng khi một tế bào phân chia, nó phải sao chép DNA trong bộ gen của nó sao cho hai tế bào con có cùng thông tin di truyền như của tế bào mẹ. Cấu trúc hai mạch đơn DNA giúp hình thành cơ chế tự nhân đôi của DNA. Ở đây, hai mạch đơn tháo xoắn tách rời nhau và mỗi trình tự bổ sung DNA ở mỗi mạch được tổng hợp lại bằng một enzyme gọi là DNA polymerase. Enzyme này xây dựng lên mạch mới bằng cách tìm những nucleotide tự do từ môi trường nội bào theo nguyên tắc bổ sung, và gắn kết chúng lại với nucleotide trên mạch gốc ban đầu. Vì DNA polymerases chỉ tổng hợp mạch mới theo chiều 5′ đến 3′, do vậy trên mạch khuôn có đầu 3’ thì mạch bổ sung được tổng hợp liên tục theo chiều 5’ đến 3’ cùng chiều với chiều tháo xoắn.[103] Trên mạch khuôn có đầu 5’ thì mạch bổ sung được tổng hợp ngắt quãng tạo nên các đoạn ngắn gọi là đoạn Okazaki cũng theo chiều 5’ đến 3’ ngược chiều với chiều tháo xoắn, sau đó các đoạn này được nối lại với nhau nhờ enzyme nối DNA ligase.[104]
Axit nucleic ngoại bào
DNA nằm ngoài tế bào (eDNA), hầu hết được giải phóng khi tế bào chết rụng, xuất hiện khắp nơi trong môi trường. Mức độ tập trung của nó trong đất có thể cao tới 2 μg/L, và trong môi trường nước tự nhiên lên tới 88 μg/L.[105] Đã có một số chức năng cho eDNA được đề xuất: nó có thể tham gia vào vận chuyển ngang gen;[106] cung cấp dinh dưỡng;[107] và nó có thể hoạt động như là một chất đệm để khôi phục hoặc chuẩn độ ion hoặc kháng sinh.[108] DNA ngoại bào hoạt động như là một thành phần ma trận chức năng ngoại bào trong nhóm vi sinh vật (biofilm) của một số loài vi khuẩn. Nó có thể hoạt động như là nhân tố nhận diện để điều phối sự bám dính và phân tán của một số loại tế bào nhất định trong biofilm;[109] hoặc đóng góp vào sự hình thành biofilm;[110] cũng như đóng góp vào tính chất độ mạnh vật lý của biofilm và sức kháng lại tác động sinh học.[111]
Tương tác với protein
Mọi chức năng của DNA phụ thuộc vào tương tác với protein. Những tương tác protein này có thể không nhất định, hoặc protein liên kết cụ thể với một trình tự DNAc. Các enzyme cũng liên kết với DNA và trong số này, polymerase sao chép trình tự base của DNA trong giai đoạn phiên mã và sao chép DNA là đặc biệt quan trọng.
Protein liên kết với DNA

|
Các protein cấu trúc liên kết với DNA là những ví dụ đã được nghiên cứu khá kĩ về tương tác không đặc hiệu DNA-protein. Bên trong nhiễm sắc thể, DNA được giữ trong phức hợp với protein cấu trúc. Những protein này sắp xếp DNA thành các cấu trúc compact gọi là chất nhiễm sắc (chromatin). Trong sinh vật nhân thực, cấu trúc này bao gồm DNA liên kết với phức hợp các protein cơ sở nhỏ gọi là histone, trong khi ở sinh vật nhân sơ có nhiều loại protein tham gia vào.[112][113] Histone tạo thành phức hợp dạng đĩa gọi là nucleosome, gồm chuỗi xoắn kép DNA bó hai vòng quanh bề mặt của nó. Những tương tác không đặc hiệu được hình thành thông qua các phần dư cơ bản trong histone, tạo liên kết ion với bộ khung đường-phosphat có tính axit của DNA, và do vậy phần lớn là độc lập với trình tự của các base.[114] Những phản ứng hóa học làm thay đổi các axit amin cơ bản bao gồm phản ứng metyl hóa, sự photpharyl hóa (phosphorylation) và axetyl hóa.[115] Những sự thay đổi hóa học này làm ảnh hưởng tới độ mạnh của tương tác giữa DNA và histone, khiến cho các nhân tố phiên mã trở lên dễ dàng hoặc khó tiếp cận được với DNA và do vậy thay đổi tốc độ quá trình phiên mã.[116] Những protein liên kết DNA không đặc hiệu khác trong chromatin bao gồm các nhóm protein có tính linh động cao mà khi liên kết có thể uốn hoặc làm vặn DNA.[117] Các protein này có vai trò quan trọng trong mảng uốn nucleosome và sắp xếp chúng thành cấu trúc lớn hơn tạo thành nhiễm sắc thể.[118]
Một nhóm protein liên kết DNA đặc biệt là các protein chỉ liên kết nhất định với mạch đơn DNA. Ở người, protein A sao mã là thành viên được hiểu tốt nhất trong nhóm này và nó tham gia vào quá trình lúc hai mạch xoắn kép tách rời nhau, bao gồm sao mã DNA, tái tổ hợp và sửa chữa DNA.[119] Những protein liên kết này làm ổn định mạch đơn DNA và bảo vệ nó khỏi hình thành cấu trúc vòng (stem-loop) hoặc bị chia cắt bởi nuclease.

Ngược lại, có những protein khác đã biến đổi để liên kết với những trình tự DNA đặc biệt. Lĩnh vực nghiên cứu sâu rộng nhất về những protein này đó là nghiên cứu nhiều loại nhân tố phiên mã (transcription factor) khác nhau, mà ở đây các protein này điều hòa quá trình phiên mã. Mỗi nhân tố phiên mã liên kết với một tập hợp cụ thể các trình tự DNA và kích hoạt hoặc ức chế sự phiên mã ở gen tại những trình tự gần với promoter (vùng gen khởi động) của chúng. Nhân tố phiên mã thực hiện vai trò này theo hai cách. Đầu tiên, chúng có thể gắn với RNA polymerase chịu trách nhiệm cho quá trình phiên mã, hoặc trực tiếp hoặc gián tiếp thông qua các protein trung gian; nó giúp định vị polymerase tại vùng gen khởi động và cho phép nó bắt đầu phiên mã.[121] Hoặc cách khác, nhân tố phiên mã có thể gắn với enzyme làm thay đổi các histone ở vùng gen khởi động. Điều này làm thay đổi khả năng tiếp cận của polymerase với khuôn mẫu DNA.[122]
Do những DNA đích này xuất hiện trong toàn thể bộ gen của sinh vật, những thay đổi trong hoạt động của một loại nhân tố phiên mã có thể ảnh hưởng tới hàng nghìn gen.[123] Hệ quả là, những protein này thường là mục tiêu của các quá trình truyền tín hiệu tải nạp (signal transduction) mà điều khiển đáp ứng đối với những thay đổi của môi trường hoặc biệt hóa tế bào và điều khiển sự phát triển. Nét đặc trưng của những tương tác của các nhân tố phiên mã với DNA đến từ các protein tạo nhiều tiếp xúc với các cạnh của các base DNA, cho phép chúng "đọc" trình tự DNA. Phần lớn những tương tác với base diễn ra ở những khe rãnh lớn, nơi có thể tiếp xúc nhiều nhất với các base.[32]

Enzym chỉnh sửa DNA
Nuclease và ligase
Nuclease là các enzyme có khả năng cắt DNA thành các đoạn bằng cách xúc tác cho phản ứng thủy phân (hydrolysis) các liên kết photphodieste. Nuclease mà thủy phân nucleotide từ đầu cuối của mạch DNA được gọi là exonuclease, trong khi endonuclease thực hiện cắt những điểm bên trong. Những nuclease được sử dụng thường xuyên nhất trong sinh học phân tử là các endonuclease giới hạn, do chúng cắt DNA thành những đoạn trình tự nhất định. Ví dụ, enzyme EcoRV ở hình ảnh bên trái nhận ra trình tự gồm 6 base 5′-GATATC-3′ và thực hiện cắt theo một đường nằm ngang. Trong tự nhiên, những enzyme này bảo vệ vi khuẩn chống lại sự tấn công của thể thực khuẩn bằng cách tiêu hóa DNA của thể thực khuẩn khi chúng xâm nhập vào tế bào của vi khuẩn, các enzyme hoạt động như là một phần trong hệ thống cải biến ức chế (restriction modification system).[125] Trong công nghệ sinh học, những nuclease hoạt động với các trình tự cụ thể được sử dụng trong nhân dòng phân tử (molecular cloning) và DNA pháp y.
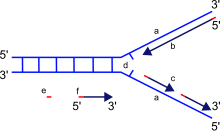
a: mạch khuôn, b: mạch dẫn đầu (leading strand), c: mạch ra chậm (lagging strand), d: replication fork, e: RNA primer, f: các đoạn Okazaki
Những enzyme có chức năng nối lại những đoạn DNA bị cắt hoặc bị đứt gãy được gọi là DNA ligase.[126] Ligase đặc biệt quan trọng cho việc nối lại các mạch đơn DNA ra chậm rời rạc (lagging strand DNA replication) hay các đoạn Okazaki tạo thành một bản sao mới hoàn chỉnh từ khuôn mẫu DNA. Chúng cũng tham gia vào sửa chữa DNA và tái tổ hợp di truyền.[126]
Topoisomerase và helicase
Topoisomerase là những enzyme có chức năng hoạt động của cả nuclease lẫn ligase. Những protein này thay đổi lượng siêu xoắn trong DNA. Một số enzyme này thực hiện cắt chuỗi xoắn ốc DNA và cho phép một mạch đơn có thể quay, do vậy giảm mức siêu xoắn của nó; enzyme sau đó gắn lại đoạn DNA bị gãy.[44] Những loại enzyme khác có khả năng cắt một chuỗi xoắn kép DNA và rồi kéo một đoạn mạch kép DNA thứ hai vào vị trí cắt này, trước khi thực hiện nối lại chuỗi xoắn kép.[127] Topoisomerase cần thiết cho nhiều quá trình có sự tham gia của DNA, như sao chép và phiên mã DNA.[45]
Helicase là những protein thuộc vào loại các động cơ phân tử. Chúng sử dụng năng lượng hóa học trong nucleoside triphosphate, nổi bật là adenosine triphosphate (ATP), để phá vỡ liên kết hiđrô giữa các base và tháo xoắn chuỗi kép DNA thành hai mạch đơn.[128] Những enzyme này có vai trò quan trọng cơ bản đối với mọi quá trình nơi các enzyme cần thiết phải tương tác với các base của DNA.
Polymerase

Polymerase là những enzyme thực hiện tổng hợp chuỗi polynucleotide từ nucleoside triphosphate. Tính tuần tự của các sản phẩm của chúng được sinh ra dựa trên những chuỗi polynucleotide đã có—gọi là các khuôn mẫu. Những enzyme này hoạt động bằng lần lượt thêm vào một nucleotide tại nhóm 3′ hydroxyl ở điểm cuối của chuỗi polynucleotide đang lớn lên. Kết quả là, mọi polymerases hoạt động luôn theo hướng đầu 5′ đến đầu 3′.[129] Tại vị trí hoạt hóa (active site) của các enzyme này, phân tử nucleoside triphosphate ghép cặp với base của khuôn mẫu: điều này cho phép polymerase tổng hợp một cách chính xác mạch bổ sung đối với khuôn mẫu. Các polymerase được phân loại theo các nhóm khuôn mẫu mà chúng sẽ sử dụng.
Trong quá trình sao chép DNA, DNA polymerase phụ thuộc-DNA thực hiện sao chép chuỗi polynucleotide DNA. Để bảo toàn thông tin sinh học, điều cơ bản là trình tự của các base trong mỗi bản sao là trình tự bổ sung chính xác cho trình tự base trong mạch khuôn mẫu. Nhiều DNA polymerases có tính năng đọc và sửa sai (proofreading). Ở đây, polymerase nhận ra các lỗi thường xuất hiện trong phản ứng tổng hợp do sự thiếu cặp base giữa các nucleotide không khớp với nhau. Nếu nó phát hiện một sự không ăn khớp, một exonuclease hoạt động từ đầu 3′ đến 5′ được kích hoạt và base không khớp nào được phát hiện sẽ bị cắt bỏ.[130] Trong hầu hết các sinh vật, DNA polymerases hoạt động trong phức hợp lớn gọi là replisome mà nó chứa nhiều tiểu đơn vị phụ, như protein kẹp DNA (DNA clamp) hay helicase.[131]
DNA polymerase phụ thuộc-RNA là những loại polymerase chuyên biệt thực hiện sao chép trình tự của mạch RNA sang DNA. Chúng bao gồm enzyme phiên mã ngược (reverse transcriptase, RT), ví dụ như một enzyme của vi rút retrovirus tham gia vào xâm nhập tế bào, và telomerase, mà cần cho quán trình sao chép của telomere.[65][132] Telomerase là một polymerase khác thường bởi vì nó chứa chính khuôn mẫu RNA của nó như là một phần trong cấu trúc của enzyme này.[66]
Sự phiên mã được thực hiện bởi RNA polymerase phụ thuộc-DNA mà sao chép trình tự của mạch DNA sang RNA. Để bắt đầu giải mã một gen, RNA polymerase gắn với một trình tự của DNA gọi là promoter (vùng gen khởi động) và tách hai mạch DNA khỏi nhau. Sau đó nó sao chép trình tự gen vào một RNA thông tin cho đến khi nó đi đến vùng kết thúc (terminator) của DNA, nơi RNA polymerase dừng lại và tách khỏi DNA. Với DNA polymerase phụ thuộc-DNA ở người, RNA polymerase II, enzyme thực hiện phiên mã hầu hết các gen trong bộ gen ở người, hoạt động như là một phần của một phức hợp protein lớn với nhiều tiểu đơn vị phụ và vùng điều hòa khác nhau.[133]
Tái tổ hợp di truyền
|

|
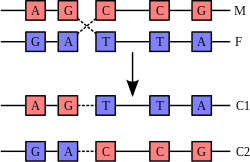
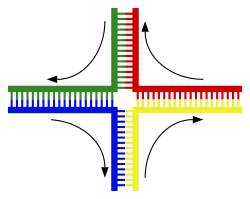
Chuỗi xoắn kép DNA thường không tương tác với những đoạn khác của DNA, và trong tế bào người các nhiễm sắc thể khác nhau thậm chí nằm ở những vùng tách biệt trong nhân tế bào gọi là "vùng nhiễm sắc thể" (chromosome territories).[135] Sự tách biệt về không gian giữa các nhiễm sắc thể khác nhau là quan trọng đối với khả năng hoạt động của DNA như là nơi lưu giữ ổn định của thông tin, khi một vài lần nhiễm sắc thể tương tác trong sự trao đổi chéo nhiễm sắc thể xảy ra trong quá trình sinh sản hữu tính, khi ấy tái tổ hợp di truyền diễn ra. Trao đổi chéo nhiễm sắc thể là khi hai chuỗi xoắn DNA tháo xoắn và tách rời từng mạch đơn ra, trao đổi các đoạn DNA cho nhau rồi tái gắn kết hai mạch đơn lại.
Tái tổ hợp cho phép nhiễm sắc thể trao đổi thông tin di truyền và tạo ra những tổ hợp gen mới, làm tăng hiệu quả của tính chọn lọc tự nhiên và có thể quan trọng đối với sự tiến hóa nhanh chóng cho những protein mới.[136] Tái tổ hợp di truyền cũng bao gồm trong quá trình sửa chữa DNA, đặc biệt trong sự đáp ứng của tế bào đối với khi chuỗi xoắn kép bị đứt gãy.[137]
Dạng phổ biến nhất của trao đổi chéo nhiễm sắc thể là tái tổ hợp tương đồng, khi hai nhiễm sắc thể tham gia có trình tự DNA tương đồng. Tái tổ hợp không tương đồng có thể phá hủy tế bào, gây ra chuyển đoạn nhiễm sắc thể (chromosomal translocation) và đột biến di truyền. Phản ứng tái tổ hợp được xúc tác bởi các enzyme recombinase, như RAD51.[138] Bước đầu tiên trong quá trình tái tổ hợp là một chuỗi DNA bị đứt gãy do tác động bởi endonuclease hay những phá hủy đối với DNA.[139] Một loạt các bước tiếp theo có sự xúc tác một phần của recombinase sau đó hai mạch xoắn nối lại tại ít nhất một tiếp xúc Holliday (Holliday junction), trong đó một đoạn của mạch đơn của chuỗi xoắn kép này được ghép nối với đoạn mạch đối ứng của chuỗi xoắn kép kia. Thể trung gian Holliday là một cấu trúc tiếp xúc bậc bốn mà có thể di chuyển dọc theo cặp nhiễm sắc thể, tráo đổi một mạch cho sang mạch khác. Phản ứng tái tổ hợp bị dừng lại khi tiếp xúc Holliday bị đứt và giải phóng chuỗi DNA sau khi nó được buộc lại.[140]
Sử dụng trong công nghệ
Kỹ thuật di truyền
Nhiều phương pháp đã được phát triển để sàng lọc DNA từ sinh vật sống, như chiết bằng phenol-clorofom, và thao tác với nó trong phòng thí nghiệm, như phân loại giới hạn (restriction digest) và phản ứng chuỗi trùng hợp. Sinh học hiện đại và ngành hóa sinh sử dụng thường xuyên những kỹ thuật này trong công nghệ tái tổ hợp DNA. Tái tổ hợp DNA là một trình tự DNA nhân tạo được lắp ghép từ các trình tự DNA khác. Chúng được biến nạp vào tế bào sinh vật dưới dạng plasmid hoặc trong những dạng thích hợp khác, bằng cách sử dụng vật chủ trung gian virut (viral vector).[141] Sản phẩm sinh vật chỉnh sửa di truyền có thể được ứng dụng để sinh ra các sản phẩm như protein tái tổ hợp, sử dụng trong nghiên cứu y học,[142] hoặc được nuôi trồng trong nông nghiệp.[143][144]
Kỹ thuật nhận diện DNA
Các nhà khoa học pháp y sử dụng DNA trong máu, tinh dịch, da, nước bọt hay tóc tìm thấy tại hiện trường để nhận ra DNA khớp với của một cá nhân, như của thủ phạm chẳng hạn. Quá trình này được gọi là kỹ thuật nhận diện DNA (DNA profiling), hay còn gọi là dấu vết di truyền ("genetic fingerprinting"). Trong kỹ thuật nhận diện DNA, độ dài của nhiều đoạn DNA lặp lại, như các đoạn ngắn chứa từ 3 đến 5 gốc base, được so sánh giữa các cá nhân liên quan với nhau. Phương pháp này thường là một kỹ thuật cực kỳ tin cậy cho phép nhận ra các trình tự DNA khớp với nhau.[145] Tuy vậy, việc nhận dạng có thể trở lên phức tạp nếu tại hiện trường gây án có nhiều DNA của nhiều người.[146] Kỹ thuật nhận diện DNA được phát triển vào năm 1984 bởi nhà di truyền học người Anh Sir Alec Jeffreys,[147] và lần đầu tiên được sử dụng trong ngành pháp y để cáo buộc Colin Pitchfork trong vụ án Enderby năm 1988.[148]
Sự phát triển của khoa học pháp y, và khả năng hiện nay có thể nhận ra thông tin di truyền từ các mẫu máu, da, nước bọt, hay tóc đã dẫn đến nhiều vụ án phải lật lại hồ sơ mặc dù tòa đã tuyên án. Chứng cứ mà hiện nay có thể được tiết lộ ra trong khi ở thời điểm kiểm tra là bất khả thi về mặt khoa học. Kết hợp với đạo luật loại bỏ trường hợp bất trùng khả tố (double jeopardy-một người không bị xử hai lần về một tội) ở một số nơi, đã cho phép khởi tố lại một số vụ án khi bản án trước đó đã không nêu được chứng cứ thuyết phục để kết án. Những người mang tội danh nặng được phép yêu cầu lấy mẫu DNA để làm mục đích so sánh. Trường hợp biện hộ rõ ràng nhất đó là mẫu DNA nhận được từ pháp y bị cho là đã bị ảnh hưởng từ những người ở xung quanh vụ án. Điều này làm cho các thủ tục điều tra trở lên chặt chẽ hơn trong những trường hợp phạm tội mới. Nhận diện DNA cũng được áp dụng thành công cho nhận dạng các nạn nhân trong những vụ tai nạn có thương vong lớn,[149] từ những phần cơ thể, và nhận biết từng nạn nhân trong những mồ chôn tập thể trong chiến tranh, thông qua so sánh với DNA của người nhà nạn nhân.
Kỹ thuật nhận diện DNA cũng được sử dụng để xác định mối liên hệ sinh học với cha mẹ hoặc ông bà của một đứa trẻ với xác suất chính xác lên tới 99,99%.[150]
DNA enzyme hay xúc tác DNA
Deoxyribozyme, cũng gọi là DNAzyme hay xúc tác DNA được phát hiện lần đầu tiên vào năm 1994.[151] Chúng là những mạch đơn DNA độc lập khỏi các trình tự DNA qua kỹ thuật lựa chọn in vitro các phối tử (ligand). DNAzyme tham gia xúc tác các phản ứng hóa học bao gồm phân cắt RNA-DNA, phối tử RNA-DNA, sự phosphoryl hóa - sự loại phosphoryl hóa các axit amin, hình thành liên kết cacbon-cacbon... DNAzyme có thể tăng cường tốc độ phản ứng hóa học gấp 100.000.000.000 so với phản ứng không có sự tham gia xúc tác của nó.[152] Các DNAzyme được nghiên cứu nhiều nhất là những loại cắt-RNA dùng để xác định các ion kim loại và thiết kế các tác nhân trị liệu. Một vài DNAzyme đặc hiệu ion kim loại bao gồm GR-5 DNAzyme (đặc hiệu với chì),[151] CA1-3 DNAzymes (với đồng),[153] 39E DNAzyme (với uranyl) và NaA43 DNAzyme (với natri).[154] NaA43 DNAzyme, nhạy với natri gấp 10.000 lần so với các ion khác, được dùng để theo dõi natri trong thời gian thực ở tế bào sống.
Tin sinh học

Tin sinh học bao gồm các kỹ thuật lưu trữ, khai phá dữ liệu, tìm kiếm và thao tác với dữ liệu sinh học, bao gồm dữ liệu về trình tự ADN. Các kỹ thuật này mang đến sự ứng dụng rộng rãi của khoa học máy tính, đặc biệt là thuật toán tìm kiếm chuỗi, học máy và lý thuyết cơ sở dữ liệu.[155] Thuật toán tìm kiếm chuỗi hay so khớp, trong đó tìm kiếm sự xuất hiện của một trình tự các chữ cái trong một trình tự các chữ cái lớn hơn, được phát triển để tìm một trình tự nucleotide cụ thể.[156] Trình tự DNA có thể sắp gióng với những trình tự DNA khác để nhận ra các trình tự tương đồng (homology) và xác định vị trí đột biến khiến chúng khác biệt. Những kỹ thuật này, đặc biệt là kỹ thuật "sắp gióng cột nhiều trình tự" (multiple sequence alignment), được sử dụng để nghiên cứu các mối quan hệ phát sinh chủng loài học và chức năng của protein.[157] Tập hợp dữ liệu của toàn bộ trình tự DNA, như được lập ra bởi Human Genome Project, là khó để sử dụng mà không có các chú giải cho phép nhận ra vị trí của các gene hay các yếu tố điều hòa ở mỗi nhiễm sắc thể. Vùng trình tự DNA với những phần đặc trưng gắn với gene mã hóa cho protein hoặc RNA có thể tìm ra bằng thuật toán tìm kiếm gene (gene finding algorithm), cho phép các nhà nghiên cứu dự đoán sự có mặt của những sinh phẩm đặc biệt mã hóa bởi gene và chức năng của chúng trong sinh vật trước khi chúng được phát hiện bằng thực nghiệm.[158]
Công nghệ nano DNA

Công nghệ nano DNA sử dụng những tính chất tương tác của phân tử DNA và những axit nucleic khác để tạo ra những phức hợp tự lắp ráp DNA có tính năng hữu ích.[159] Do vậy DNA được sử dụng như là vật liệu cấu trúc hơn là vật liệu mang thông tin sinh học. Các nhà khoa học đã tạo ra những dàn mạng hai chiều tuần hoàn (bằng phương pháp lát gạch và origami DNA) và cấu trúc ba chiều đa diện đều.[160] Thiết bị cơ nano và máy tính DNA have cũng được chứng minh là khả dĩ,[161] và những cấu trúc DNA này dùng làm khuôn mẫu để xắp sếp các phân tử khác như hệ keo nguyên tử vàng và protein streptavidin trong vi khuẩn Streptomyces avidinii.[162]
Lịch sử và nhân chủng học
Bởi vì theo thời gian DNA tích lũy các đột biến, do vậy chúng được di truyền lại, nó chứa thông tin lịch sử, và bằng cách so sánh các trình tự DNA, các nhà di truyền học có thể suy luận ra lịch sử tiến hóa của mỗi loài sinh vật, hay phát sinh chủng loài của chúng.[163] Lĩnh vực phát sinh chủng loài học là một công cụ mạnh của sinh học tiến hóa. Nếu so sánh những trình tự DNA của một loài với nhau, các nhà di truyền quần thể có thể biết được lịch sự phát triển của một quần thể đang nghiên cứu. Kết quả nghiên cứu của ngành này được áp dụng sang cho di truyền sinh thái (ecological genetics) và nhân chủng học; Ví dụ, các nhà khoa học sử dụng bằng chứng DNA để nghiên cứu Mười bộ tộc biến mất (Ten Lost Tribes) của Israel.[164][165]
Chú thích
- ^ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2014). Molecular Biology of the Cell (ấn bản 6). Garland. tr. Chapter 4: DNA, Chromosomes and Genomes. ISBN 9780815344322.
- ^ Purcell, Adam. “DNA”. Basic Biology.
- ^ Nuwer, Rachel (18 tháng 7 năm 2015). “Counting All the DNA on Earth”. The New York Times. New York: The New York Times Company. ISSN 0362-4331. Truy cập ngày 18 tháng 7 năm 2015.
- ^ “The Biosphere: Diversity of Life”. Aspen Global Change Institute. Basalt, CO. Truy cập ngày 19 tháng 7 năm 2015.
- ^ Russell, Peter (2001). iGenetics. New York: Benjamin Cummings. ISBN 0-8053-4553-1.
- ^ Mashaghi A, Katan A (2013). “A physicist's view of DNA”. De Physicus. 24e (3): 59–61. arXiv:1311.2545v1. Bibcode:2013arXiv1311.2545M.
- ^ Saenger, Wolfram (1984). Principles of Nucleic Acid Structure. New York: Springer-Verlag. ISBN 0-387-90762-9.
- ^ a b Alberts, Bruce; Johnson, Alexander; Lewis, Julian; Raff, Martin; Roberts, Keith; Walters, Peter (2002). Molecular Biology of the Cell; Fourth Edition. New York and London: Garland Science. ISBN 0-8153-3218-1. OCLC 145080076.
- ^ Irobalieva, Rossitza N.; Fogg, Jonathan M.; Catanese Jr, Daniel J.; Sutthibutpong, Thana; Chen, Muyuan; Barker, Anna K.; Ludtke, Steven J.; Harris, Sarah A.; Schmid, Michael F. (12 tháng 10 năm 2015). “Structural diversity of supercoiled DNA”. Nature Communications. 6: 8440. doi:10.1038/ncomms9440. PMC 4608029. PMID 26455586.
- ^ a b c Watson JD, Crick FH (1953). “A Structure for Deoxyribose Nucleic Acid” (PDF). Nature. 171 (4356): 737–738. Bibcode:1953Natur.171..737W. doi:10.1038/171737a0. PMID 13054692.
- ^ Mandelkern M, Elias JG, Eden D, Crothers DM (1981). “The dimensions of DNA in solution”. J Mol Biol. 152 (1): 153–61. doi:10.1016/0022-2836(81)90099-1. PMID 7338906.
- ^ Gregory SG, Barlow KF, McLay KE, Kaul R, Swarbreck D, Dunham A, và đồng nghiệp (2006). “The DNA sequence and biological annotation of human chromosome 1”. Nature. 441 (7091): 315–21. Bibcode:2006Natur.441..315G. doi:10.1038/nature04727. PMID 16710414.
- ^ a b c Berg J., Tymoczko J. and Stryer L. (2002) Biochemistry. W. H. Freeman and Company ISBN 0-7167-4955-6
- ^ Abbreviations and Symbols for Nucleic Acids, Polynucleotides and their Constituents IUPAC-IUB Commission on Biochemical Nomenclature (CBN). Truy cập 17 tháng 7 năm 2016.
- ^ a b Ghosh A, Bansal M (2003). “A glossary of DNA structures from A to Z”. Acta Crystallogr D. 59 (4): 620–6. doi:10.1107/S0907444903003251. PMID 12657780.
- ^ Lấy từ PDB 1D65
- ^ Yakovchuk P, Protozanova E, Frank-Kamenetskii MD (2006). “Base-stacking and base-pairing contributions into thermal stability of the DNA double helix”. Nucleic Acids Res. 34 (2): 564–74. doi:10.1093/nar/gkj454. PMC 1360284. PMID 16449200.
- ^ Burton E. Tropp - "Molecular Biology"- Jones and Barlett Learning, ISBN 978-0-7637-8663-2
- ^ “Watson-Crick Structure of DNA - 1953”. Steven Carr. Memorial University of Newfoundland. Truy cập ngày 13 tháng 7 năm 2016.
- ^ Verma S, Eckstein F (1998). “Modified oligonucleotides: synthesis and strategy for users”. Annu. Rev. Biochem. 67: 99–134. doi:10.1146/annurev.biochem.67.1.99. PMID 9759484.
- ^ Kiljunen S, Hakala K, Pinta E, Huttunen S, Pluta P, Gador A, Lönnberg H, Skurnik M (2005). “Yersiniophage phiR1-37 is a tailed bacteriophage having a 270 kb DNA genome with thymidine replaced by deoxyuridine”. Microbiology. 151 (12): 4093–4102. doi:10.1099/mic.0.28265-0. PMID 16339954.
- ^ Uchiyama J, Takemura-Uchiyama I, Sakaguchi Y, Gamoh K, Kato SI, Daibata M, Ujihara T, Misawa N, Matsuzaki S (tháng 3 năm 2014). “Intragenus generalized transduction in Staphylococcus spp. by a novel giant phage”. ISME J. 8: 1949–1952. doi:10.1038/ismej.2014.29.
- ^ Simpson L (1998). “A base called J”. Proc Natl Acad Sci USA. 95 (5): 2037–2038. Bibcode:1998PNAS...95.2037S. doi:10.1073/pnas.95.5.2037. PMC 33841. PMID 9482833.
- ^ Borst P, Sabatini R (2008). “Base J: discovery, biosynthesis, and possible functions”. Annual Review of Microbiology. 62: 235–51. doi:10.1146/annurev.micro.62.081307.162750. PMID 18729733.
- ^ Cross M, Kieft R, Sabatini R, Wilm M, de Kort M, van der Marel GA, van Boom JH, van Leeuwen F, Borst P (1999). “The modified base J is the target for a novel DNA-binding protein in kinetoplastid protozoans”. The EMBO Journal. 18 (22): 6573–6581. doi:10.1093/emboj/18.22.6573. PMC 1171720. PMID 10562569.
- ^ DiPaolo C, Kieft R, Cross M, Sabatini R (2005). “Regulation of trypanosome DNA glycosylation by a SWI2/SNF2-like protein”. Mol Cell. 17 (3): 441–451. doi:10.1016/j.molcel.2004.12.022. PMID 15694344.
- ^ Vainio S, Genest PA, ter Riet B, van Luenen H, Borst P (2009). “Evidence that J-binding protein 2 is a thymidine hydroxylase catalyzing the first step in the biosynthesis of DNA base J”. Molecular and biochemical parasitology. 164 (2): 157–61. doi:10.1016/j.molbiopara.2008.12.001. PMID 19114062.
- ^ Iyer LM, Tahiliani M, Rao A, Aravind L (2009). “Prediction of novel families of enzymes involved in oxidative and other complex modifications of bases in nucleic acids”. Cell Cycle. 8 (11): 1698–1710. doi:10.4161/cc.8.11.8580. PMC 2995806. PMID 19411852.
- ^ van Luenen HG, Farris C, Jan S, Genest PA, Tripathi P, Velds A, Kerkhoven RM, Nieuwland M, Haydock A, Ramasamy G, Vainio S, Heidebrecht T, Perrakis A, Pagie L, van Steensel B, Myler PJ, Borst P (2012). “Leishmania”. Cell. 150 (5): 909–921. doi:10.1016/j.cell.2012.07.030. PMC 3684241. PMID 22939620.
- ^ Hazelbaker DZ, Buratowski S (2012). “Transcription: base J blocks the way”. Curr Biol. 22 (22): R960–2. doi:10.1016/j.cub.2012.10.010. PMC 3648658. PMID 23174300.
- ^ Wing R, Drew H, Takano T, Broka C, Tanaka S, Itakura K, Dickerson RE (1980). “Crystal structure analysis of a complete turn of B-DNA”. Nature. 287 (5784): 755–8. Bibcode:1980Natur.287..755W. doi:10.1038/287755a0. PMID 7432492.
- ^ a b Pabo CO, Sauer RT (1984). “Protein-DNA recognition”. Annu Rev Biochem. 53: 293–321. doi:10.1146/annurev.bi.53.070184.001453. PMID 6236744.
- ^ Clausen-Schaumann H, Rief M, Tolksdorf C, Gaub HE (2000). “Mechanical stability of single DNA molecules”. Biophys J. 78 (4): 1997–2007. Bibcode:2000BpJ....78.1997C. doi:10.1016/S0006-3495(00)76747-6. PMC 1300792. PMID 10733978.
- ^ Chalikian TV, Völker J, Plum GE, Breslauer KJ (1999). “A more unified picture for the thermodynamics of nucleic acid duplex melting: A characterization by calorimetric and volumetric techniques”. Proc Natl Acad Sci USA. 96 (14): 7853–8. Bibcode:1999PNAS...96.7853C. doi:10.1073/pnas.96.14.7853. PMC 22151. PMID 10393911.
- ^ deHaseth PL, Helmann JD (1995). “Open complex formation by Escherichia coli RNA polymerase: the mechanism of polymerase-induced strand separation of double helical DNA”. Mol Microbiol. 16 (5): 817–24. doi:10.1111/j.1365-2958.1995.tb02309.x. PMID 7476180.
- ^ Isaksson J, Acharya S, Barman J, Cheruku P, Chattopadhyaya J (2004). “Single-stranded adenine-rich DNA and RNA retain structural characteristics of their respective double-stranded conformations and show directional differences in stacking pattern”. Biochemistry. 43 (51): 15996–6010. doi:10.1021/bi048221v. PMID 15609994.
- ^ Designation of the two strands of DNA JCBN/NC-IUB Newsletter 1989. Retrieved 7 May 2008
- ^ Hüttenhofer A, Schattner P, Polacek N (2005). “Non-coding RNAs: hope or hype?”. Trends Genet. 21 (5): 289–97. doi:10.1016/j.tig.2005.03.007. PMID 15851066.
- ^ Munroe SH (2004). “Diversity of antisense regulation in eukaryotes: multiple mechanisms, emerging patterns”. J Cell Biochem. 93 (4): 664–71. doi:10.1002/jcb.20252. PMID 15389973.
- ^ Makalowska I, Lin CF, Makalowski W (2005). “Overlapping genes in vertebrate genomes”. Comput Biol Chem. 29 (1): 1–12. doi:10.1016/j.compbiolchem.2004.12.006. PMID 15680581.
- ^ Johnson ZI, Chisholm SW (2004). “Properties of overlapping genes are conserved across microbial genomes”. Genome Res. 14 (11): 2268–72. doi:10.1101/gr.2433104. PMC 525685. PMID 15520290.
- ^ Lamb RA, Horvath CM (1991). “Diversity of coding strategies in influenza viruses”. Trends Genet. 7 (8): 261–6. doi:10.1016/0168-9525(91)90326-L. PMID 1771674.
- ^ Benham CJ, Mielke SP (2005). “DNA mechanics”. Annu Rev Biomed Eng. 7: 21–53. doi:10.1146/annurev.bioeng.6.062403.132016. PMID 16004565.
- ^ a b Champoux JJ (2001). “DNA topoisomerases: structure, function, and mechanism”. Annu Rev Biochem. 70: 369–413. doi:10.1146/annurev.biochem.70.1.369. PMID 11395412.
- ^ a b Wang JC (2002). “Cellular roles of DNA topoisomerases: a molecular perspective”. Nature Reviews Molecular Cell Biology. 3 (6): 430–40. doi:10.1038/nrm831. PMID 12042765.
- ^ Basu HS, Feuerstein BG, Zarling DA, Shafer RH, Marton LJ (1988). “Recognition of Z-RNA and Z-DNA determinants by polyamines in solution: experimental and theoretical studies”. J Biomol Struct Dyn. 6 (2): 299–309. doi:10.1080/07391102.1988.10507714. PMID 2482766.
- ^ Franklin RE, Gosling RG (6 tháng 3 năm 1953). “The Structure of Sodium Thymonucleate Fibres I. The Influence of Water Content” (PDF). Acta Crystallogr. 6 (8–9): 673–7. doi:10.1107/S0365110X53001939.
Franklin RE, Gosling RG (1953). “The structure of sodium thymonucleate fibres. II. The cylindrically symmetrical Patterson function”. Acta Crystallogr. 6 (8–9): 678–85. doi:10.1107/S0365110X53001940. - ^ Franklin RE, Gosling RG (1953). “Molecular Configuration in Sodium Thymonucleate. Franklin R. and Gosling R.G” (PDF). Nature. 171 (4356): 740–1. Bibcode:1953Natur.171..740F. doi:10.1038/171740a0. PMID 13054694.
- ^ Wilkins MH, Stokes AR, Wilson HR (1953). “Molecular Structure of Deoxypentose Nucleic Acids” (PDF). Nature. 171 (4356): 738–740. Bibcode:1953Natur.171..738W. doi:10.1038/171738a0. PMID 13054693.
- ^ Leslie AG, Arnott S, Chandrasekaran R, Ratliff RL (1980). “Polymorphism of DNA double helices”. J. Mol. Biol. 143 (1): 49–72. doi:10.1016/0022-2836(80)90124-2. PMID 7441761.
- ^ Baianu, I.C. (1980). “Structural Order and Partial Disorder in Biological systems”. Bull. Math. Biol. 42 (4): 137–141. doi:10.1016/s0092-8240(80)80083-8. http://cogprints.org/3822/
- ^ Hosemann R., Bagchi R.N., Direct analysis of diffraction by matter, North-Holland Publs., Amsterdam – New York, 1962.
- ^ Baianu, I.C. (1978). “X-ray scattering by partially disordered membrane systems”. Acta Crystallogr. A. 34 (5): 751–3. Bibcode:1978AcCrA..34..751B. doi:10.1107/S0567739478001540.
- ^ Wahl MC, Sundaralingam M (1997). “Crystal structures of A-DNA duplexes”. Biopolymers. 44 (1): 45–63. doi:10.1002/(SICI)1097-0282(1997)44:1<45::AID-BIP4>3.0.CO;2-#. PMID 9097733.
- ^ Lu XJ, Shakked Z, Olson WK (2000). “A-form conformational motifs in ligand-bound DNA structures”. J. Mol. Biol. 300 (4): 819–40. doi:10.1006/jmbi.2000.3690. PMID 10891271.
- ^ Rothenburg S, Koch-Nolte F, Haag F (2001). “DNA methylation and Z-DNA formation as mediators of quantitative differences in the expression of alleles”. Immunol Rev. 184: 286–98. doi:10.1034/j.1600-065x.2001.1840125.x. PMID 12086319.
- ^ Oh DB, Kim YG, Rich A (2002). “Z-DNA-binding proteins can act as potent effectors of gene expression in vivo”. Proc. Natl. Acad. Sci. U.S.A. 99 (26): 16666–71. Bibcode:2002PNAS...9916666O. doi:10.1073/pnas.262672699. PMC 139201. PMID 12486233.
- ^ Rich A, Norheim A, Wang AH (1984). “The chemistry and biology of left-handed Z-DNA”. Annual Review of Biochemistry. 53: 791–846. doi:10.1146/annurev.bi.53.070184.004043. PMID 6383204.
- ^ Sinden, Richard R (15 tháng 1 năm 1994). DNA structure and function (ấn bản 1). Academic Press. tr. 398. ISBN 0-12-645750-6.
- ^ Ho PS (27 tháng 9 năm 1994). “The non-B-DNA structure of d(CA/TG)n does not differ from that of Z-DNA”. Proc Natl Acad Sci USA. 91 (20): 9549–9553. Bibcode:1994PNAS...91.9549H. doi:10.1073/pnas.91.20.9549. PMC 44850. PMID 7937803.
- ^ a b Palmer, Jason (2 tháng 12 năm 2010). “Arsenic-loving bacteria may help in hunt for alien life”. BBC News. Truy cập ngày 2 tháng 12 năm 2010.
- ^ a b Bortman, Henry (2 tháng 12 năm 2010). “Arsenic-Eating Bacteria Opens New Possibilities for Alien Life”. Space.com. Truy cập ngày 2 tháng 12 năm 2010.
- ^ Katsnelson, Alla (2 tháng 12 năm 2010). “Arsenic-eating microbe may redefine chemistry of life”. Nature News. doi:10.1038/news.2010.645.
- ^ Cressey, Daniel (3 tháng 10 năm 2012). “'Arsenic-life' Bacterium Prefers Phosphorus after all”. Nature News. doi:10.1038/nature.2012.11520.
- ^ a b Greider CW, Blackburn EH (1985). “Identification of a specific telomere terminal transferase activity in Tetrahymena extracts”. Cell. 43 (2 Pt 1): 405–13. doi:10.1016/0092-8674(85)90170-9. PMID 3907856.
- ^ a b c Nugent CI, Lundblad V (1998). “The telomerase reverse transcriptase: components and regulation”. Genes Dev. 12 (8): 1073–85. doi:10.1101/gad.12.8.1073. PMID 9553037.
- ^ Wright WE, Tesmer VM, Huffman KE, Levene SD, Shay JW (1997). “Normal human chromosomes have long G-rich telomeric overhangs at one end”. Genes Dev. 11 (21): 2801–9. doi:10.1101/gad.11.21.2801. PMC 316649. PMID 9353250.
- ^ Created from NDB UD0017
- ^ a b Burge S, Parkinson GN, Hazel P, Todd AK, Neidle S (2006). “Quadruplex DNA: sequence, topology and structure”. Nucleic Acids Res. 34 (19): 5402–15. doi:10.1093/nar/gkl655. PMC 1636468. PMID 17012276.
- ^ Parkinson GN, Lee MP, Neidle S (2002). “Crystal structure of parallel quadruplexes from human telomeric DNA”. Nature. 417 (6891): 876–80. Bibcode:2002Natur.417..876P. doi:10.1038/nature755. PMID 12050675.
- ^ Griffith JD, Comeau L, Rosenfield S, Stansel RM, Bianchi A, Moss H, de Lange T (1999). “Mammalian telomeres end in a large duplex loop”. Cell. 97 (4): 503–14. doi:10.1016/S0092-8674(00)80760-6. PMID 10338214.
- ^ Seeman NC (2005). “DNA enables nanoscale control of the structure of matter”. Q. Rev. Biophys. 38 (4): 363–71. doi:10.1017/S0033583505004087. PMC 3478329. PMID 16515737.
- ^ Hu Q, Rosenfeld MG (2012). “Epigenetic regulation of human embryonic stem cells”. Frontiers in Genetics. 3: 238. doi:10.3389/fgene.2012.00238. PMC 3488762. PMID 23133442.
- ^ Klose RJ, Bird AP (2006). “Genomic DNA methylation: the mark and its mediators”. Trends Biochem Sci. 31 (2): 89–97. doi:10.1016/j.tibs.2005.12.008. PMID 16403636.
- ^ Bird A (2002). “DNA methylation patterns and epigenetic memory”. Genes Dev. 16 (1): 6–21. doi:10.1101/gad.947102. PMID 11782440.
- ^ Walsh CP, Xu GL (2006). “Cytosine methylation and DNA repair”. Curr Top Microbiol Immunol. Current Topics in Microbiology and Immunology. 301: 283–315. doi:10.1007/3-540-31390-7_11. ISBN 3-540-29114-8. PMID 16570853.
- ^ Kriaucionis S, Heintz N (2009). “The nuclear DNA base 5-hydroxymethylcytosine is present in Purkinje neurons and the brain”. Science. 324 (5929): 929–30. Bibcode:2009Sci...324..929K. doi:10.1126/science.1169786. PMC 3263819. PMID 19372393.
- ^ Ratel D, Ravanat JL, Berger F, Wion D (2006). “N6-methyladenine: the other methylated base of DNA”. BioEssays. 28 (3): 309–15. doi:10.1002/bies.20342. PMC 2754416. PMID 16479578.
- ^ Gommers-Ampt JH, Van Leeuwen F, de Beer AL, Vliegenthart JF, Dizdaroglu M, Kowalak JA, Crain PF, Borst P (1993). “beta-D-glucosyl-hydroxymethyluracil: a novel modified base present in the DNA of the parasitic protozoan T. brucei”. Cell. 75 (6): 1129–36. doi:10.1016/0092-8674(93)90322-H. PMID 8261512.
- ^ Tạo ra từ PDB 1JDG
- ^ Douki T, Reynaud-Angelin A, Cadet J, Sage E (2003). “Bipyrimidine photoproducts rather than oxidative lesions are the main type of DNA damage involved in the genotoxic effect of solar UVA radiation”. Biochemistry. 42 (30): 9221–6. doi:10.1021/bi034593c. PMID 12885257.
- ^ Cadet J, Delatour T, Douki T, Gasparutto D, Pouget JP, Ravanat JL, Sauvaigo S (1999). “Hydroxyl radicals and DNA base damage”. Mutat Res. 424 (1–2): 9–21. doi:10.1016/S0027-5107(99)00004-4. PMID 10064846.
- ^ Beckman KB, Ames BN (1997). “Oxidative decay of DNA”. J. Biol. Chem. 272 (32): 19633–6. doi:10.1074/jbc.272.32.19633. PMID 9289489.
- ^ Valerie K, Povirk LF (2003). “Regulation and mechanisms of mammalian double-strand break repair”. Oncogene. 22 (37): 5792–812. doi:10.1038/sj.onc.1206679. PMID 12947387.
- ^ Johnson, George (28 tháng 12 năm 2010). “Unearthing Prehistoric Tumors, and Debate”. The New York Times.
If we lived long enough, sooner or later we all would get cancer.
- ^ Alberts, B; Johnson A, Lewis J; và đồng nghiệp (2002). “The Preventable Causes of Cancer”. Molecular biology of the cell (ấn bản 4). New York: Garland Science. ISBN 0-8153-4072-9.
A certain irreducible background incidence of cancer is to be expected regardless of circumstances: mutations can never be absolutely avoided, because they are an inescapable consequence of fundamental limitations on the accuracy of DNA replication, as discussed in Chapter 5. If a human could live long enough, it is inevitable that at least one of his or her cells would eventually accumulate a set of mutations sufficient for cancer to develop.
- ^ Bernstein H, Payne CM, Bernstein C, Garewal H, Dvorak K (2008). Cancer and aging as consequences of un-repaired DNA damage. In: New Research on DNA Damages (Editors: Honoka Kimura and Aoi Suzuki) Nova Science Publishers, Inc., New York, Chapter 1, pp. 1–47. open access, but read only https://www.novapublishers.com/catalog/product_info.php?products_id=43247 ISBN 978-1604565812
- ^ Hoeijmakers JH (tháng 10 năm 2009). “DNA damage, aging, and cancer”. N. Engl. J. Med. 361 (15): 1475–85. doi:10.1056/NEJMra0804615. PMID 19812404.
- ^ Freitas AA, de Magalhães JP (2011). “A review and appraisal of the DNA damage theory of ageing”. Mutat. Res. 728 (1–2): 12–22. doi:10.1016/j.mrrev.2011.05.001. PMID 21600302.
- ^ Ferguson LR, Denny WA (1991). “The genetic toxicology of acridines”. Mutat Res. 258 (2): 123–60. doi:10.1016/0165-1110(91)90006-H. PMID 1881402.
- ^ Stephens TD, Bunde CJ, Fillmore BJ (2000). “Mechanism of action in thalidomide teratogenesis”. Biochem Pharmacol. 59 (12): 1489–99. doi:10.1016/S0006-2952(99)00388-3. PMID 10799645.
- ^ Jeffrey AM (1985). “DNA modification by chemical carcinogens”. Pharmacol Ther. 28 (2): 237–72. doi:10.1016/0163-7258(85)90013-0. PMID 3936066.
- ^ Braña MF, Cacho M, Gradillas A, de Pascual-Teresa B, Ramos A (2001). “Intercalators as anticancer drugs”. Curr Pharm Des. 7 (17): 1745–80. doi:10.2174/1381612013397113. PMID 11562309.
- ^ Venter JC, Adams MD, Myers EW, Li PW, Mural RJ, Sutton GG, và đồng nghiệp (2001). “The sequence of the human genome”. Science. 291 (5507): 1304–51. Bibcode:2001Sci...291.1304V. doi:10.1126/science.1058040. PMID 11181995.
- ^ Thanbichler M, Wang SC, Shapiro L (2005). “The bacterial nucleoid: a highly organized and dynamic structure”. J Cell Biochem. 96 (3): 506–21. doi:10.1002/jcb.20519. PMID 15988757.
- ^ Hình tạo từ PDB 1MSW
- ^ Wolfsberg TG, McEntyre J, Schuler GD (2001). “Guide to the draft human genome”. Nature. 409 (6822): 824–6. Bibcode:2001Natur.409..824W. doi:10.1038/35057000. PMID 11236998.
- ^ Gregory TR (2005). “The C-value enigma in plants and animals: a review of parallels and an appeal for partnership”. Annals of Botany. 95 (1): 133–46. doi:10.1093/aob/mci009. PMID 15596463.
- ^ Birney E, Stamatoyannopoulos JA, Dutta A, Guigó R, Gingeras TR, Margulies EH, và đồng nghiệp (2007). “Identification and analysis of functional elements in 1% of the human genome by the ENCODE pilot project”. Nature. 447 (7146): 799–816. Bibcode:2007Natur.447..799B. doi:10.1038/nature05874. PMC 2212820. PMID 17571346.
- ^ Pidoux AL, Allshire RC (2005). “The role of heterochromatin in centromere function”. Philosophical Transactions of the Royal Society B. 360 (1455): 569–79. doi:10.1098/rstb.2004.1611. PMC 1569473. PMID 15905142.
- ^ Harrison PM, Hegyi H, Balasubramanian S, Luscombe NM, Bertone P, Echols N, Johnson T, Gerstein M (2002). “Molecular Fossils in the Human Genome: Identification and Analysis of the Pseudogenes in Chromosomes 21 and 22”. Genome Res. 12 (2): 272–80. doi:10.1101/gr.207102. PMC 155275. PMID 11827946.
- ^ Harrison PM, Gerstein M (2002). “Studying genomes through the aeons: protein families, pseudogenes and proteome evolution”. J Mol Biol. 318 (5): 1155–74. doi:10.1016/S0022-2836(02)00109-2. PMID 12083509.
- ^ Albà M (2001). “Replicative DNA polymerases”. Genome Biol. 2 (1): reviews3002.1–reviews3002.4. doi:10.1186/gb-2001-2-1-reviews3002. PMC 150442. PMID 11178285. Đã bỏ qua tham số không rõ
|nopp=(trợ giúp) - ^ “Replication fork”. Andrew Staroscik. scienceprimer.com. Truy cập 6 tháng 11 năm 2016.
- ^ Tani, Katsuji; Nasu, Masao (2010). “Roles of Extracellular DNA in Bacterial Ecosystems”. Trong Kikuchi, Yo; Rykova, Elena Y. (biên tập). Extracellular Nucleic Acids. Springer. tr. 25–38. ISBN 978-3-642-12616-1.
- ^ Vlassov, V. V.; Laktionov, P. P.; Rykova, E. Y. (2007). “Extracellular nucleic acids”. BioEssays. 29: 654–667. doi:10.1002/bies.20604.
- ^ Finkel, S. E.; Kolter, R. (2001). “DNA as a nutrient: novel role for bacterial competence gene homologs”. J. Bacteriol. 183: 6288–6293. doi:10.1128/JB.183.21.6288-6293.2001.
- ^ Mulcahy, H.; Charron-Mazenod, L.; Lewenza, S. (2008). “Extracellular DNA chelates cations and induces antibiotic resistance in Pseudomonas aeruginosa biofilms”. PLoS Pathog. 4: e1000213. doi:10.1371/journal.ppat.1000213.
- ^ Berne, C.; Kysela, D. T.; Brun, Y. V. (2010). “A bacterial extracellular DNA inhibits settling of motile progeny cells within a biofilm”. Mol. Microbiol. 77: 815–829. doi:10.1111/j.1365-2958.2010.07267.x.
- ^ Whitchurch, C. B.; Tolker-Nielsen, T.; Ragas, P. C.; Mattick, J. S. (2002). “Extracellular DNA required for bacterial biofilm formation” (PDF). Science. 295: 1487. doi:10.1126/science.295.5559.1487.
- ^ Hu, W.; Li, L.; Sharma, S.; Wang, J.; McHardy, I.; Lux, R.; Yang, Z.; He, X.; Gimzewski, J. K.; Li, Y.; Shi, W. (2012). “DNA Builds and Strengthens the Extracellular Matrix in Myxococcus xanthus Biofilms by Interacting with Exopolysaccharides”. PLoS ONE. 7 (12): e51905. Bibcode:2012PLoSO...751905H. doi:10.1371/journal.pone.0051905.
- ^ Sandman K, Pereira SL, Reeve JN (1998). “Diversity of prokaryotic chromosomal proteins and the origin of the nucleosome”. Cell Mol Life Sci. 54 (12): 1350–64. doi:10.1007/s000180050259. PMID 9893710.
- ^ Dame RT (2005). “The role of nucleoid-associated proteins in the organization and compaction of bacterial chromatin”. Mol. Microbiol. 56 (4): 858–70. doi:10.1111/j.1365-2958.2005.04598.x. PMID 15853876.
- ^ Luger K, Mäder AW, Richmond RK, Sargent DF, Richmond TJ (1997). “Crystal structure of the nucleosome core particle at 2.8 A resolution”. Nature. 389 (6648): 251–60. Bibcode:1997Natur.389..251L. doi:10.1038/38444. PMID 9305837.
- ^ Jenuwein T, Allis CD (2001). “Translating the histone code”. Science. 293 (5532): 1074–80. doi:10.1126/science.1063127. PMID 11498575.
- ^ Ito T (2003). “Nucleosome assembly and remodelling”. Curr Top Microbiol Immunol. Current Topics in Microbiology and Immunology. 274: 1–22. doi:10.1007/978-3-642-55747-7_1. ISBN 978-3-540-44208-0. PMID 12596902.
- ^ Thomas JO (2001). “HMG1 and 2: architectural DNA-binding proteins”. Biochem Soc Trans. 29 (Pt 4): 395–401. doi:10.1042/BST0290395. PMID 11497996.
- ^ Grosschedl R, Giese K, Pagel J (1994). “HMG domain proteins: architectural elements in the assembly of nucleoprotein structures”. Trends Genet. 10 (3): 94–100. doi:10.1016/0168-9525(94)90232-1. PMID 8178371.
- ^ Iftode C, Daniely Y, Borowiec JA (1999). “Replication protein A (RPA): the eukaryotic SSB”. Crit Rev Biochem Mol Biol. 34 (3): 141–80. doi:10.1080/10409239991209255. PMID 10473346.
- ^ Created from PDB 1LMB
- ^ Myers LC, Kornberg RD (2000). “Mediator of transcriptional regulation”. Annu Rev Biochem. 69: 729–49. doi:10.1146/annurev.biochem.69.1.729. PMID 10966474.
- ^ Spiegelman BM, Heinrich R (2004). “Biological control through regulated transcriptional coactivators”. Cell. 119 (2): 157–67. doi:10.1016/j.cell.2004.09.037. PMID 15479634.
- ^ Li Z, Van Calcar S, Qu C, Cavenee WK, Zhang MQ, Ren B (2003). “A global transcriptional regulatory role for c-Myc in Burkitt's lymphoma cells”. Proc Natl Acad Sci USA. 100 (14): 8164–9. Bibcode:2003PNAS..100.8164L. doi:10.1073/pnas.1332764100. PMC 166200. PMID 12808131.
- ^ Created from PDB 1RVA
- ^ Bickle TA, Krüger DH (1993). “Biology of DNA restriction”. Microbiol Rev. 57 (2): 434–50. PMC 372918. PMID 8336674.
- ^ a b Doherty AJ, Suh SW (2000). “Structural and mechanistic conservation in DNA ligases”. Nucleic Acids Res. 28 (21): 4051–8. doi:10.1093/nar/28.21.4051. PMC 113121. PMID 11058099.
- ^ Schoeffler AJ, Berger JM (2005). “Recent advances in understanding structure-function relationships in the type II topoisomerase mechanism”. Biochem Soc Trans. 33 (Pt 6): 1465–70. doi:10.1042/BST20051465. PMID 16246147.
- ^ Tuteja N, Tuteja R (2004). “Unraveling DNA helicases. Motif, structure, mechanism and function”. Eur J Biochem. 271 (10): 1849–63. doi:10.1111/j.1432-1033.2004.04094.x. PMID 15128295.
- ^ Joyce CM, Steitz TA (1995). “Polymerase structures and function: variations on a theme?”. J Bacteriol. 177 (22): 6321–9. PMC 177480. PMID 7592405.
- ^ Hubscher U, Maga G, Spadari S (2002). “Eukaryotic DNA polymerases”. Annu Rev Biochem. 71: 133–63. doi:10.1146/annurev.biochem.71.090501.150041. PMID 12045093.
- ^ Johnson A, O'Donnell M (2005). “Cellular DNA replicases: components and dynamics at the replication fork”. Annu Rev Biochem. 74: 283–315. doi:10.1146/annurev.biochem.73.011303.073859. PMID 15952889.
- ^ Tarrago-Litvak L, Andréola ML, Nevinsky GA, Sarih-Cottin L, Litvak S (1 tháng 5 năm 1994). “The reverse transcriptase of HIV-1: from enzymology to therapeutic intervention”. FASEB J. 8 (8): 497–503. PMID 7514143.
- ^ Martinez E (2002). “Multi-protein complexes in eukaryotic gene transcription”. Plant Mol Biol. 50 (6): 925–47. doi:10.1023/A:1021258713850. PMID 12516863.
- ^ Created from PDB 1M6G
- ^ Cremer T, Cremer C (2001). “Chromosome territories, nuclear architecture and gene regulation in mammalian cells”. Nature Reviews Genetics. 2 (4): 292–301. doi:10.1038/35066075. PMID 11283701.
- ^ Pál C, Papp B, Lercher MJ (2006). “An integrated view of protein evolution”. Nature Reviews Genetics. 7 (5): 337–48. doi:10.1038/nrg1838. PMID 16619049.
- ^ O'Driscoll M, Jeggo PA (2006). “The role of double-strand break repair – insights from human genetics”. Nature Reviews Genetics. 7 (1): 45–54. doi:10.1038/nrg1746. PMID 16369571.
- ^ Vispé S, Defais M (1997). “Mammalian Rad51 protein: a RecA homologue with pleiotropic functions”. Biochimie. 79 (9–10): 587–92. doi:10.1016/S0300-9084(97)82007-X. PMID 9466696.
- ^ Neale MJ, Keeney S (2006). “Clarifying the mechanics of DNA strand exchange in meiotic recombination”. Nature. 442 (7099): 153–8. Bibcode:2006Natur.442..153N. doi:10.1038/nature04885. PMID 16838012.
- ^ Dickman MJ, Ingleston SM, Sedelnikova SE, Rafferty JB, Lloyd RG, Grasby JA, Hornby DP (2002). “The RuvABC resolvasome”. Eur J Biochem. 269 (22): 5492–501. doi:10.1046/j.1432-1033.2002.03250.x. PMID 12423347.
- ^ Goff SP, Berg P (1976). “Construction of hybrid viruses containing SV40 and lambda phage DNA segments and their propagation in cultured monkey cells”. Cell. 9 (4 PT 2): 695–705. doi:10.1016/0092-8674(76)90133-1. PMID 189942.
- ^ Houdebine LM (2007). “Transgenic animal models in biomedical research”. Methods Mol Biol. 360: 163–202. doi:10.1385/1-59745-165-7:163. ISBN 1-59745-165-7. PMID 17172731.
- ^ Daniell H, Dhingra A (2002). “Multigene engineering: dawn of an exciting new era in biotechnology”. Current Opinion in Biotechnology. 13 (2): 136–41. doi:10.1016/S0958-1669(02)00297-5. PMC 3481857. PMID 11950565.
- ^ Job D (2002). “Plant biotechnology in agriculture”. Biochimie. 84 (11): 1105–10. doi:10.1016/S0300-9084(02)00013-5. PMID 12595138.
- ^ Collins A, Morton NE (1994). “Likelihood ratios for DNA identification”. Proc Natl Acad Sci USA. 91 (13): 6007–11. Bibcode:1994PNAS...91.6007C. doi:10.1073/pnas.91.13.6007. PMC 44126. PMID 8016106.
- ^ Weir BS, Triggs CM, Starling L, Stowell LI, Walsh KA, Buckleton J (1997). “Interpreting DNA mixtures”. J Forensic Sci. 42 (2): 213–22. PMID 9068179.
- ^ Jeffreys AJ, Wilson V, Thein SL (1985). “Individual-specific 'fingerprints' of human DNA”. Nature. 316 (6023): 76–9. Bibcode:1985Natur.316...76J. doi:10.1038/316076a0. PMID 2989708.
- ^ Colin Pitchfork — first murder conviction on DNA evidence also clears the prime suspect Forensic Science Service Accessed 23 December 2006
- ^ “DNA Identification in Mass Fatality Incidents”. National Institute of Justice. tháng 9 năm 2006.
- ^ "Paternity Blood Tests That Work Early in a Pregnancy" New York Times June 20, 2012
- ^ a b Breaker, Ronald R.; Joyce, Gerald F. (12 tháng 1 năm 1994). “A DNA enzyme that cleaves RNA”. Chemistry & Biology. 1 (4): 223–229. doi:10.1016/1074-5521(94)90014-0. ISSN 1074-5521. PMID 9383394.
- ^ Chandra, Madhavaiah; Sachdeva, Amit; Silverman, Scott K. “DNA-catalyzed sequence-specific hydrolysis of DNA”. Nature Chemical Biology. 5 (10): 718–720. doi:10.1038/nchembio.201. PMC 2746877. PMID 19684594.
- ^ Carmi, Nir; Shultz, Lisa A.; Breaker, Ronald R. (12 tháng 1 năm 1996). “In vitro selection of self-cleaving DNAs”. Chemistry & Biology. 3 (12): 1039–1046. doi:10.1016/S1074-5521(96)90170-2. ISSN 1074-5521. PMID 9000012.
- ^ Torabi, Seyed-Fakhreddin; Wu, Peiwen; McGhee, Claire E.; Chen, Lu; Hwang, Kevin; Zheng, Nan; Cheng, Jianjun; Lu, Yi (12 tháng 5 năm 2015). “In vitro selection of a sodium-specific DNAzyme and its application in intracellular sensing”. Proceedings of the National Academy of Sciences. 112 (19): 5903–5908. doi:10.1073/pnas.1420361112. ISSN 0027-8424. PMC 4434688. PMID 25918425.
- ^ Baldi, Pierre; Brunak, Soren (2001). Bioinformatics: The Machine Learning Approach. MIT Press. ISBN 978-0-262-02506-5. OCLC 45951728.
- ^ Gusfield, Dan. Algorithms on Strings, Trees, and Sequences: Computer Science and Computational Biology. Cambridge University Press, 15 January 1997. ISBN 978-0-521-58519-4.
- ^ Sjölander K (2004). “Phylogenomic inference of protein molecular function: advances and challenges”. Bioinformatics. 20 (2): 170–9. doi:10.1093/bioinformatics/bth021. PMID 14734307.
- ^ Mount DM (2004). Bioinformatics: Sequence and Genome Analysis (ấn bản 2). Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press. ISBN 0-87969-712-1. OCLC 55106399.
- ^ Rothemund PW (2006). “Folding DNA to create nanoscale shapes and patterns”. Nature. 440 (7082): 297–302. Bibcode:2006Natur.440..297R. doi:10.1038/nature04586. PMID 16541064.
- ^ Andersen ES, Dong M, Nielsen MM, Jahn K, Subramani R, Mamdouh W, Golas MM, Sander B, Stark H, Oliveira CL, Pedersen JS, Birkedal V, Besenbacher F, Gothelf KV, Kjems J (2009). “Self-assembly of a nanoscale DNA box with a controllable lid”. Nature. 459 (7243): 73–6. Bibcode:2009Natur.459...73A. doi:10.1038/nature07971. PMID 19424153.
- ^ Ishitsuka Y, Ha T (2009). “DNA nanotechnology: a nanomachine goes live”. Nat Nanotechnol. 4 (5): 281–2. Bibcode:2009NatNa...4..281I. doi:10.1038/nnano.2009.101. PMID 19421208.
- ^ Aldaye FA, Palmer AL, Sleiman HF (2008). “Assembling materials with DNA as the guide”. Science. 321 (5897): 1795–9. Bibcode:2008Sci...321.1795A. doi:10.1126/science.1154533. PMID 18818351.
- ^ Wray GA (2002). “Dating branches on the Tree of Life using DNA”. Genome Biol. 3 (1): reviews0001.1–reviews0001.7. doi:10.1046/j.1525-142X.1999.99010.x. PMC 150454. PMID 11806830. Đã bỏ qua tham số không rõ
|nopp=(trợ giúp) - ^ Lost Tribes of Israel, Nova, PBS airdate: 22 February 2000. Transcript available from PBS.org. Retrieved 4 March 2006.
- ^ Kleiman, Yaakov. "The Cohanim/DNA Connection: The fascinating story of how DNA studies confirm an ancient biblical tradition". aish.com (13 January 2000). Retrieved 4 March 2006.
Tài liệu tham khảo
- ADN: The Secret of Life, by James D. Watson. ISBN 0-375-41546-7
- The Double Helix: A Personal Account of the Discovery of the Structure of ADN (Norton Critical Editions), by James D. Watson. ISBN 0-393-95075-1
- Calladine, Chris R.; Drew, Horace R.; Luisi, Ben F. and Travers, Andrew A. (2003). Understanding DNA: the molecule & how it works. Amsterdam: Elsevier Academic Press. ISBN 0-12-155089-3.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- Dennis, Carina; Julie Clayton (2003). 50 years of DNA. Basingstoke: Palgrave Macmillan. ISBN 1-4039-1479-6.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- Judson, Horace Freeland (1996). The eighth day of creation: makers of the revolution in biology. Plainview, N.Y: CSHL Press. ISBN 0-87969-478-5.
- Olby, Robert C. (1994). The path to the double helix: the discovery of DNA. New York: Dover Publications. ISBN 0-486-68117-3., first published in tháng 10 năm 1974 by MacMillan, with foreword by Francis Crick;the definitive DNA textbook,revised in 1994 with a 9 page postscript.
- Olby, Robert C. (2009). Francis Crick: A Biography. Plainview, N.Y: Cold Spring Harbor Laboratory Press. ISBN 0-87969-798-9.
- Ridley, Matt (2006). Francis Crick: discoverer of the genetic code. [Ashland, OH: Eminent Lives, Atlas Books. ISBN 0-06-082333-X.
- Berry, Andrew; Watson, James D. (2003). DNA: the secret of life. New York: Alfred A. Knopf. ISBN 0-375-41546-7.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- Stent, Gunther Siegmund; Watson, James D. (1980). The double helix: a personal account of the discovery of the structure of DNA. New York: Norton. ISBN 0-393-95075-1.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- Wilkins, Maurice (2003). The third man of the double helix the autobiography of Maurice Wilkins. Cambridge, Eng: University Press. ISBN 0-19-860665-6.
Liên kết ngoài
| Wikimedia Commons có thêm hình ảnh và phương tiện truyền tải về DNA. |
- DNA tại Từ điển bách khoa Việt Nam
- DNA tại Encyclopædia Britannica (tiếng Anh)
- DNA trên DMOZ
- DNA binding site prediction on protein
- DNA coiling to form chromosomes
- DNA from the Beginning Another DNA Learning Center site on DNA, genes, and heredity from Mendel to the human genome project.
- DNA Lab, demonstrates how to extract DNA from wheat using readily available equipment and supplies.
- DNA the Double Helix Game Website chính thức của Giải Nobel
- DNA under electron microscope
- Dolan DNA Learning Center
- Double Helix: 50 years of DNA, Nature
- Double Helix 1953–2003 National Centre for Biotechnology Education
- Francis Crick and James Watson talking on the BBC in 1962, 1972, and 1974
- Genetic Education Modules for Teachers—DNA from the Beginning Study Guide
- Guide to DNA cloning
- Olby R (2003). “Quiet debut for the double helix” (PDF). Nature. 421 (6921): 402–5. doi:10.1038/nature01397. PMID 12540907. Đã bỏ qua tham số không rõ
|month=(trợ giúp) - Rosalind Franklin's contributions to the study of DNA
- The Register of Francis Crick Personal Papers 1938 - 2007 tại Mandeville Special Collections Library, Geisel Library, Đại học California, San Diego
- U.S. National DNA Day—watch videos and participate in real-time chat with top scientists
- “Clue to chemistry of heredity found” (PDF). The New York Times. ngày 13 tháng 6 năm 1953. Tờ báo Mỹ đầu tiên đưa tin về việc phát hiện ra cấu trúc ADN.
- An Introduction to DNA and Chromosomes từ HOPES: Huntington's Disease Outreach Project for Education at Stanford




