Diboran(4)
Giao diện
| Diboran(4) | |
|---|---|
 | |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| ChEBI | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| Tham chiếu Gmelin | 24760 |
| Thuộc tính | |
| Công thức phân tử | B 2H 4 |
| Khối lượng mol | 25.65 g·mol–1 |
| Điểm nóng chảy | |
| Điểm sôi | |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Diboran là một hợp chất vô cơ của bor với hydro có công thức hóa học B2H4.
Điều chế
[sửa | sửa mã nguồn]Diboran(4) được điều chế bằng cách tách hai nguyên tử hydro từ diboran(6) có xúc tác fluor[1]:
- B2H6 (x.t F2)→ B2H4 + H2
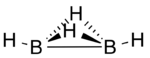
Cấu trúc
[sửa | sửa mã nguồn]Diboran(4) có cấu trúc phân tử trong đó có hai nguyên tử hydro làm cầu nối giữa hai nguyên tử bor thông qua liên kết ba điện tử ở tâm, ngoài liên kết hai điện tử ở tâm giữa hai nguyên tử bor và một liên kết nguyên tử hydro ở đầu cuối cho mỗi nguyên tử bor[2].
Dẫn xuất
[sửa | sửa mã nguồn]Hợp chất này có các dẫn xuất khác như:
[sửa | sửa mã nguồn]- Borane
- Diboran(6)
- Tetraboran
- Pentaboran(9)
- Pentaboran(11)
- Hexaboran(10)
- Hexaboran(12)
- Decaboran(14)
- Octadecaboran[3][4][5]
Xem thêm
[sửa | sửa mã nguồn]Hợp chất bor khác:
[sửa | sửa mã nguồn]Tham khảo
[sửa | sửa mã nguồn]- ^ Ruščic, B.; Schwarz, M.; Berkowitz, J. (1989). “Molecular structure and thermal stability of B
2H
4 and B
2H+
4 species”. The Journal of Chemical Physics. AIP Publishing. 91 (8): 4576–4581. doi:10.1063/1.456745. - ^ Alkorta, Ibon; Soteras, Ignacio; Elguero, José; Del Beneb, Janet E. (ngày 23 tháng 6 năm 2011). “The boron–boron single bond in diborane(4) as a non-classical electron donor for hydrogen bonding” (PDF). Physical Chemistry Chemical Physics. 13 (31): 14026–14032. doi:10.1039/C1CP20560A. Bản gốc (PDF) lưu trữ ngày 24 tháng 11 năm 2021. Truy cập ngày 10 tháng 9 năm 2021.
- ^ Xie, Xiaochen; Haddow, Mairi F.; Mansell, Stephen M.; Norman, Nicholas C.; Russell, Christopher A. (2012). “Diborane(4) compounds with bidentate diamino groups”. Dalton Transactions. 41 (7): 2140–7. doi:10.1039/C2DT11936F. PMID 22187045.
- ^ Wagner, Arne; Kaifer, Elisabeth; Himmel, Hans-Jörg (2012). “Diborane(4)–metal bonding: Between hydrogen bridges and frustrated oxidative addition”. Chemical Communications. 48 (43): 5277–9. doi:10.1039/C2CC31671D. PMID 22526934.
- ^ Horn, Julian; Widera, Anna; Litters, Sebastian; Kaifer, Elisabeth; Himmel, Hans-Jörg (2018). “The proton affinity, HOMO energy and ionization energy of electron-rich sp3–sp3-hybridized diborane(4) compounds with bridging guanidinate substituents can be varied by substitution”. Dalton Trans. 47 (6): 2009–2017. doi:10.1039/C7DT04433J.
