Sắt(II) sulfat
| Sắt(II) sunfat | |
|---|---|
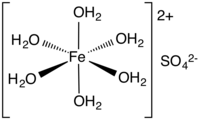 Cấu trúc khung phân tử của sắt(II) sunfat ngậm 6 nước | |
 Cấu trúc 3D phân tử của sắt(II) sunfat khan | |
| Danh pháp IUPAC | Sắt(II) sulfate |
| Tên khác | Ferơ sunfat, vitriol xanh lục, vitriol sắt, Copperas, Melanterit, Szomolnokit |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| ChEBI | |
| ChEMBL | |
| Số RTECS | NO8500000 (khan) NO8510000 (7 nước) |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| ChemSpider | |
| UNII | |
| Thuộc tính | |
| Công thức phân tử | FeSO4 |
| Khối lượng mol | 151,9106 g/mol (khan) 169,92588 g/mol (1 nước) 223,97172 g/mol (4 nước) 241,987 g/mol (5 nước) 260,00228 g/mol (6 nước) 278,01756 g/mol (7 nước) |
| Bề ngoài | tinh thể không màu (khan) tinh thể vàng nhạt (1 nước) tinh thể lục lam sáng (7 nước) |
| Mùi | không mùi |
| Khối lượng riêng | 3,65 g/cm³ (khan) 3 g/cm³ (1 nước) 2,15 g/cm³ (5 nước)[1] 1,934 g/cm³ (6 nước)[2] 1,895 g/cm³ (7 nước)[3] |
| Điểm nóng chảy | 680 °C (953 K; 1.256 °F) (khan, phân hủy)[4] 300 °C (572 °F; 573 K) (1 nước, phân hủy) 60–64 °C (140–147 °F; 333–337 K) (7 nước, phân hủy)[3][5] |
| Điểm sôi | |
| Độ hòa tan trong nước | 1 nước: 44,69 g/100mL (77 ℃) 35,97 g/100mL (90,1 ℃) 7 nước: 15,65 g/100mL (0 ℃) 20,5 g/100mL (10 ℃) 29,51 g/100mL (25 ℃) 39,89 g/100mL (40,1 ℃) 51,35g/100mL (54 ℃)[6] |
| Độ hòa tan | tan ít trong cồn tạo phức với nhiều phối tử vô cơ và hữu cơ |
| Độ hòa tan trong etylen glycol | 6,4 g/100 g (20 ℃)[4] |
| Áp suất hơi | 1,95 kPa (7 nước)[7] |
| MagSus | 1,24×10−2 cm³/mol (khan) 1,05×10−2 cm³/mol (1 nước) 1,12×10−2 cm³/mol (7 nước)[3] +10200×10−6 cm³/mol |
| Chiết suất (nD) | 1,591 (1 nước)[8] 1,526–1,528 (21 ℃, 4 nước)[9] 1,513–1,515 (5 nước)[1] 1,468 (6 nước)[2] 1,471 (7 nước)[10] |
| Cấu trúc | |
| Cấu trúc tinh thể | Trực thoi, oP24 (khan)[11] Đơn nghiêng, mS36 (1 nước)[8] Đơn nghiêng, mP72 (4 nước)[9] Ba nghiêng, aP42 (5 nước)[1] Đơn nghiêng, mS192 (6 nước)[2] Đơn nghiêng, mP108 (7 nước)[3][10] |
| Nhóm không gian | Pnma, No. 62 (khan) [11] C2/c, No. 15 (1 và 6 nước)[2][8] P21/n, No. 14 (4 nước)[9] P1, No. 2 (5 nước)[1] P21/c, No. 14 (7 nước)[10] |
| Hằng số mạng | a = 8,704(2) Å, b = 6,801(3) Å, c = 4,786(8) Å (293 K, khan)[11] |
| Tọa độ | Bát diện (Fe2+) |
| Nhiệt hóa học | |
| Enthalpy hình thành ΔfH | -928,4 kJ/mol (khan)[3] -3016 kJ/mol (7 nước)[12] |
| Entropy mol tiêu chuẩn S | 107,5 J/mol·K (khan)[3] 409,1 J/mol·K (7 nước)[12] |
| Nhiệt dung | 100,6 J/mol·K (khan)[3] 394,5 J/mol·K (7 nước)[12] |
| Dược lý học | |
| Các nguy hiểm | |
| NFPA 704 |
|
| LD50 | 237 mg/kg (đường miệng, chuột)[5] |
| REL | TWA 1 mg/m³[13] |
| Ký hiệu GHS |  [7] [7] |
| Báo hiệu GHS | Cảnh báo |
| Chỉ dẫn nguy hiểm GHS | H302, H315, H319[7] |
| Chỉ dẫn phòng ngừa GHS | P305+P351+P338[7] |
| Các hợp chất liên quan | |
| Anion khác | Sắt(II) selenat Sắt(II) telurat |
| Cation khác | Coban(II) sunfat Đồng(II) sunfat Mangan(II) sunfat Niken(II) sunfat |
| Hợp chất liên quan | Sắt(III) sunfat |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Sắt(II) sunfat là tên chung của một nhóm muối với công thức hóa học FeSO4·xH2O. Dạng muối phổ biến nhất là dạng ngậm 7 phân tử nước (x = 7) nhưng ngoài ra cũng có nhiều giá trị x khác nhau. Muối ngậm nước này được sử dụng trong y tế để điều trị chứng thiếu sắt, và cũng cho các ứng dụng công nghiệp. Được biết đến từ thời cổ đại với cái tên coppera và vitriol xanh lá cây, muối ngậm 7 phân tử nước với màu lục lam nhạt là dạng phổ biến nhất của hợp chất này. Tất cả sắt(II) sunfat hòa tan trong nước để tạo ra cùng một aquo phức [Fe(H2O)6]2+, có mô hình hình học phân tử bát diện và thuận từ. Tên copperas có từ thời đồng(II) sunfat được gọi là coppera xanh, và có lẽ tương tự, sắt(II) và kẽm sunfat được biết đến tương ứng là coppera màu xanh lá cây và coppera trắng.[14]
Hợp chất này có trong Danh sách các thuốc thiết yếu của WHO, các loại thuốc quan trọng nhất cần thiết cho một hệ thống y tế cơ bản.[15]
Điều chế[sửa | sửa mã nguồn]
FeSO4 có thể được điều chế theo nhiều cách khác nhau. Một trong những cách đó là cho sắt(II) oxit hoặc sắt(II) hydroxide tác dụng với axit sunfuric loãng.
- FeO + H2SO4 → FeSO4 + H2O
Ngoài ra, cho Fe tác dụng với CuSO4 cũng là một cách để điều chế FeSO4.
- Fe + CuSO4 → FeSO4 + Cu↓

Hợp chất khác[sửa | sửa mã nguồn]
FeSO4 còn tạo một số hợp chất với NH3, như:
- FeSO4·2NH3·H2O – bột màu nâu đen;[16]
- FeSO4·4NH3 – chất rắn màu đỏ nâu;[17]
- FeSO4·5NH3·H2O – tinh thể màu đỏ nâu;[18]
- FeSO4·6NH3 – bột trắng.[19]
FeSO4 còn tạo ra một số hợp chất với N2H4, như FeSO4·2N2H4·H2O là tinh thể lục phương màu lục nhạt, có tính nổ.[20]
FeSO4 còn tạo một số hợp chất với CON3H5, như FeSO4·2CON3H5 là tinh thể màu trắng, tan vừa trong nước. Trong dung dịch nó dễ bị oxy hóa, tạo ra sắt(III) hydroxide.[21]
FeSO4 còn tạo một số hợp chất với CS(NH2)2, như FeSO4·2CS(NH2)2 là tinh thể không màu.[22]
FeSO4 còn tạo một số hợp chất với CSN3H5, như FeSO4·2CSN3H5 là tinh thể màu lục, tan trong nước.[23]
Tham khảo[sửa | sửa mã nguồn]
- ^ a b c d “Siderotil Mineral Data”. Truy cập ngày 3 tháng 8 năm 2014.
- ^ a b c d “Ferrohexahydrite Mineral Data”. Truy cập ngày 3 tháng 8 năm 2014.
- ^ a b c d e f g Lide, David R. biên tập (2009). CRC Handbook of Chemistry and Physics . Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ a b Anatolievich, Kiper Ruslan. “iron(II) sulfate”. Truy cập ngày 3 tháng 8 năm 2014.
- ^ a b “MSDS of Ferrous sulfate heptahydrate”. Fair Lawn, New Jersey: Fisher Scientific, Inc. Truy cập ngày 3 tháng 8 năm 2014.
- ^ Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (ấn bản 2). New York: D. Van Nostrand Company. tr. 343.
- ^ a b c d Bản dữ liệu Sắt(II) sulfat của Sigma-Aldrich, truy cập lúc {{{Datum}}} (PDF).
- ^ a b c Ralph, Jolyon; Chautitle, Ida. “Szomolnokite”. Mindat.org. Truy cập ngày 3 tháng 8 năm 2014.
- ^ a b c “Rozenite Mineral Data”. Truy cập ngày 3 tháng 8 năm 2014.
- ^ a b c “Melanterite Mineral Data”. Truy cập ngày 3 tháng 8 năm 2014.
- ^ a b c Weil, Matthias (2007). “The High-temperature β Modification of Iron(II) Sulfate”. Acta Crystallographica Section E. International Union of Crystallography. 63 (12): i192. doi:10.1107/S160053680705475X. Truy cập ngày 3 tháng 8 năm 2014.
- ^ a b c Anatolievich, Kiper Ruslan. “iron(II) sulfate heptahydrate”. Truy cập ngày 3 tháng 8 năm 2014.
- ^ “NIOSH Pocket Guide to Chemical Hazards #0346”. Viện An toàn và Sức khỏe Nghề nghiệp Quốc gia Hoa Kỳ (NIOSH).
- ^ Brown, Lesley (1993). The New shorter Oxford English dictionary on historical principles. Oxford [Eng.]: Clarendon. ISBN 0-19-861271-0.
- ^ “WHO Model List of Essential Medicines (19th List)” (PDF). World Health Organization. tháng 4 năm 2015. Truy cập ngày 8 tháng 12 năm 2016.
- ^ Handbuch der Anorganischen Chemie (Abegg, R. (Richard), 1869-1910; Auerbach, Felix, 1856-1933), trang B 95 – [1]. Truy cập 14 tháng 5 năm 2020.
- ^ Contributions from the Physical Laboratories of Harvard University for the Years..., Tập 16 (1922), trang 7. Truy cập 3 tháng 9 năm 2020.
- ^ A Text-book Of Inorganic Chemistry Vol-x, trang 127 – [2]. Truy cập 7 tháng 3 năm 2020.
- ^ A Comprehensive Treatise on Inorganic and Theoretical Chemistry: Fe (part 3) (Joseph William Mellor; Longmans, Green and Company, 1947), trang 273 – [3]. Truy cập 25 tháng 4 năm 2020.
- ^ Russian Journal of Inorganic Chemistry, Tập 19,Phần 2 (British Library Lending Division with the cooperation of the Royal Society of Chemistry, 1974), trang 1582 – [4]. Truy cập 2 tháng 2 năm 2021.
- ^ Smith – "Co-ordination compounds of semicarbazide, phenylsemicarbazide, m-tolylsemicarbazide, and aminoguanidine" trong Journal of the Chemical Society, Phần 2 (Chemical Society (Great Britain); The Society, 1937), trang 1356. Truy cập 12 tháng 3 năm 2021.
- ^ Investigation on the growth and characterization of nonlinear optical single crystal of bis thiourea iron(II) sulphate. Truy cập 14 tháng 5 năm 2020.
- ^ Glenn A.Eisman, William MichaelReiff – A magnetic susceptibility and Mössbauer spectroscopy study of bis(thiosemicarbazide)iron(II) sulfate. A case of zero field splitting. Inorganica Chimica Acta (50), 1981, tr. 239–242. doi:10.1016/S0020-1693(00)83750-0.
Liên kết ngoài[sửa | sửa mã nguồn]
| Wikimedia Commons có thêm hình ảnh và phương tiện truyền tải về Sắt(II) sulfat. |
- “Product Information”. Chemical Land21. ngày 10 tháng 1 năm 2007.
- How to Make Copperas (Iron Sulfate) from Pyrites
 . The American Cyclopædia. 1879.
. The American Cyclopædia. 1879.

