Chromi(VI) oxide
| Chromi(VI) oxide | |
|---|---|
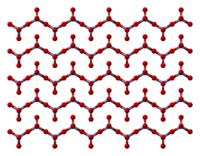 Cấu trúc của Chromi(VI) Oxide | |
 Mẫu Chromi(VI) Oxide khan | |
| Danh pháp IUPAC | Chromi trioxide |
| Tên khác | Chromiic anhydride |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| ChEBI | |
| Số RTECS | GB6650000 |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| ChemSpider | |
| UNII | |
| Thuộc tính | |
| Công thức phân tử | CrO3 |
| Khối lượng mol | 99,9962 g/mol |
| Bề ngoài | chất rắn đỏ đậm dễ chảy |
| Mùi | Không mùi |
| Khối lượng riêng | 2,7 g/cm³ (20 ℃)[1] |
| Điểm nóng chảy | 197 °C (470 K; 387 °F) [1] |
| Điểm sôi | 250 °C (523 K; 482 °F) (phân hủy)[1] |
| Độ hòa tan trong nước | 164,8 g/100 mL (0 ℃) 169 g/100 mL (25 ℃)[1] 172,6 g/100 mL (40 ℃) 198,1 g/100 mL (100 ℃)[2] |
| Độ hòa tan | Hòa tan trong H2SO4, HNO3, (C2H5)2O, CH3COOH, aceton |
| MagSus | +40·10-6 cm³/mol[1] |
| Nhiệt hóa học | |
| Enthalpy hình thành ΔfH | -589,3 kJ/mol[3] |
| Entropy mol tiêu chuẩn S | 73,2 J/mol·K[4] |
| Các nguy hiểm | |
| Phân loại của EU | Carc. Cat. 1 Muta. Cat. 2 Repr. Cat. 3 |
| NFPA 704 |
|
| Chỉ dẫn R | R45, R46, R9, R24/25, R26, R35, R42/43, R48/23, R50/53, R62 |
| Chỉ dẫn S | S53, S45, S60, S61 |
| LD50 | 80 mg/kg (rats, oral)[5] |
| Ký hiệu GHS |      [6] [6] |
| Báo hiệu GHS | Nguy hiểm |
| Chỉ dẫn nguy hiểm GHS | H271, H301, H311, H314, H317, H330, H334, H340, H350, H361, H372, H410[6] |
| Chỉ dẫn phòng ngừa GHS | P201, P220, P260, P273, P280, P284[6] |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Chromi(VI) Oxide, hay Chromi trioxide (tiếng Anh: Chromium trioxide) là một hợp chất vô cơ với công thức CrO3. Nó là Oxide axit của axit Chromiic, và đôi khi được bán trên thị trường dưới cùng một tên.[5] Hợp chất này có dạng đỏ hơi tím rắn dưới điều kiện khan, màu cam sáng khi ướt, đều tan trong nước và bị thủy phân. Hàng ngàn tấn Chromi(VI) Oxide được sản xuất hàng năm, chủ yếu cho mạ điện. Chromi(VI) Oxide là một chất oxy hóa mạnh và bị nghi ngờ là chất gây ung thư.
Sản xuất, cấu trúc và những phản ứng cơ bản
[sửa | sửa mã nguồn]Chromi(VI) Oxide được tạo ra bằng cách cho natri Chromiat hay natri điChromiat với axit sunfuric:
Khoảng 100.000 tấn Chromi(VI) Oxide được sản xuất hàng năm bằng cách này hoặc theo con tương tự.
Ở dạng rắn, nó bao gồm chuỗi tetrahedrally phối hợp Chromi nguyên tử chia sẻ đỉnh. Mỗi nguyên tử Chromi trung tâm chia sẻ hai nguyên tử oxy trung tâm với nguyên tử Chromi kề nó. Hai nguyên tử oxy không được chia sẻ thì cho một lượng pháp tổng thể 1:3.[7]
Cấu trúc của monome Chromi đã được tính toán bằng cách sử dụng mật độ chức năng thuyết, và là dự đoán là có dạng kim tự tháp (nhóm điểm C3) chứ không phải là phẳng (nhóm điểm D3h).
Chromi(VI) Oxide bị phân hủy khoảng 250 ℃ giải phóng oxy cuối cùng cho ra Cr2O3:
- 4CrO3 → 2Cr2O3 + 3O2↑
Nó được sử dụng trong tổng hợp hữu cơ như một hợp chất oxy hóa, thường giống như một dung dịch axit acetic, hay axeton trong phản ứng oxy hóa Jones. Trong những chất oxy hóa, Cr(VI) chuyển alcohol bậc 1 thành axit cacboxylic và alcohol bậc 2 thanh keton. Các phản ứng được đưa ra dưới đây:
Alcohol bậc 1
- 4CrO3 + 3RCH2OH + 12H+ → 3RCOOH + 4Cr3+ + 9H2O
Alcohol bậc 2
- 2CrO3 + 3R2CHOH + 6H+ → 3R2C=O + 2Cr3+ + 6H2O
Ứng dụng
[sửa | sửa mã nguồn]Chromi(VI) Oxide được sử dụng trong mạ Chromi. Nó là thường được sử dụng với các chất phụ gia có ảnh hưởng đến quy trình mạ nhưng không phản ứng với các triOxide. Các triOxide phản ứng với cadmi, kẽm, và kim loại khác để thụ động hóa Chromi giúp chống lại sự ăn mòn. Nó cũng được sử dụng trong sản xuất hồng ngọc tổng hợp. Axit Chromiic là dung dịch cũng được sử dụng trong việc áp dụng phủ sơn anot lên nhôm, được ứng dụng trong hàng không vũ trụ. Axit Chromiic hoặc axit photphoric cũng là giải pháp ưu tiên cho việc phủ sơn anot các loại.
An toàn
[sửa | sửa mã nguồn]Chromi(VI) Oxide rất độc, gây ăn mòn và là tác nhân gây ung thư.[8] Nó là ví dụ chính của Chromi hóa trị VI, là một mối nguy cho môi trường. Các dẫn xuất liên quan của Chromi(III) thì không đặc biệt nguy hiểm như vậy nên được tận dụng để hủy các mẫu Chromi(VI).
Chromi(VI) Oxide là một chất oxy hóa mạnh, nó sẽ đốt cháy các vật liệu hữu cơ như rượu khi tiếp xúc.
Hình ảnh
[sửa | sửa mã nguồn]-
Dung dịch kali dichromiat đậm đặc.
-
Cho axit sunfuric vào để tạo phản ứng.
-
Kết tinh của Chromi(VI) Oxide từ phản ứng.
-
Phản ứng giữa Chromi(VI) Oxide và ethanol
Tham khảo
[sửa | sửa mã nguồn]- ^ a b c d e Lide, David R. biên tập (2009). CRC Handbook of Chemistry and Physics . Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ Seidell, Atherton; Linke, William F. (1919). Solubilities of Inorganic and Organic Compounds (ấn bản 2). D. Van Nostrand Company. tr. 250.
- ^ Pradyot, Patnaik (2003). Handbook of Inorganic Chemicals. The McGraw-Hill Companies, Inc. ISBN 0-07-049439-8.
- ^ chromium(VI) oxide
- ^ a b “Chromium trioxide”. http://www.chemicalland21.com. AroKor Holdings Inc. Truy cập ngày 15 tháng 6 năm 2014. Liên kết ngoài trong
|website=(trợ giúp) - ^ a b c Bản dữ liệu Chromi(VI) oxide của Sigma-Aldrich, truy cập lúc {{{Datum}}} (PDF).
- ^ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (ấn bản 6), New York: Wiley-Interscience, ISBN 0-471-19957-5
- ^ “Chromium Trioxide (MSDS)”. J. T. Baker. Truy cập ngày 13 tháng 9 năm 2007.









