Vanadi(IV) fluoride
| Vanadi(IV) fluoride | |||
|---|---|---|---|
| |||
| Danh pháp IUPAC | vanadium tetrafluoride | ||
| Nhận dạng | |||
| Số CAS | |||
| PubChem | |||
| Số EINECS | |||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| InChI | đầy đủ
| ||
| UNII | |||
| Thuộc tính | |||
| Công thức phân tử | VF4 | ||
| Khối lượng mol | 126,9346 g/mol | ||
| Bề ngoài | bột màu xanh lá cây hút ẩm[1] | ||
| Mùi | không mùi | ||
| Khối lượng riêng | 3,15 g/cm³ (20 °C)[1] 2,975 g/cm³ (23 °C)[2] | ||
| Điểm nóng chảy | 325 °C (598 K; 617 °F) (phân hủy ở 760 mmHg)[1] | ||
| Điểm sôi | thăng hoa[1] | ||
| Độ hòa tan trong nước | tan[1] | ||
| Độ hòa tan | tan trong aceton, acid acetic tan rất ít trong SO2Cl2, alcohols, CHCl3[2] tạo phức với amonia | ||
| Cấu trúc | |||
| Cấu trúc tinh thể | Đơn nghiêng, mP10 | ||
| Nhóm không gian | P21/c, No. 14 | ||
| Nhiệt hóa học | |||
| Enthalpy hình thành ΔfH | −1412 kJ/mol[3] | ||
| Entropy mol tiêu chuẩn S | 126 J/mol·K[3] | ||
| Các nguy hiểm | |||
| Mắt | gây bỏng | ||
| Da | gây bỏng da | ||
| Ký hiệu GHS |   | ||
| Báo hiệu GHS | Danger | ||
| Chỉ dẫn nguy hiểm GHS | H300, H314, H330 | ||
| Chỉ dẫn phòng ngừa GHS | P260, P301+P310, P303+P361+P353, P304+P340, P305+P351+P338, P320, P330, P405, P501 | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Vanadi(IV) fluoride (công thức hóa học: VF4) là một hợp chất vô cơ của vanadi và fluor. Nó là chất rắn màu vàng nâu thuận từ rất hút ẩm. Không giống như vanadi(IV) chloride tương ứng, tetrafluoride không dễ bay hơi vì nó có cấu trúc polymer. Nó bị phân hủy trước khi nóng chảy.
Điều chế và phản ứng[sửa | sửa mã nguồn]
VF4 có thể được điều chế bằng cách xử lý VCl4 với HF:
- VCl4 + 4 HF → VF4 + 4 HCl
Trong lần đầu tiên được khám phá, hợp chất được điều chế theo cách này.[4] Nó bị phân hủy ở 325 °C, tạo thành tri- và pentafluoride:
- 2 VF4 → VF3 + VF5
Phản ứng của M2VF5 với khí fluor sẽ tạo ra M2VF6 (M = K, Rb, Cs), có màu hồng đến vàng, ổn định trong không khí.[5]
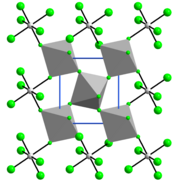
Cấu trúc[sửa | sửa mã nguồn]
Cấu trúc của VF4 giống SnF4. Mỗi trung tâm vanadi có dạng bát diện, được bao quanh bởi sáu phối tử fluoride. Bốn trong số các trung tâm fluoride làm cầu nối với các trung tâm vanadi liền kề.[6]
Hợp chất khác[sửa | sửa mã nguồn]
VF4·NH3 được tạo thành khi cho VF5 tác dụng với khí amonia. Nó có màu nâu, phân hủy ở 250 °C (482 °F; 523 K). Phức VF4·py có màu xám hồng, phân hủy ở 150 °C (302 °F; 423 K). VF4·3en cũng được biết đến.[5]
Tham khảo[sửa | sửa mã nguồn]
- ^ a b c d e Lide, David R. biên tập (2009). CRC Handbook of Chemistry and Physics . Boca Raton, Florida: CRC Press. ISBN 978-1-4200-9084-0.
- ^ a b Kwasnik, W. (1963). Brauer, Georg (biên tập). Handbook of Preparative Inorganic Chemistry . London: Academic Press. tr. 252–253.
- ^ a b Anatolievich, Kiper Ruslan. “vanadium(IV) fluoride”. chemister.ru. Truy cập ngày 25 tháng 6 năm 2014.
- ^ Otto Ruff, Herbert Lickfett "Vanadinfluoride" Chemische Berichte 1911, vol. 44, pages 2539–2549. doi:10.1002/cber.19110440379
- ^ a b Clark, R. J. H.; Brown, D. (8 tháng 10 năm 2013). The Chemistry of Vanadium, Niobium and Tantalum: Pergamon Texts in Inorganic Chemistry (bằng tiếng Anh). Elsevier. tr. 548. ISBN 978-1-4831-8170-7.
- ^ Becker S., Muller B. G. Vanadium Tetrafluoride, Angew.
Đọc thêm[sửa | sửa mã nguồn]
- Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (ấn bản 6), New York: Wiley-Interscience, ISBN 0-471-19957-5