Acid chloric
| Acid chloric | |
|---|---|
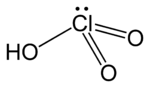 Acid chloric acid | |
 Chloric acid | |
| Tên khác | Chloric(V) acid |
| Nhận dạng | |
| Số CAS | |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| Thuộc tính | |
| Công thức phân tử | HClO3 |
| Khối lượng mol | 84.45914 g mol−1 |
| Bề ngoài | Dung dịch không màu |
| Khối lượng riêng | 1 g/mL, solution (approxymate) |
| Điểm nóng chảy | |
| Điểm sôi | |
| Độ hòa tan trong nước | >40 g/100 ml (20 °C) |
| Độ axit (pKa) | ca. −1 |
| Cấu trúc | |
| Hình dạng phân tử | pyramidal |
| Các nguy hiểm | |
| Nguy hiểm chính | Oxidant, Corrosive |
| Các hợp chất liên quan | |
| Anion khác | acid hydrobromic acid hydroiodic |
| Cation khác | Amoni chlorat Natri chlorat Kali chlorat |
| Hợp chất liên quan | Acid hydrochloric Acid hypochlorơ Acid chlorơ Acid pechloric |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Acid chloric có công thức là HClO3, là một acid có oxy của chlor. Là acid là một trong những acid mạnh (pKa ≈ −2.7), chỉ tồn tại ở dạng dung dịch. Acid chloric có tính oxy hóa mạnh; tác dụng với lưu huỳnh, phosphor, arsenic, khí lưu huỳnh dioxide. Giấy, bông bốc cháy ngay khi tiếp xúc với dung dịch HClO3 40%. Trong nước, nó mạnh tương đương với acid hydrochloric. Muối quan trọng nhất của nó là kali chlorat (KClO3). Acid chloric rất độc.
Tính chất[sửa | sửa mã nguồn]
Axit cloric không ổn định về mặt nhiệt động theo hướng không cân đối.
Axit cloric ổn định trong dung dịch nước lạnh có nồng độ lên tới khoảng 30% và có thể điều chế các dung dịch có nồng độ lên tới 40% bằng cách làm bay hơi cẩn thận dưới áp suất giảm. Trên nồng độ này, dung dịch axit cloric bị phân hủy tạo ra nhiều loại sản phẩm, ví dụ:
8 HClO3 → 4 HClO4 + 2 H2O + 2 Cl2 + 3 O2
3 HClO3 → HClO4 + H2O + 2 ClO2
Tính chất hoá học[sửa | sửa mã nguồn]
Acid chloric có thể phản ứng với nhiều kim loại trước dãy điện hoá của hydro:
- 2HClO3 + 2K → 2KClO3 + H2
- 2HClO3 + Ca → Ca(ClO3)2 + H2
- 6HClO3 + 2Al → 2Al(ClO3)3 + 3H2
Điều chế[sửa | sửa mã nguồn]
Acid chloric có thể được điều chế bằng phản ứng giữa bari chlorat và acid sunfuric:
- Ba(ClO3)2 + H2SO4 → 2HClO3 + BaSO4↓
Một phương pháp khác là đun nóng axit hypoclorơ, tạo ra axit cloric và hydro clorua:
3 HClO → HClO3 + 2 HCl
Nguy hiểm[sửa | sửa mã nguồn]
Axit cloric là một tác nhân oxy hóa mạnh mẽ. Hầu hết các chất hữu cơ và chất dễ cháy sẽ bốc cháy khi tiếp xúc.
Tham khảo[sửa | sửa mã nguồn]
- Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (ấn bản 2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- R. Bruce King biên tập (1994). “Chloric acid”. encyclopedia of Inorganic Chemistry. 2. Chichester: Wiley. tr. 658. ISBN 0-471-93620-0.
