Urani(VI) fluoride
| Urani(VI) fluoride | |
|---|---|
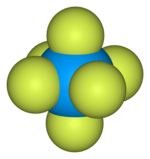 Cấu trúc của urani(VI) fluoride | |
| Tên khác | Urani hexafluoride Uranic fluoride |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Thuộc tính | |
| Công thức phân tử | UF6 |
| Khối lượng mol | 352,0184 g/mol |
| Bề ngoài | tinh thể trắng hoặc không màu |
| Điểm nóng chảy | 64,052 °C (337,202 K; 147,294 °F) |
| Điểm sôi | 56,5 °C (329,6 K; 133,7 °F) (thăng hoa) |
| Độ hòa tan trong nước | phản ứng |
| Độ hòa tan | tan trong CCl4, Cl2 lỏng, Br2, nitrobenzen |
| Các nguy hiểm | |
| Nguy hiểm chính | rất độc, phóng xạ |
| NFPA 704 |
|
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Urani(VI) fluoride (UF6), được gọi là "hex" trong ngành công nghiệp hạt nhân, là một hợp chất được sử dụng trong quá trình làm giàu urani tạo ra nhiên liệu cho lò phản ứng hạt nhân và vũ khí hạt nhân. Nó tạo ra các tinh thể màu xám rắn ở nhiệt độ và áp suất tiêu chuẩn, rất độc, phản ứng với nước và ăn mòn với hầu hết các kim loại. Nó phản ứng nhẹ với nhôm, tạo thành một lớp bề mặt mỏng AlF3 chống lại phản ứng tiếp theo.
Điều chế[sửa | sửa mã nguồn]
Trong quá trình tái xử lý hạt nhân, urani phản ứng với clo trifluoride để cho UF6:
- U + 2ClF3 → UF6 + Cl2↑
Tính chất[sửa | sửa mã nguồn]
Tính chất vật lý[sửa | sửa mã nguồn]
Ở áp suất khí quyển, UF6 thăng hoa ở khoảng 56,5 ℃.[1]

Cấu trúc trạng thái rắn được xác định bởi nhiễu xạ neutron ở 77 K và 293 K.
Tính chất hóa học[sửa | sửa mã nguồn]
Urani(VI) fluoride là một chất oxy hóa và một axit Lewis có thể liên kết với flo; ví dụ, phản ứng của đồng(II) fluoride với urani(VI) fluoride trong acetonitril tạo thành đồng(II) heptaflorouranat(VI) (Cu(UF7)2). [2]
Urani(VI) fluoride có chứa cation hữu cơ đã được cô lập và đặc trưng bởi nhiễu xạ tia X.[3]
Ứng dụng trong chu trình tạo nhiên liệu hạt nhân[sửa | sửa mã nguồn]
Ngoài việc sử dụng nó trong quá trình làm giàu, urani(VI) fluoride đã được sử dụng trong phương pháp tái xử lý tiên tiến (fluoride volatility) được phát triển ở Cộng hòa Séc. Trong quá trình này, sử dụng nhiên liệu hạt nhân oxit được xử lý bằng khí flo để tạo thành một hỗn hợp chất fluoride. Hỗn hợp này sau đó được chưng cất để tách các lớp vật liệu khác nhau.
Tham khảo[sửa | sửa mã nguồn]
- ^ . doi:10.1063/1.1746914. Chú thích journal cần
|journal=(trợ giúp);|title=trống hay bị thiếu (trợ giúp) - ^ . doi:10.1039/DT9760000272. Chú thích journal cần
|journal=(trợ giúp);|title=trống hay bị thiếu (trợ giúp) - ^ . doi:10.1021/ja992145f. Chú thích journal cần
|journal=(trợ giúp);|title=trống hay bị thiếu (trợ giúp)
Liên kết ngoài[sửa | sửa mã nguồn]
- Simon Cotton (Uppingham School, Rutland, UK): Uranium Hexafluoride.
- Uranium Hexafluoride (UF6) – Physical and chemical properties of UF6, and its use in uranium processing – Uranium Hexafluoride and Its Properties Lưu trữ 2012-01-27 tại Wayback Machine
- Import of Western depleted uranium hexafluoride (uranium tails) to Russia [dead link ngày 30 tháng 6 năm 2017]
- Uranium Hexafluoride in www.webelements.com

