Fluor
| Fluor, 9F | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 Fluor lỏng (F2 ở nhiệt độ cực thấp) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Quang phổ vạch của fluor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất chung | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tên, ký hiệu | Fluor, F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phiên âm | /ˈflʊəriːn/ /ˈflɔːriːn/ (FLOR-een) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hình dạng | Thể khí: màu vàng rất nhạt Thể lỏng: màu vàng sáng Thể rắn: alpha màu đục, beta màu trong suốt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fluor trong bảng tuần hoàn | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số nguyên tử (Z) | 9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Khối lượng nguyên tử chuẩn (Ar) | 18,998 403 162(5)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phân loại | halogen | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhóm, phân lớp | 17, p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chu kỳ | Chu kỳ 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cấu hình electron | [He] 2s2 2p5[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
mỗi lớp | 2, 7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất vật lý | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Màu sắc | Vàng nhạt | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái vật chất | Chất khí | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt độ nóng chảy | 53,48 K (−219,67 °C, −363,41 °F)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt độ sôi | 85,03 K (−188,11 °C, −306,60 °F)[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mật độ | 1,696 g/L[4] (ở 0 °C, 101.325 kPa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mật độ ở thể lỏng | ở nhiệt độ sôi: 1,505 g·cm−3[5] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Điểm ba | 53,48 K, 90 kPa[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Điểm tới hạn | 144,41 K, 5,1724 MPa[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt bay hơi | 6,51 kJ·mol−1[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt dung | Cp: 31 J·mol−1·K−1[5] (ở 21,1 °C) Cv: 23 J·mol−1·K−1[5] (ở 21,1 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Áp suất hơi
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất nguyên tử | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái oxy hóa | -1 Acid mạnh | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ âm điện | 3,98 (Thang Pauling)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Năng lượng ion hóa | Thứ nhất: 1.681[6] kJ·mol−1 Thứ hai: 3.374[6] kJ·mol−1 Thứ ba: 6.147[6] kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính liên kết cộng hóa trị | 64 pm[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính van der Waals | 135 pm[8] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thông tin khác | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cấu trúc tinh thể | Lập phương | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ dẫn nhiệt | 0,02591 W·m−1·K−1[9] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất từ | Nghịch từ (−1,2×10−4)[10][11] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số đăng ký CAS | 7782-41-4[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Lịch sử | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Đặt tên | Theo tên của fluorit, một khoáng vật có tên được đặt theo từ Latinh fluo (dòng chảy, trong nấu luyện) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phát hiện | André-Marie Ampère (1810) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tách ra lần đầu | Henri Moissan[2] (26 tháng 6 năm 1886) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Đặt tên chính bởi | Humphry Davy André-Marie Ampère | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Đồng vị ổn định nhất | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bài chính: Đồng vị của Fluor | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nguồn:[12] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Fluor (danh pháp cũ: flo) là một nguyên tố hóa học có ký hiệu là F và số hiệu nguyên tử là 9. Đây là halogen nhẹ nhất và tồn tại dưới dạng chất khí rất độc, màu vàng nhạt ở điều kiện tiêu chuẩn. Do có độ âm điện cao nhất, fluor hoạt động hóa học rất mạnh: phản ứng với hầu hết nguyên tố khác, bao gồm một số khí hiếm, để tạo thành hợp chất với fluor.
Trong các nguyên tố, fluor là nguyên tố phổ biến thứ 24 trong vũ trụ và thứ 13 trong lớp vỏ Trái Đất. Fluorit, nguồn khoáng vật cơ bản của fluor với tên gọi được lấy làm tên nguyên tố, được mô tả lần đầu tiên vào năm 1529; vì nó được cho thêm vào quặng kim loại để làm hạ điểm nóng chảy trong nấu luyện nên từ fluo, có nghĩa là "dòng chảy" trong tiếng Latinh, được lấy làm tên của khoáng vật này. Được cho là một nguyên tố hóa học vào năm 1810, fluor lúc bấy giờ là một chất gây nguy hiểm và khó phân lập từ các hợp chất của nó, và một số nhà khoa học thời điểm đó bị thương tật hoặc tử vong khi cố gắng thực hiện thí nghiệm này. Phải đến năm 1886, nhà hóa học người Pháp Henri Moissan mới phân lập được nguyên tố fluor qua điện phân ở nhiệt độ thấp, một quá trình vẫn còn được áp dụng trong sản xuất hiện đại. Công cuộc sản xuất khí fluor trong công nghiệp để làm giàu urani, một trong những ứng dụng lớn nhất của fluor, bắt đầu từ dự án Manhattan trong Chiến tranh thế giới thứ hai.
Do vấn đề về chi phí tinh chế fluor tinh khiết, đa số ứng dụng thương mại chủ yếu đến từ các hợp chất của nó, trong đó khoảng một nửa fluorit khai thác được sử dụng trong chế tạo thép. Lượng fluorit còn lại được chuyển thành hydro fluoride ăn mòn để sản xuất fluoride hữu cơ hoặc cryolite, chất đóng vai trò quan trọng trong quá trình luyện nhôm. Fluoride hữu cơ rất bền về mặt hóa học và nhiệt, thường được sử dụng làm chất làm lạnh, chất cách điện và trong chế tạo dụng cụ nhà bếp (dưới dạng PTFE hay Teflon). Một số dược phẩm như atorvastatin và fluoxetine cũng chứa fluor, và ion fluoride làm ức chế ổ răng, được sử dụng trong kem đánh răng và fluor hóa nước. Doanh số của các sản phẩm hóa học liên quan đến fluor ước tính khoảng hơn 15 tỷ USD mỗi năm.
Khí fluorocarbon là loại khí nhà kính với nguy cơ gây ấm lên toàn cầu cao hơn từ 100 đến 20.000 lần so với carbon dioxide. Các hợp chất hữu cơ của fluor tồn tại lâu trong môi trường do độ bền của liên kết giữa carbon và fluor. Fluor không có vai trò trao đổi chất ở động vật; một số thực vật tổng hợp chất độc hữu cơ của nó để ngăn chặn các loài động vật ăn thực vật.
Đặc điểm[sửa | sửa mã nguồn]
Cấu hình electron[sửa | sửa mã nguồn]

Nguyên tử fluor có 9 electron, ít hơn 1 so với neon, và có cấu hình electron là 1s22s22p5: hai electron ở lớp trong đã được lấp đầy và bảy ở lớp ngoài cùng, cần thêm một electron lấp vào. Các electron ngoài cùng bị vô hiệu hóa tại lá chắn nguyên tử và có điện tích hạt nhân hữu hiệu ở mức cao, bằng 9 − 2 = 7; đặc điểm này làm ảnh hưởng đến tính chất vật lý của nguyên tử.[2]
Năng lượng ion hóa thứ nhất của fluor cao thứ ba trong tất cả nguyên tố chỉ sau heli và neon,[13] làm phức tạp thêm quá trình tách electron từ nguyên tử fluor trung hòa. Nó cũng có ái lực electron cao, đứng thứ hai chỉ sau chlor,[14] và có xu hướng lấy một electron để trở thành nguyên tử ở trạng thái bền vững có cùng số electron với khí hiếm neon;[2] nó có độ âm điện cao nhất trong tất cả nguyên tố.[15] Nguyên tử fluor có bán kính liên kết cộng hóa trị nhỏ, khoảng 60 picomet, gần bằng với hai nguyên tố lân cận trong cùng chu kỳ là oxy và neon.[16][17][gc 1]
Khả năng phản ứng[sửa | sửa mã nguồn]
Năng lượng liên kết của difluor F2 nhỏ hơn rất nhiều so với Cl2 hoặc Br2 và gần bằng với liên kết peroxide dễ gãy đôi; đặc điểm này, cùng với độ âm điện cao, là lý do làm fluor dễ bị phân ly, hoạt động hóa học rất mạnh, và tạo liên kết bền với các nguyên tử nguyên tố khác.[18][19] Ngược lại, liên kết giữa fluor với các nguyên tử khác là rất bền do nó có độ âm điện cao. Một số chất trơ như bột thép, mảnh kính, và sợi amiăng phản ứng nhanh với khí fluor lạnh; gỗ và nước tự bốc cháy dưới tia khí fluor.[4][20] Phản ứng của nguyên tố fluor với kim loại yêu cầu điều kiện khác nhau. Kim loại kiềm gây nổ và kim loại kiềm thổ thể hiện phản ứng mãnh liệt ở dạng khối; để tránh sự thụ động hóa từ việc tạo thành lớp fluoride kim loại, phần lớn kim loại khác như nhôm và sắt phải được nghiền bột,[18] và kim loại quý cần khí fluor tinh khiết ở nhiệt độ 300–450 °C (575–850 °F).[21] Một số phi kim rắn như lưu huỳnh và phosphor phản ứng mãnh liệt trong fluor lỏng ở nhiệt độ không khí.[22] Hydro sulfide[22] và lưu huỳnh dioxide[23] dễ phản ứng với fluor tạo thành hợp chất; acid sulfuric có phản ứng ở mức độ yếu hơn nhiều, yêu cầu nhiệt độ cao.[24]
Hydro, giống như một số kim loại kiềm khác, khi phản ứng với fluor sẽ gây nổ.[25] Carbon dưới dạng muội đèn phản ứng ở nhiệt độ phòng sinh ra fluoromethan. Than chì kết hợp với fluor ở nhiệt độ trên 400 °C (750 °F) để tạo thành carbon monofluoride phi thức; ở nhiệt độ cao hơn, phản ứng còn sinh ra khí fluorocarbon và đôi lúc gây nổ.[26] Carbon dioxide và carbon monoxide phản ứng ở nhiệt độ bằng hoặc cao hơn một chút so với nhiệt độ phòng,[27] trong khi parafin và các chất hữu cơ khác tạo phản ứng mạnh:[28] thậm chí, các haloalkan đã thế hết nguyên tử hydro như carbon tetrachloride, những chất thường không bắt lửa, có thể phát nổ.[29] Mặc dù nitơ trifluoride trơ về mặt hóa học, nitơ cần được phóng điện ở nhiệt độ cao để phản ứng với fluor xảy ra do liên kết ba rất bền trong phân tử nitơ;[30] amonia có thể phản ứng gây nổ.[31][32] Oxy không kết hợp với fluor ở điều kiện môi trường xung quanh, nhưng có thể phản ứng được khi phóng điện ở nhiệt độ và áp suất thấp; sản phẩm tạo ra thường bị phân hủy thành các nguyên tố cấu tạo nên chúng khi đun nóng.[33][34][35] Các halogen nặng hơn[36] cũng như khí hiếm radon[37] dễ phản ứng với fluor; trong các khí hiếm khác, chỉ có xenon và krypton là có thể phản ứng được, nhưng phản ứng đó chỉ xảy ra trong điều kiện đặc biệt.[38]
Trạng thái[sửa | sửa mã nguồn]
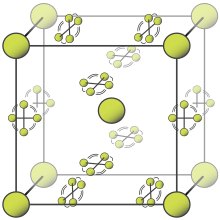
Ở nhiệt độ phòng, fluor là một chất khí dạng phân tử hai nguyên tử;[4] khí fluor nguyên chất có màu vàng nhạt (đôi khi còn nói là màu vàng lục).[39] Nó có mùi hắc đặc trưng cảm nhận được ở mật độ 20 ppb.[40] Fluor ngưng tụ tạo thành chất lỏng màu vàng sáng ở −188 °C (−306 °F), là nhiệt độ chuyển tiếp gần bằng với oxy và nitơ.[41]
Fluor có hai dạng thù hình rắn là α- và β-fluor. β-fluor kết tinh ở −220 °C (−364 °F), có màu trong suốt và mềm dẻo, với cấu trúc hệ tinh thể lập phương không trật tự giống như tinh thể oxy rắn,[41][gc 2] không giống với hệ tinh thể trực thoi trong các halogen rắn khác.[45][46] Khi nhiệt độ tiếp tục giảm xuống −228 °C (−378 °F), quá trình chuyển pha xảy ra tạo thành α-fluor rắn đục có cấu trúc hệ tinh thể đơn nghiêng với các lớp phân tử dày đặc và bo góc. Quá trình chuyển pha từ β- sang α-fluor tỏa nhiệt nhiều hơn so với quá trình ngưng tụ của fluor và có thể diễn ra mạnh mẽ.[45][46][gc 3]
Đồng vị[sửa | sửa mã nguồn]
Đồng vị ổn định 19F là đồng vị duy nhất của fluor tồn tại trong tự nhiên.[47] Nó có tỷ số hồi chuyển từ cao[gc 4] và độ nhạy đặc biệt với từ trường, và vì là đồng vị ổn định duy nhất nên nó được sử dụng trong chụp cộng hưởng từ.[49] Có 17 đồng vị phóng xạ với số khối từ 14 đến 31 đã được tổng hợp, trong đó 18F là đồng vị ổn định nhất với chu kỳ bán rã là 109,77 phút. 18F là một vết đồng vị phóng xạ tự nhiên được tạo thành qua phản ứng phá vỡ argon khí quyển bằng tia vũ trụ cùng với phản ứng của proton với oxy tự nhiên: 18O + p → 18F + n.[50] Các đồng vị phóng xạ khác có chu kỳ bán rã dưới 70 giây; trong đó, đa số bị phân rã trong vòng dưới nửa giây.[51] Hai đồng vị 17F và 18F trải qua quá trình phân rã β+ và bắt giữ electron, các đồng vị nhẹ hơn phân rã qua phát xạ proton, và các đồng vị nặng hơn 19F đi qua quá trình phân rã β− (riêng các đồng vị nặng nhất qua phát xạ neutron chậm).[51][52] Fluor có hai đồng phân siêu bền đã biết là 18mF với chu kỳ bán rã 162(7) phần tỷ giây, và 26mF với chu kỳ bán rã 2,2(1) phần nghìn giây.[53]
Phổ biến[sửa | sửa mã nguồn]
Vũ trụ[sửa | sửa mã nguồn]
| Số hiệu |
Nguyên tố | Mức tương đối |
|---|---|---|
| 6 | Carbon | 4.800 |
| 7 | Nitơ | 1.500 |
| 8 | Oxy | 8.800 |
| 9 | Fluor | 1 |
| 10 | Neon | 1.400 |
| 11 | Natri | 24 |
| 12 | Magnesi | 430 |
Trong số các nguyên tố nhẹ, mật độ phân bố 400 ppb (phần tỷ) của fluor – đứng thứ 24 trong các nguyên tố trong vũ trụ – ở mức thấp một cách bất thường: các nguyên tố khác từ carbon đến magnesi có độ phổ biến lớn hơn từ 20 lần trở lên.[55] Đó là vì các quá trình tổng hợp hạt nhân sao đã bỏ qua fluor, và bất kỳ nguyên tử fluor nào lẽ ra được tạo nên có tiết diện hiệu dụng nguyên tử cao, cho phép tiếp tục dung hợp với hydro hoặc heli để tạo thành oxy hoặc neon.[55][56]
Ngoài lý do về sự tồn tại trong khoảng thời gian ngắn, xa hơn nữa, có ba cách giải thích được đặt ra về sự hiện diện của fluor:[55][57]
- trong siêu tân tinh loại II, việc các hạt neutrino bắn phá vào các nguyên tử neon làm chúng chuyển hóa thành fluor;
- gió Mặt Trời của các sao Wolf–Rayet có thể đã thổi fluor ra khỏi bất kỳ nguyên tử hydro hoặc heli nào; hoặc
- fluor bị rẽ ra trong những dòng đối lưu bắt nguồn từ sự nóng chảy trong các ngôi sao nhánh tiệm cận khổng lồ.
Trái Đất[sửa | sửa mã nguồn]
Fluor là nguyên tố phổ biến thứ 13 trên vỏ Trái Đất, chiếm khoảng 600–700 ppm (phần triệu) về khối lượng.[58] Nguyên tố fluor trên khí quyển Trái Đất có thể phản ứng dễ dàng với hơi nước, dẫn đến nó không phổ biến trong tự nhiên;[59][60] nó chỉ được tìm thấy dưới dạng khoáng vật chứa fluoride, trong đó fluorit, fluorapatite và cryolite có tầm quan trọng lớn nhất trong công nghiệp.[58][61] Fluorit (CaF2), một khoáng vật đa dạng về màu sắc và phổ biến trên thế giới, là nguồn chủ yếu dùng để sản xuất fluor; Trung Quốc và Mexico là những nước cung cấp hàng đầu. Hoa Kỳ từng là quốc gia dẫn đầu về chiết tách fluor vào đầu thế kỷ 20 nhưng đã chấm dứt khai thác vào năm 1995.[61][62][63][64][65] Mặc dù fluorapatite (Ca5(PO4)3F) chiếm tỷ lệ fluoride nhiều nhất trên toàn thế giới, nhưng fluor chỉ chiếm 3,5% khối lượng phân tử, nghĩa là nó phần lớn được sử dụng dưới dạng phosphat. Tại Hoa Kỳ một lượng nhỏ hợp chất của fluor được điều chế qua acid hexafluorosilicic(IV), một sản phẩm phụ của công nghiệp phosphat.[61] Cryolite (Na3AlF6), một khoáng vật được sử dụng trực tiếp trong sản xuất nhôm, là loại khoáng vật giàu fluor nhất. Mỏ khai thác thương mại chính ở bờ Tây Greenland đóng cửa vào năm 1987, và hiện tại phần lớn cryolite được sản xuất bằng phương pháp tổng hợp.[61]
| Các loại khoáng vật chứa fluor chủ yếu | ||

|

|

|
| Fluorit | Fluorapatite | Cryolite |
Một số khoáng vật khác như topaz có chứa fluor. Fluoride, khác với các halide khác, không tan và không tồn tại ở nồng độ thích hợp trong nước muối để có thể được thương mại hóa.[61] Một lượng nhỏ chất hữu cơ của fluor có nguồn gốc không rõ ràng đã được phát hiện trong các vụ phun trào núi lửa và trong các suối nước nóng.[66] Sự tồn tại khí fluor trong tinh thể, dựa vào mùi của antozonite nghiền, là vấn đề còn gây tranh cãi;[67][68] một nghiên cứu năm 2012 báo cáo sự tồn tại của 0,04% F2 trong antozonite về khối lượng, cho rằng những bao thể này là do bức xạ có từ sự tồn tại lượng nhỏ urani.[68]
Lịch sử[sửa | sửa mã nguồn]
Phát hiện ban đầu[sửa | sửa mã nguồn]

Năm 1529, Georgius Agricola mô tả fluorit là một phụ gia được sử dụng để làm giảm nhiệt độ nóng chảy của kim loại trong quá trình nấu luyện.[69][70][gc 5] Ông dùng từ Latinh fluorés (fluo, dòng chảy) để chỉ đá fluorit. Tên này sau đó trở thành fluorspar (hiện còn được dùng phổ biến) và tiếp đến là fluorite.[62][74][75] Thành phần của fluorit về sau được xác định là calci fluoride.[76]
Acid hydrofluoric được sử dụng trong khắc kính từ sau năm 1720.[gc 6] Andreas Sigismund Marggraf lần đầu tiên xác định được đặc tính của hợp chất này vào năm 1764 khi đun nóng fluorit với acid sulfuric, và dung dịch thu được làm ăn mòn bình thủy tinh chứa nó.[78][79] Nhà hóa học người Thụy Điển Carl Wilhelm Scheele lặp lại thí nghiệm này vào năm 1771 và gọi tên sản phẩm thu được là fluss-spats-syran (hay fluorspar acid trong tiếng Anh).[79][80] Năm 1810, nhà vật lý người Pháp André-Marie Ampère đặt giả thiết rằng hydro và một nguyên tố tương tự với chlor tạo nên acid hydrofluoric.[81] Ba năm sau, Sir Humphry Davy đề xuất gọi tên nguyên tố đó là fluorine từ tên tiếng Anh fluoric acid và hậu tố -ine của các halogen khác, dựa trên tên gọi do Ampère đặt ra trong thư gửi ông vào ngày 26 tháng 8 năm 1812.[82][83][84] Từ này được sử dụng trong nhiều ngôn ngữ châu Âu; tiếng Hy Lạp, tiếng Nga, và một số ngôn ngữ khác (sau giả thiết của Ampère) sử dụng tên ftor hoặc các tên gọi dẫn xuất của nó, bắt nguồn từ từ φθόριος (phthorios, phá hủy).[85] Từ fluorum trong tiếng Latinh hiện đại đã dẫn đến ký hiệu nguyên tố là F như hiện tại; ký hiệu Fl từng xuất hiện trong các tài liệu trước đây.[86][gc 7]
Phân lập[sửa | sửa mã nguồn]
Các nghiên cứu ban đầu về fluor nguy hiểm đến mức một số nhà thí nghiệm thế kỷ 19 được gọi là "nhà tử đạo fluor" sau khi gặp điều không may với acid hydrofluoric.[gc 8] Việc phân lập nguyên tố fluor gặp trở ngại bởi tính ăn mòn cực mạnh của chính nguyên tố đó và hydro fluoride, cũng như việc thiếu đi một chất điện ly đơn giản và thích hợp.[76][87] Edmond Frémy đặt giả thuyết rằng việc điện phân hydro fluoride tinh khiết để sinh ra fluor là điều khả thi và nghĩ ra một phương pháp để tạo ra những mẫu khan từ kali bifluoride đã acid hóa; nhưng thay vào đó, ông phát hiện khí hydro fluoride (khô) thu được không dẫn điện.[76][87][88] Henri Moissan, một cựu học trò của Frémy, giữ kiên nhẫn và sau nhiều lần thử và sai thì phát hiện ra rằng hỗn hợp kali hydrofluoride và hydro fluoride khô có tính dẫn điện, cho phép quá trình điện phân được diễn ra. Để chống lại tính ăn mòn nhanh của bạch kim trong pin điện hóa, ông làm lạnh phản ứng đến nhiệt độ cực thấp trong một bình chứa đặc biệt và chế tạo pin từ hỗn hợp bạch kim và iridi có sức chống chịu cao hơn, đồng thời sử dụng nút bít fluorit.[87][89] Năm 1886, sau 74 năm nỗ lực của nhiều nhà hóa học, Moissan phân lập thành công nguyên tố fluor.[88][90]
Năm 1906, hai tháng trước khi qua đời, Moissan được trao giải Nobel Hóa học,[91] với lời tuyên dương rằng để:[87]
công nhận những điều hữu ích mà ông đã làm nên trong quá trình nghiên cứu và phân lập nguyên tố fluor… Cả thế giới đã ngưỡng mộ trước kỹ năng thí nghiệm tuyệt vời mà từ đó, [ông] đã tìm hiểu được "con thú dữ" trong tất cả các nguyên tố.[gc 9]
-
Tranh vẽ dụng cụ thí
nghiệm của Moissan (1887) -
Chân dung Henri Moissan
Ứng dụng sau này[sửa | sửa mã nguồn]

Công ty con Frigidaire của General Motors (GM) thực hiện các thí nghiệm với chất làm lạnh chlorofluorocarbon vào cuối thập niên 1920, và Kinetic Chemicals được thành lập dưới sự hợp tác liên doanh giữa GM và DuPont vào năm 1930 với hy vọng quảng bá Freon-12 (CCl2F2) trở thành một chất làm lạnh như thế. Nó dần thay thế các hợp chất cũ và độc hại trước đây, làm tăng nhu cầu sử dụng tủ lạnh trong nhà bếp, và trở thành sản phẩm sinh lời; đến năm 1949 DuPont đã mua lại Kinetic và quảng bá một số hợp chất Freon khác.[79][92][93][94] Polytetrafluoroethylen (Teflon) được Roy J. Plunkett tìm ra một cách tình cờ vào năm 1938 khi nghiên cứu về tủ lạnh tại Kinetic, và tính trơ mạnh về mặt hóa học và về nhiệt của nó góp phần làm tăng tốc việc thương mại hóa và sản xuất đại trà đến năm 1941.[79][92][93]
Nguyên tố fluor bắt đầu được sản xuất đồng loạt trong Chiến tranh thế giới thứ hai. Đức áp dụng phương pháp điện phân ở nhiệt độ cao để chế tạo hàng tấn chlor trifluoride gây cháy theo kế hoạch[95] và Dự án Manhattan sử dụng lượng lớn cho sản xuất urani(VI) fluoride để làm giàu urani. Vì UF6 có tính ăn mòn giống fluor, các nhà máy khuếch tán dạng thể khí cần những loại nguyên liệu đặc biệt: nickel dùng làm màng, fluoropolymer làm lớp cản, và fluorocarbon lỏng làm chất làm lạnh và chất bôi trơn. Ngành công nghiệp hạt nhân đang phát triển nhanh chóng này về sau đã giúp đẩy mạnh sự phát triển của ngành hóa học fluor sau chiến tranh.[96]
Hợp chất[sửa | sửa mã nguồn]
Số lượng hợp chất hóa học liên quan đến fluor là rất lớn, bao gồm cả phạm vi hữu cơ và vô cơ. Fluor kết hợp được với kim loại, phi kim, á kim và phần lớn khí hiếm,[97] và thường có trạng thái oxy hóa là −1 trong các hợp chất này.[gc 10] Ái lực electron cao của fluor dẫn đến ưu tiên về liên kết ion: khi nó tạo thành liên kết cộng hóa trị, chúng là các liên kết có cực và gần như luôn luôn là liên kết đơn.[100][101][gc 11]
Kim loại[sửa | sửa mã nguồn]
Kim loại kiềm tạo thành muối ion monofluoride và dễ tan; chúng có cấu trúc dạng lập phương như natri chloride và các muối chloride tương tự.[102][103] Muối difluoride của kim loại kiềm thổ chứa các liên kết ion mạnh nhưng không tan trong nước,[86] ngoại trừ beryli fluoride, một chất biểu thị một số đặc trưng cộng hóa trị và có cấu trúc giống với thạch anh.[104] Đất hiếm và nhiều kim loại khác tạo thành muối trifluoride, đa số trong đó là muối ion.[105][106][107]
Liên kết cộng hóa trị dễ thấy rõ trước tiên là ở muối tetrafluoride: muối của zirconi, hafni[108][109] và một số nguyên tố họ Actini[110] là muối ion với nhiệt độ nóng chảy cao,[111][gc 12] trong khi muối của titani,[114] vanadi,[115] và niobi là muối trùng hợp,[116] nóng chảy hoặc phân hủy ở nhiệt độ không quá 350 °C (660 °F).[117] Muối pentafluoride tiếp tục xu hướng này với các polymer nằm theo đường thẳng và phức hệ oligomer.[118][119][120] Có 13 muối hexafluoride kim loại đã biết,[gc 13] tất cả đều có dạng bát diện, và phần lớn chúng là chất rắn dễ bay hơi ngoại trừ chất lỏng MoF6 và ReF6, và chất khí WF6.[121][122][123] Rheni(VII) fluoride, muối heptafluoride kim loại duy nhất được mô tả rõ ràng, là một chất rắn phân tử nóng chảy chậm có dạng hình học phân tử tháp đôi năm cạnh.[124] Muối fluoride kim loại với nhiều nguyên tử fluor hơn có khả năng phản ứng đặc biệt cao.[125]
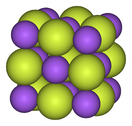
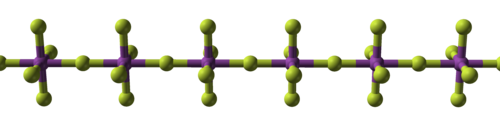
| Cấu trúc của muối fluoride kim loại | ||
|
|

|
| Natri fluoride, muối ion | Bismuth pentafluoride, muối trùng hợp | Rheni heptafluoride, muối phân tử |
Hydro[sửa | sửa mã nguồn]

Hydro kết hợp với fluor để tạo thành hydro fluoride, trong đó các phân tử rời rạc tập trung thành cụm bằng liên kết hydro, tương đồng với nước hơn hydro chloride.[126][127][128] Nó sôi tại nhiệt độ cao hơn nhiều so với các hydro halide nặng hơn và bị trộn lẫn hoàn toàn với nước, khác với các hydro halide này.[129] Hydro fluoride dễ bị hydrat hóa khi tiếp xúc với nước để tạo thành dung dịch hydro fluoride, hay còn gọi là acid hydrofluoric. Không giống các acid hydrohalic khác, vốn đều là acid mạnh, acid hydrofluoric là một acid yếu ở nồng độ thấp,[130][gc 14] có hằng số điện ly acid pKa bằng 3,17 ở 25 °C.[132] Tuy nhiên, nó có thể làm ăn mòn thủy tinh, điều mà các acid khác không thể làm được.[133]
Phi kim dễ phản ứng khác[sửa | sửa mã nguồn]
- Á kim cũng được xét trong phần này

Hợp chất fluoride hai nguyên tố của á kim và phi kim khối p thường là hợp chất cộng hóa trị và dễ bay hơi, với khả năng phản ứng khác nhau. Phi kim chu kỳ 3 trở về sau có thể tạo thành hợp chất fluoride siêu hóa trị.[135]
Bor trifluoride có dạng phẳng và chứa một bát tử chưa hoàn chỉnh. Nó hoạt động hóa học như một acid Lewis và kết hợp với base Lewis như amonia để tạo thành sản phẩm cộng.[136] Carbon tetrafluoride có dạng tứ diện và là chất trơ;[gc 15] các hợp chất cùng nhóm với nó, silic và germani tetrafluoride, cũng có dạng tứ diện[137] nhưng hoạt động giống một acid Lewis.[138][139] Các nguyên tố nhóm nitơ tạo thành hợp chất trifluoride có khả năng phản ứng và tính base tăng dần khi khối lượng mol càng lớn, mặc dù nitơ trifluoride chống lại sự thủy phân và không có tính base.[140] Hợp chất pentafluoride của phosphor, arsenic, và antimon có khả năng phản ứng lớn hơn so với hợp chất trifluoride tương ứng, trong đó antimon pentafluoride là acid Lewis trung tính mạnh nhất đã biết.[118][141][142]
Hợp chất fluoride của các nguyên tố nhóm chalcogen gồm nhiều loại khác nhau: hợp chất difluoride không bền tồn tại đối với oxy (hợp chất duy nhất đã biết mà trong đó oxy có trạng thái oxy hóa +2), lưu huỳnh, và selen. Hợp chất tetrafluoride và hexafluoride của lưu huỳnh, selen và telu cũng tồn tại; đó là hợp chất bền do có nhiều nguyên tử fluor hơn và các nguyên tử trung tâm nhẹ hơn, nên lưu huỳnh hexafluoride là chất đặc biệt trơ về mặt hóa học.[143][144] Chlor, brom và iod có thể tạo thành các hợp chất mono-, tri- và pentafluoride, nhưng chỉ có iod heptafluoride là xác định được đặc tính trong số các hợp chất heptafluoride của hợp chất halogen có thể có.[145] Nhiều loại hợp chất trong số này là nguồn chính tạo ra nguyên tử fluor và các hoạt động công nghiệp sử dụng chlor trifluoride yêu cầu biện pháp phòng ngừa tai nạn tương tự như khi sử dụng fluor.[146][147]
Khí hiếm[sửa | sửa mã nguồn]

Khí hiếm, những nguyên tố có các lớp electron hoàn chỉnh, không có phản ứng nào với các nguyên tố hóa học khác cho đến năm 1962 khi Neil Bartlett phát hiện và tổng hợp được xenon hexafluoroplatinat;[149] xenon difluoride, tetrafluoride, hexafluoride, và nhiều hợp chất oxyfluoride đã được phân lập thành công kể từ đó.[150] Trong các khí hiếm khác, krypton tạo thành muối difluoride,[151] và radon phản ứng với fluor để tạo thành một chất rắn được cho là radon difluoride.[152][153] Muối fluoride hai nguyên tố của các khí hiếm nhẹ hơn là loại muối không bền cá biệt: argon và hydro fluoride kết hợp với nhau trong điều kiện vô cùng đặc biệt để sinh ra argon fluorohydride.[38] Không có muối fluoride nào của heli và neon tồn tại lâu,[154] và chưa có muối neon fluoride nào từng được quan sát;[155] heli fluorohydride được ghi nhận là có thể thấy được trong vòng vài phần nghìn giây ở áp suất cao và nhiệt độ thấp.[154]
Hợp chất hữu cơ[sửa | sửa mã nguồn]

Liên kết carbon−fluor là liên kết mạnh nhất trong hóa hữu cơ,[157] và làm cho các hợp chất hữu cơ của fluor có tính bền.[158] Nó gần như không tồn tại trong tự nhiên, nhưng có trong các hợp chất tổng hợp. Các nghiên cứu trong lĩnh vực này thường được thúc đẩy bởi những ứng dụng trong sản xuất thương mại;[159] các hợp chất liên quan rất đa dạng và phản ánh độ phức tạp vốn có trong hóa hữu cơ.[92]
Phân tử rời rạc[sửa | sửa mã nguồn]
Sự thay thế liên tục nguyên tử hydro trong một alkane bằng nguyên tử fluor làm biến đổi tính chất hóa học của nó một cách từ từ: điểm nóng chảy và điểm sôi giảm xuống, khối lượng riêng tăng lên, tính tan trong hydrocarbon giảm và tính bền tổng thể tăng. Perfluorocarbon,[gc 16] những chất trong đó các nguyên tử hydro bị thay thế hết, không tan trong phần lớn dung môi hữu cơ, chỉ xảy ra phản ứng với natri trong amonia lỏng ở điều kiện xung quanh.[160]
Thuật ngữ hợp chất perfluor hóa được dùng cho những hợp chất vốn có thể là perfluorocarbon nếu không phải do sự xuất hiện của một nhóm chức,[161][gc 17] thường là acid carboxylic. Các hợp chất này cũng có nhiều tính chất tương tự như perfluorocarbon, chẳng hạn như tính bền và tính kỵ nước,[163] trong khi nhóm chức làm tăng khả năng phản ứng của chúng, cho phép chúng bám vào bề mặt hoặc trở thành chất hoạt động bề mặt;[164] đặc biệt, chất hoạt động bề mặt fluor hóa có thể làm giảm sức căng bề mặt của nước nhiều hơn so với các đồng đẳng gốc hydrocarbon của chúng. Fluorotelome, những chất có một vài nguyên tử carbon chưa bị fluor hóa gần nhóm chức, cũng được xem là hợp chất perfluor hóa.[163]
Polymer[sửa | sửa mã nguồn]
Polymer cũng thể hiện tính bền tăng dần do sự thay thế nguyên tử hydro bằng fluor trong các phân tử rời rạc; điểm nóng chảy của chúng cũng thường tăng lên như vậy.[165] Polytetrafluoroethylen (PTFE), loại fluoropolymer đơn giản nhất và là đồng đẳng perfluoro của polyethylene với đơn vị cấu trúc là –CF2–, thể hiện sự thay đổi này theo dự đoán, nhưng điểm nóng chảy rất cao của nó làm nó khó có thể được dập khuôn.[166] Một số dẫn xuất PTFE chịu được nhiệt độ thấp hơn nhưng dễ dập khuôn hơn: nhựa FEP thay một số nguyên tử fluor bằng nhóm trifluorometyl, nhựa PFA làm tương tự với nhóm trifluoromethoxy,[166] và Nafion chứa các xích bên perfluoroete kết thúc bằng nhóm acid sulfonic.[167][168] Một số fluoropolymer khác vẫn giữ lại một vài nguyên tử hydro; polyvinylidene fluoride chứa lượng nguyên tử fluor bằng một nửa của PTFE và polyvinyl fluoride chứa lượng bằng một phần tư, nhưng cả hai đều có tính chất giống polymer perfluor hóa.[169]
Sản xuất[sửa | sửa mã nguồn]
Trong công nghiệp[sửa | sửa mã nguồn]

Phương pháp của Moissan được áp dụng để sản xuất fluor trong công nghiệp, thông qua điện phân hỗn hợp kali fluoride/hydro fluoride: các ion hydro và ion fluoride được khử và oxy hóa tại một thùng chứa bằng thép làm cathode và một khối carbon làm anode dưới dòng điện 8–12 vôn để tạo ra khí hydro và khí fluor.[63][170] Nhiệt độ sau đó được tăng lên, KF•2HF nóng chảy ở 70 °C (158 °F) và được điện phân ở 70–130 °C (158–266 °F). KF, chất dùng làm xúc tác, là cần thiết vì HF tinh khiết không thể điện phân được.[79][171][172] Fluor có thể được cất trữ trong trụ thép có phần bên trong được thụ động hóa, ở nhiệt độ dưới 200 °C (392 °F); nếu không thì có thể dùng nickel.[79][171] Van điều chỉnh và đường ống được làm bằng nickel; riêng đường ống thay vào đó có thể làm bằng Monel.[173] Việc thụ động hóa thường xuyên cũng như ngăn nước và dầu mỡ phải được thực hiện. Trong phòng thí nghiệm, dụng cụ thủy tinh có thể trữ được khí fluor ở áp suất thấp và điều kiện không có nước;[173] một số tài liệu thay vào đó khuyến cáo sử dụng hệ thống nickel-Monel-PTFE.[174]
Điều chế hóa học[sửa | sửa mã nguồn]
Khi đang chuẩn bị một hội nghị kỷ niệm 100 năm thành tựu của Moissan vào năm 1986, Karl O. Christe tìm ra rằng việc điều chế fluor về mặt hóa học là có thể thực hiện được trên cơ sở rằng phản ứng giữa một muối fluoride của kim loại có trạng thái oxy hóa cao và một chất nhận ion fluoride mạnh làm sinh ra fluoride kim loại không bền, một chất sau đó bị phân hủy để tạo ra khí fluor.[175][176] Ông trình bày một phương pháp để thu được fluor với hiệu suất cao và áp suất ở mức khí quyển:[177]
- 2 KMnO4 + 2 KF + 10 HF + 3 H2O2 → 2 K2MnF6 + 8 H2O + 3 O2↑
- 2 K2MnF6 + 4 SbF5 → 4 KSbF6 + 2 MnF3 + F2↑
Christe về sau bình luận thêm rằng các chất phản ứng "đã được biết đến trong hơn 100 năm và thậm chí cả Moissan có thể đến được với phương pháp này".[178] Ít nhất đến năm 2008, một số tài liệu vẫn xác nhận rằng fluor có khả năng phản ứng cao đến mức khó có thể điều chế và phân lập được.[179]
Ứng dụng trong công nghiệp[sửa | sửa mã nguồn]
Khai thác fluorit, nguồn cung cấp fluor chủ yếu cho toàn thế giới, đạt đỉnh vào năm 1989 khi có 5,6 triệu tấn quặng được khai thác. Các quy định hạn chế sử dụng chlorofluorocarbon được ban hành làm con số này giảm xuống còn 3,6 triệu tấn vào năm 1994; việc sản xuất về sau tăng trưởng trở lại. Khoảng 4,5 triệu tấn quặng với tổng giá trị 550 triệu USD được tạo ra vào năm 2003; các báo cáo về sau ước tính tổng doanh số ngành hóa học fluor toàn cầu năm 2011 đạt 15 tỷ USD và dự báo giá trị sản xuất từ năm 2016 đến 2018 là từ 3,5 đến 5,9 triệu tấn cùng tổng doanh thu ít nhất 20 tỷ USD.[79][180][181][182][183] Lượng fluorit khai thác được chia thành hai phân khúc chính với tỷ lệ bằng nhau: fluorit có độ tinh khiết từ 60–85% (metspar) hầu hết được sử dụng trong nấu luyện sắt trong khi loại tinh khiết trên 97% (acidspar) thường được chuyển thành chất trung gian phản ứng hydro fluoride chủ chốt trong công nghiệp.[63][79][184]


Ít nhất 17.000 tấn fluor được sản xuất mỗi năm. Nó chỉ có chi phí khoảng từ 5 đến 8 USD mỗi kilôgam dưới dạng urani hoặc lưu huỳnh hexafluoride, nhưng cao hơn nhiều lần dưới dạng nguyên tố do vấn đề về vận chuyển. Đa số quá trình sử dụng lượng lớn fluor tự do áp dụng kỹ thuật tạo ra tại chỗ (in situ) dưới hình thức hội nhập theo chiều dọc.[185]
Ứng dụng lớn nhất của khí fluor, tiêu thụ khoảng 7.000 tấn mỗi năm, là trong quá trình điều chế UF6 cho chu trình nhiên liệu hạt nhân. Fluor được sử dụng để fluor hóa urani(IV) fluoride, một chất được tự tổng hợp từ urani dioxide và acid hydrofluoric.[185] Fluor là chất đơn đồng vị, nên sự khác nhau về khối lượng giữa các phân tử UF6 là do sự tồn tại của 235U hoặc 238U, cho phép làm giàu urani qua khuếch tán dạng thể khí hoặc máy ly tâm khí.[4][63] Khoảng 6.000 tấn fluor hàng năm được đi vào sản xuất SF6 điện môi trơ cho máy biến áp cao thế và cầu dao điện, loại bỏ yêu cầu về chất nguy hại PCB có liên quan với thiết bị sử dụng dầu.[186] Một số hợp chất của fluor được ứng dụng trong điện tử: rheni và wolfram hexafluoride trong lắng đọng hơi hoá học, tetrafluoromethan trong khắc plasma[187][188][189] và nitơ trifluoride trong thiết bị tẩy rửa.[63] Fluor cũng được dùng trong việc tổng hợp fluoride hữu cơ, nhưng khả năng phản ứng của nó đòi hỏi nó trước tiên phải được chuyển về ClF3, BrF3 hoặc IF5, những chất đồng thời cho phép diễn ra quá trình fluor hoá có hiệu chỉnh. Các loại dược phẩm đã fluor hóa sử dụng lưu huỳnh tetrafluoride để thay thế.[63]
Fluoride vô cơ[sửa | sửa mã nguồn]

Giống như các hợp kim của sắt khác, khoảng 3 kg metspar được thêm vào mỗi tấn thép; các ion fluoride làm giảm nhiệt độ nóng chảy và độ nhớt của nó.[63][190] Cùng với vai trò làm chất phụ gia trong một số nguyên liệu như men và lớp phủ đũa hàn, phần lớn acidspar được cho phản ứng với acid sulfuric để tạo thành acid hydrofluoric, một chất được sử dụng trong tẩy gỉ thép, khắc kính và cracking alkane.[63] Một phần ba HF được dùng trong tổng hợp cryolite và nhôm fluoride, sau đó cả hai chảy theo dòng trong công nghệ Hall−Héroult để chiết tách nhôm; việc bổ sung là cần thiết do thỉnh thoảng chúng phản ứng với dụng cụ nấu luyện. Mỗi tấn nhôm cần khoảng 23 kg nhôm fluoride.[63][191] Fluorosilicat tiêu thụ một lượng chiếm tỷ lệ nhiều thứ hai, trong đó natri hexafluorosilicat(IV) sử dụng trong fluor hóa nước và xử lý nước thải, và được dùng dưới dạng chất trung gian phản ứng để sản xuất cryolite và silic tetrafluoride.[192] Một số fluoride vô cơ quan trọng khác bao gồm muối fluoride của cobalt, nickel và amoni.[63][103][193]
Fluoride hữu cơ[sửa | sửa mã nguồn]
Hợp chất fluoride hữu cơ tiêu thụ khoảng 20% lượng fluorit khai thác và hơn 40% lượng acid hydrofluoric, trong đó khí làm lạnh chiếm ưu thế và fluoropolymer đang tăng trưởng về thị phần.[63][194] Chất hoạt động bề mặt là một ứng dụng nhỏ của fluor nhưng đem lại khoảng 1 tỷ USD doanh thu hàng năm.[195] Do nguy cơ gây hại từ phản ứng hydrocarbon–fluor trực tiếp ở nhiệt độ trên –150 °C (–240 °F), việc sản xuất fluorocarbon trong công nghiệp được thực hiện gián tiếp, chủ yếu qua các phản ứng trao đổi halogen chẳng hạn như phản ứng fluor hóa Swarts, trong đó các nguyên tử chlor trong chlorocarbon được thay thế bằng fluor bởi acid hydrofluoric kèm xúc tác. Phản ứng fluor hóa điện hóa đưa hydrocarbon ra điện phân trong hydro fluoride, và quá trình Fowler xử lý chúng bằng các chất chứa fluor dạng rắn như cobalt(III) fluoride.[92][196]
Khí làm lạnh[sửa | sửa mã nguồn]
Các chất làm lạnh đã halogen hóa, còn có tên gọi là Freon,[gc 18] được định danh bằng số R chỉ lượng fluor, chlor, carbon và hydro có trong nó.[63][197] Các hợp chất chlorofluorocarbon (CFC) như R-11, R-12 và R-114 từng chiếm vai trò chủ đạo trong nhóm hợp chất hữu cơ của fluor, đạt đỉnh về sản xuất trong thập niên 1980. Được sử dụng trong các hệ thống máy điều hòa, chất nổ đẩy và dung môi, sản lượng sản xuất chúng đến đầu thập niên 2000 chỉ còn bằng dưới một phần mười so với mức đỉnh sau khi nhiều quốc gia ban hành lệnh cấm sử dụng.[63] Hydrochlorofluorocarbon (HCFC) và hydrofluorocarbon (HFC) được xem là những chất thay thế; hơn 90% lượng fluor trong công nghiệp hữu cơ được dùng để tổng hợp chúng. Các chất HCFC quan trọng bao gồm R-22, chlorodifluoromethan và R-141b. Loại HFC chính hiện tại là R-134a[63] cùng với một dạng phân tử mới HFO-1234yf, một hydrofluoroolefin đang dần trở nên nổi bật do có nguy cơ gây ấm lên toàn cầu chỉ bằng dưới 1% so với HFC-134a.[198]
Polyme[sửa | sửa mã nguồn]
Có khoảng 180.000 tấn fluoropolymer được sản xuất vào năm 2006 và 2007, tạo ra doanh thu hơn 3,5 tỷ USD mỗi năm.[199] Tổng doanh số thị trường fluoropolymer toàn cầu được ước tính là gần 6 tỷ USD vào năm 2011 và được dự báo tăng trưởng 6,5% mỗi năm đến năm 2016.[200] Fluoropolymer chỉ có thể được tạo thành bằng cách polymer hóa các gốc tự do.[165]
Polytetrafluoroetylen (PTFE), còn được gọi là Teflon theo tên thương hiệu của DuPont,[201] chiếm khoảng 60–80% khối lượng fluoropolymer được sản xuất trên thế giới.[199] Ứng dụng lớn nhất của nó là làm chất cách điện vì PTFE là một chất điện môi rất tốt. Nó cũng được sử dụng làm chất chống ăn mòn trong công nghiệp hóa học khi cần thiết, đặc biệt làm lớp tráng đường ống. Một ứng dụng chủ yếu khác là trong vải sợi thủy tinh bọc bởi PTFE để làm mái che sân vận động. Ứng dụng thương mại lớn nhất của nó là trong dụng cụ nhà bếp chống dính.[201] Phim PTFE bị kéo dãn và giật trở thành PTFE dạng mềm (ePTFE), một loại màng tổng hợp có lỗ rỗ nhỏ với tên thương hiệu là Gore-Tex, được sử dụng để sản xuất áo mưa, thiết bị bảo hộ cá nhân và màng lọc; sợi ePTFE có thể dùng để chế tạo phớt cơ khí và màng lọc bụi.[201] Một số loại fluoropolymer khác, bao gồm etylen propylen fluor hóa, cũng có các tính chất của PTFE và có thể dùng thay thế cho nó; chúng dễ dập khuôn hơn nhưng có chi phí cao hơn và tính chịu nhiệt kém hơn. Phim nhựa từ hai loại fluoropolymer khác nhau thay thế thủy tinh trong pin Mặt Trời.[201][202]
Các chất ionome fluor hóa, những chất bền về mặt hóa học nhưng chi phí cao, được dùng làm màng bọc pin điện hóa, trong đó chất được kể đến đầu tiên và nổi bật nhất là Nafion. Được phát triển từ những năm 1960, Nafion ban đầu được sử dụng làm vật liệu trong pin nhiên liệu của các thiết bị vũ trụ và sau đó thay thế pin xút–chlor làm từ thủy ngân. Gần đây, ứng dụng làm pin nhiên liệu bắt đầu xuất hiện trở lại với những nỗ lực để lắp đặt pin nhiên liệu màng trao đổi proton trên xe ô tô.[203][204][205] Các loại fluoroelastome chẳng hạn như Viton là hỗn hợp fluoropolymer liên kết ngang được ứng dụng chủ yếu để làm vòng chữ O;[201] perfluorobutan (C4F10) được dùng làm chất dập tắt đám cháy.[206]
Chất hoạt động bề mặt[sửa | sửa mã nguồn]

Chất hoạt động bề mặt fluor hóa là các phân tử nhỏ hữu cơ chứa fluor được sử dụng để chống thấm nước và vết bẩn. Mặc dù có giá đắt đỏ (so sánh được với dược phẩm ở khoảng 200 đến 2.000 USD một kilôgam), chúng tạo ra doanh thu hàng năm hơn 1 tỷ USD đến năm 2006; riêng doanh số của Scotchgard là hơn 300 triệu USD vào năm 2000.[195][207][208] Chất hoạt động bề mặt fluor hóa chỉ chiếm tỷ trọng nhỏ trong thị trường chất hoạt động bề mặt, trong đó các sản phẩm giá rẻ làm từ hydrocarbon chiếm phần lớn thị phần. Ứng dụng trong sơn vẫn còn hạn chế do chi phí pha trộn và tổng hợp, với tổng sản lượng chỉ khoảng 100 triệu USD vào năm 2006.[195]
Sản phẩm nông hóa học[sửa | sửa mã nguồn]
Khoảng 30% sản phẩm nông hóa học có chứa fluor,[209] phần lớn trong đó là thuốc diệt cỏ và thuốc diệt nấm cùng một vài chất kích thích hoặc ức chế cây trồng. Phản ứng thế bởi fluor, thường là của một nguyên tử hoặc nhiều nhất là một nhóm trifluorometyl, làm biến đổi mạnh các tính chất tương tự như dược phẩm fluor hóa.[210] Trifluralin là một ví dụ nổi bật, được sử dụng phổ biến làm chất diệt cỏ dại,[210][211] nhưng được cho là một chất gây ung thư và đã bị cấm sử dụng tại nhiều quốc gia châu Âu.[212] Natri fluoroacetat (1080) là một chất độc với động vật có vú, trong đó hai nguyên tử hydro trong acid acetic được thế bằng fluor và natri; nó làm phá vỡ trao đổi chất trong tế bào bằng cách thay thế acetat trong chu trình Krebs. Được tổng hợp lần đầu vào thế kỷ 19, nó được xếp loại là thuốc trừ sâu vào đầu thế kỷ 20 và sau này được sản xuất và sử dụng đại trà như ngày nay. New Zealand, quốc gia tiêu thụ 1080 nhiều nhất, sử dụng nó để bảo vệ chim kiwi khỏi sự xâm lấn từ cáo túi đuôi chổi Australia.[213] Châu Âu và Hoa Kỳ đã cấm hoặc hạn chế sử dụng 1080.[214][215][gc 19]
Ứng dụng trong y tế[sửa | sửa mã nguồn]
Chăm sóc răng miệng[sửa | sửa mã nguồn]
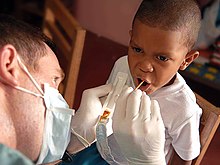
Các nghiên cứu từ giữa thế kỷ 20 cho thấy điều trị tại chỗ bằng fluoride làm giảm sâu răng. Điều này ban đầu được lý giải là do hydroxyapatite trong men răng được chuyển thành fluorapatite bền hơn, nhưng các nghiên cứu trên răng chưa fluor hóa đã bác bỏ giả thuyết này, và ngày nay hiện tượng này được giải thích là do fluoride giúp phục hồi men răng tại các lỗ sâu nhỏ.[216] Sau các nghiên cứu trong trẻ em tại những khu vực mà fluor có trong nước uống một cách tự nhiên, công cuộc fluor hóa nguồn nước sinh hoạt để chống sâu răng[217] bắt đầu vào thập niên 1940 và đến nay đã được áp dụng với nguồn nước cung cấp cho 6% dân số thế giới, bao gồm hai phần ba người dân Hoa Kỳ.[218][219] Các bài bình duyệt học thuật vào năm 2000 và 2007 cho thấy có mối liên hệ giữa fluor hóa nước và sự suy giảm mạnh triệu chứng sâu răng ở trẻ em.[220] Mặc dù nhận được sự ủng hộ như vậy, cũng như có bằng chứng cho thấy không có tác dụng bất lợi ngoài triệu chứng răng nhiễm độc fluor ở mức nhẹ ở đa số trường hợp,[221] song những tranh cãi về mặt đạo đức và an toàn vẫn còn tiếp diễn.[219][222] Lợi ích từ việc fluor hóa này đã và đang giảm xuống có thể do sự xuất hiện của các nguồn fluoride thay thế, nhưng vẫn đong đếm được ở nhóm thu nhập thấp.[223] Natri monofluorophosphat cùng với natri hoặc thiếc(II) fluoride thường được tìm thấy trong các loại kem đánh răng fluoride, một sản phẩm lần đầu tiên được giới thiệu tại Hoa Kỳ vào năm 1955 và hiện rất phổ biến ở các quốc gia phát triển, cùng với nước súc miệng, gel, bọt và vecni fluor hóa.[223][224]
Dược phẩm[sửa | sửa mã nguồn]
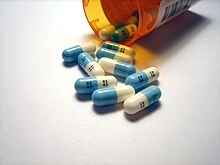
Khoảng 20% dược phẩm hiện đại có chứa fluor.[225] Một trong số đó, thuốc làm giảm cholesterol atorvastatin (Lipitor), có doanh thu nhiều hơn bất kỳ loại thuốc nào khác đến khi nó trở thành thuốc gốc vào năm 2011.[226] Thuốc kê toa chữa hen phế quản Seretide với doanh số đứng trong top 10 vào giữa thập niên 2000 chứa hai thành phần công hiệu, trong đó fluticasone là chất đã fluor hóa.[227] Nhiều loại dược phẩm được fluor hóa để làm chậm lại thời điểm bất hoạt do liên kết carbon–fluor rất bền.[228] Fluor hóa cũng làm tăng tính tan trong chất mỡ do liên kết này có tính kỵ nước cao hơn liên kết carbon–hydro, và tính chất này ảnh hưởng đến sự xâm nhập của thuốc lên màng tế bào, kéo theo sinh khả dụng tăng lên.[227]
Thuốc chống trầm cảm ba vòng cùng một số loại thuốc chống trầm cảm khác trước những năm 1980 có một số tác dụng phụ do sự can thiệp không chọn lọc của chúng với chất dẫn truyền thần kinh thay vì tác nhân chính serotonin; fluoxetine đã fluor hóa trở thành một trong những loại thuốc đầu tiên tránh được vấn đề này. Nhiều loại thuốc chống trầm cảm ngày nay cũng có tác dụng tương tự, bao gồm thuốc ức chế tái hấp thu serotonin có chọn lọc: citalopram cùng đồng phân escitalopram, fluvoxamine và paroxetine.[229][230] Quinolone là kháng sinh phổ rộng nhân tạo thường được fluor hóa để làm tăng phổ tắc dụng. Chúng bao gồm ciprofloxacin và levofloxacin.[231][232][233][234] Fluor cũng có trong một số loại steroid:[235] fludrocortisone là một loại mineralocorticoid làm tăng huyết áp, còn triamcinolone và dexamethasone là các glucocorticoid mạnh.[236] Đa số thuốc gây mê hít vào được fluor hóa mạnh; thuốc đầu tiên như vậy, halothane, có tính trơ và hiệu nghiệm lớn hơn nhiều so với các loại khác cùng thời. Các hợp chất về sau chẳng hạn như ether đã fluor hóa, trong đó gồm sevoflurane và desflurane, được xem là tốt hơn halothane và gần như không tan trong máu, cho phép thời gian tỉnh lại nhanh hơn.[237][238]
Chụp PET[sửa | sửa mã nguồn]

Fluor-18 thường được tìm thấy trong chất đánh dấu phóng xạ cho việc chụp cắt lớp phát xạ positron, vì chu kỳ bán rã gần 2 giờ của nó là đủ dài để vận chuyển từ cơ sở sản xuất đến trung tâm tổng hợp ảnh y khoa.[239] Chất đánh dấu phổ biến nhất là fludeoxyglucose,[239] một chất mà sau khi được tiêm vào tĩnh mạch thì được đưa lên bởi các mô đang cần glucose như não và phần lớn khối u ác tính;[240] sau đó, có thể sử dụng công nghệ chụp cắt lớp vi tính để cung cấp hình ảnh chi tiết.[241]
Chất vận chuyển oxy[sửa | sửa mã nguồn]
Fluorocarbon lỏng có thể tải và vận chuyển lượng lớn thể tích oxy hoặc carbon dioxide, lớn hơn nhiều so với máu, và đã thu hút sự quan tâm với khả năng được ứng dụng trong máu nhân tạo và thở chất lỏng.[242] Do fluorocarbon không thể tạo thành hỗn hợp với nước theo cách thông thường, chúng phải được trộn với nhũ tương (các giọt bắn perfluorocarbon nhỏ lơ lửng trong nước) để thay thế cho máu.[243][244] Oxycyte, một loại sản phẩm như vậy, đã trải qua các giai đoạn thử nghiệm lâm sàng ban đầu.[245] Các chất này có thể làm tăng sức bền của vận động viên và đã bị cấm trong thể thao; một trường hợp tay đua xe đạp suýt tử vong vào năm 1998 đã dẫn đến một cuộc điều tra liên quan đến chúng.[246][247] Một số ứng dụng của thở chất lỏng perfluorocarbon tinh khiết (sử dụng chất lỏng perfluorocarbon tinh khiết thay vì nhũ tương nước) bao gồm hỗ trợ người bị bỏng và trẻ sinh non bằng phổi thiếu khuyết. Các quá trình ghép phổi một phần và đầy đủ đều đã được nghiên cứu và xem xét, dù chỉ có ghép phổi một phần là được thử nghiệm rộng rãi trên người.[248] Phương pháp ghép một phần của Alliance Pharmaceuticals từng được thử nghiệm lâm sàng nhưng đã bị chấm dứt vì hiệu quả không tốt hơn so với các liệu pháp thông thường.[249]
Vai trò sinh học[sửa | sửa mã nguồn]

Fluor là nguyên tố không thiết yếu đối với người hoặc động vật có vú; một lượng nhỏ fluor có thể làm tăng độ bền chắc của xương, nhưng hiệu quả này vẫn chưa được xác minh một cách rõ ràng. Do có nhiều nguồn chứa fluor lượng nhỏ trong môi trường, khả năng thiếu fluor chỉ có thể xảy ra do chế độ ăn của người;[250] lượng fluor cần thiết và phù hợp trong khẩu phần ăn hàng ngày được khuyến cáo dựa trên nhu cầu dinh dưỡng khuyến nghị do Tổ chức Y tế Thế giới[251] và Viện Y học, Viện Hàn lâm Khoa học Quốc gia Hoa Kỳ[252] ban hành, khác nhau tùy theo độ tuổi và giới tính.
Hợp chất cơ fluor tự nhiên đã được tìm thấy trong vi sinh vật và thực vật[66] nhưng không có ở động vật.[253] Loại phổ biến nhất là fluoroacetat, được sử dụng làm chất chống lại động vật ăn thực vật có trong ít nhất 40 loại thực vật ở châu Phi, Australia và Brasil.[214] Một số ví dụ khác bao gồm acid béo fluor hóa, fluoroacetone và 2-fluorocitrat.[253] Fluorinase, một enzyme liên kết fluor với carbon, được phát hiện trong vi khuẩn vào năm 2002.[254]
Độc tính[sửa | sửa mã nguồn]
Nguyên tố fluor cực độc đối với sinh vật sống. Ảnh hưởng đến con người bắt đầu tại nồng độ nhỏ hơn so với mức 50 ppm của hydro cyanide[256] và tương đương với mức của chlor:[257] hiện tượng mắt và hệ hô hấp bị tấy lên nặng cùng với tổn thương gan và thận xảy ra ở mức trên 25 ppm, mức độ nguy hiểm tức thời đối với fluor.[258] Mắt và mũi bị tổn thương nghiêm trọng tại 100 ppm,[258] và hít phải 1.000 ppm fluor sẽ gây tử vong trong vài phút,[259] so với mức 270 ppm của hydro cyanide.[260]
Acid hydrofluoric[sửa | sửa mã nguồn]

Acid hydrofluoric là một chất độc tiếp xúc với độc tính cao hơn so với nhiều acid mạnh như acid sulfuric dù đó là acid yếu: nó vẫn trung tính trong dung dịch nước và do đó thấm qua mô nhanh hơn, kể cả khi hít, nuốt phải hoặc tiếp xúc qua da, và ít nhất 9 công nhân Hoa Kỳ tử vong trong các vụ tai nạn như vậy từ năm 1984 đến năm 1994. Nó phản ứng với calci và magnesi trong máu dẫn đến hạ calci máu và tử vong qua rối loạn nhịp tim.[262] Sự hình thành calci fluoride không tan gây cảm giác đau mạnh,[263] và vết bỏng lớn hơn 160 cm² (25 in2) có thể gây ngộ độc toàn thân trầm trọng.[264]
Vết bỏng acid có thể không thấy được rõ ràng trong 8 giờ đối với HF nồng độ 50% và tối đa 24 giờ ở nồng độ thấp hơn, và ban đầu có thể không thấy đau do hydro fluoride ảnh hưởng đến hoạt động của các dây thần kinh. Nếu da đã bị tiếp xúc với HF, có thể làm giảm tổn thương bằng cách rửa dưới vòi nước trong 10–15 phút và loại bỏ quần áo dính acid.[265] Bước tiếp theo thường là dùng calci gluconat có chứa ion calci để chúng liên kết với fluor; vết bỏng trên da có thể được chữa bằng gel calci gluconat 2,5% hoặc dung dịch rửa chuyên dụng.[266][267][268] Trường hợp acid hydrofluoric đã hấp thụ vào cơ thể cần tiếp tục được chăm sóc y tế; calci gluconat có thể được tiêm hoặc truyền trong tĩnh mạch. Sử dụng calci chloride – một thuốc thử phổ biến trong phòng thí nghiệm – thay cho calci gluconat là bị cấm và có thể gây biến chứng nghiêm trọng. Một số trường hợp nặng có thể phải cắt bỏ hoặc cắt cụt những phần bị tổn thương.[264][269]
Ion fluoride[sửa | sửa mã nguồn]
Fluoride không tan là chất độc ở mức trung bình: 5–10 g natri fluoride, hoặc 32–64 mg ion fluoride trên mỗi kilôgam trọng lượng cơ thể là liều lượng gây chết người đối với người trưởng thành.[270] Liều lượng ở mức một phần năm so với liều gây chết có thể dẫn đến tác hại đối với sức khỏe,[271] và sử dụng quá liều về lâu dài có thể gây nhiễm độc fluor ở xương, căn bệnh ảnh hưởng đến hàng triệu người ở châu Phi và châu Á.[271][272] Fluoride được tiêm vào sẽ tạo thành acid hydrofluoric trong dạ dày, sau đó acid này được hấp thụ dễ dàng bởi ruột, tại đó nó xuyên qua màng tế bào, liên kết với calci và ảnh hưởng đến các enzyme khác nhau trước khi được thải ra ngoài qua bài tiết nước tiểu. Giới hạn nhiễm độc được xác định bằng cách xét nghiệm nước tiểu về khả năng đào thải ion fluoride của cơ thể.[271][273]
Từ trước đến nay, đa số ca nhiễm độc fluoride là do vô tình uống phải thuốc trừ sâu chứa fluoride vô cơ.[274] Đa số cuộc gọi đến các trung tâm chống độc để phản ánh trường hợp ngộ độc fluoride hiện nay đến từ việc nuốt phải kem đánh răng chứa fluoride.[271] Sự cố xảy ra trong thiết bị fluor hóa nước là một nguyên nhân khác: một vụ ngộ độc xảy ra ở bang Alaska, Hoa Kỳ vào tháng 5 năm 1992 làm 300 người bị ảnh hưởng, trong đó có một ca tử vong.[275] Mối nguy hại từ kem đánh răng càng lớn đối với trẻ nhỏ, và Trung tâm kiểm soát và phòng ngừa dịch bệnh Hoa Kỳ khuyến cáo nên giám sát trẻ dưới 6 tuổi đánh răng để chúng không nuốt phải kem đánh răng.[276] Một nghiên cứu cấp khu vực năm 1991 về ngộ độc fluor ở trẻ vị thành niên báo cáo tổng cộng 87 ca ngộ độc trong năm 1986, trong đó có một ca tử vong do uống phải thuốc trừ sâu. Đa số ca ngộ độc không có triệu chứng, nhưng khoảng 30% có triệu chứng đau dạ dày.[274] Một nghiên cứu trên toàn lãnh thổ Hoa Kỳ năm 1997 cũng có phát hiện tương tự: 80% số ca ngộ độc có liên quan đến trẻ em dưới 6 tuổi, và có một số ít ca chuyển nặng.[277]
Vấn đề môi trường[sửa | sửa mã nguồn]
Khí quyển[sửa | sửa mã nguồn]
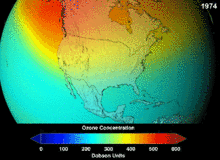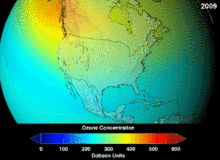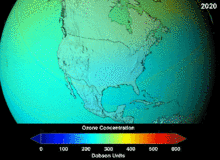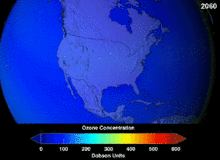
Nghị định thư Montreal ký vào năm 1987 đặt ra các quy định nghiêm ngặt về chlorofluorocarbon (CFC) và bromofluorocarbon dựa trên mức độ nguy cơ gây suy giảm tầng ozon (đo bằng chỉ số ODP). Tính trơ mạnh về mặt hóa học vốn đã giúp chúng từng được sử dụng rộng rãi cũng đồng nghĩa với việc chúng không thể bị phân hủy đến khi đi đến độ cao cao hơn, tại đó các nguyên tử chlor và brom tự do phản ứng với các phân tử ozon làm phá hủy tầng ozon theo cơ chế gốc.[279] Kể cả sau lệnh cấm và những dấu hiệu ban đầu cho thấy tính hiệu quả của nó, các nhà khoa học cảnh báo có thể sẽ phải mất nhiều thế hệ trước khi tầng ozon được phục hồi hoàn toàn.[280][281] Với ODP bằng một phần mười so với CFC, hydrochlorofluorocarbon (HCFC) là các chất thay thế ở thời điểm hiện tại,[282] và theo dự kiến đến năm 2030–2040 sẽ được thay bằng hydrofluorocarbon (HFC) không chứa chlor và có ODP bằng 0.[283] Năm 2007, thời hạn này được lùi lại sớm hơn sang năm 2020 tại các quốc gia phát triển;[284] Cơ quan Bảo vệ Môi trường Hoa Kỳ đã cấm sản xuất một loại HCFC và hạn chế sản xuất hai loại khác vào năm 2003.[283] Khí fluorocarbon thường là loại khí nhà kính với mức độ nguy cơ gây ấm lên toàn cầu (đo bằng chỉ số GWP) khoảng từ 100 đến 10.000; riêng lưu huỳnh hexafluoride là khoảng 20.000.[285] Một ngoại lệ là HFO-1234yf, thuộc một dạng chất làm lạnh mới có tên là hydrofluoroolefin (HFO) và đã thu hút sự quan tâm trên toàn cầu do có GWP chỉ bằng 4 so với con số 1.430 của chất làm lạnh phổ biến hiện nay HFC-134a.[198]
Tồn tại sinh học[sửa | sửa mã nguồn]
Các hợp chất hữu cơ của fluor thể hiện sự tồn tại lâu dài trong môi trường do độ bền của liên kết carbon–fluor. Acid perfluoroalkine (PFAA), những chất ít tan trong nước do các nhóm chức acid của chúng, được cho là chất ô nhiễm hữu cơ khó phân hủy;[287] acid perfluorooctansulfonic (PFOS) và acid perfluorooctanoic (PFOA) là những chất được nghiên cứu thường xuyên nhất.[288][289][290] PFAA đã được tìm thấy ở lượng nhỏ trên thế giới từ gấu Bắc Cực cho đến con người, còn PFOS và PFOA được cho là có trong sữa mẹ và máu của trẻ sơ sinh. Một bài báo năm 2013 cho thấy sự tương quan nhẹ giữa nồng độ PFAA trong nước ngầm và đất với hoạt động của con người; không có dấu hiệu rõ ràng cho thấy một chất hóa học chiếm ưu thế, và lượng PFOS lớn hơn có tương quan với lượng PFOA lớn hơn.[288][289][291] Trong cơ thể, PFAA liên kết với các protein như albumin huyết thanh; chúng thường tập trung trong gan và máu của người trước khi được thải ra ngoài qua thận. Thời gian ở lại trong cơ thể khác nhau rất nhiều ở các loài vật khác nhau, với chu kỳ bán rã là vài ngày ở động vật gặm nhấm và vài năm ở người.[288][289][292] Hiện tượng quá liều PFOS và PFOA gây ung thư và tử vong ở động vật gặm nhấm sơ sinh nhưng các nghiên cứu trên người vẫn chưa xác định được ảnh hưởng cụ thể tại mức độ nhiễm độc như hiện tại.[288][289][292]
Ghi chú[sửa | sửa mã nguồn]
- ^ Các tài liệu còn mâu thuẫn với nhau về bán kính của nguyên tử oxy, fluor và neon. Do đó sự so sánh chính xác là không thể có được.
- ^ α-Fluor có thứ tự sắp xếp phân tử đều đặn và là tinh thể rắn, nhưng các phân tử trong nó chuyển động không theo một hướng nhất định nào. Các phân tử trong β-fluor có vị trí cố định và có chuyển động quay ít hỗn loạn hơn. Để biết thêm về α-fluor, xem cấu trúc do Pauling xây dựng năm 1970.[42] Đối với thông tin thêm về khái niệm mất trật tự trong tinh thể, xem các bài báo khoa học được dẫn chứng ở đây.[43][44]
- ^ Tiếng lách cách có thể nghe thấy được; mẫu thử bị vỡ và tấm kính thử nghiệm bị thổi ra.
- ^ Tỷ số giữa mô men động lượng và mô men lưỡng cực từ được gọi là tỷ số hồi chuyển từ. "Một hạt nhân nào đó, với nhiều mục đích khác nhau, có thể liên tưởng là đang quay quanh một trục giống như Trái Đất hoặc một con quay. Về mặt tổng quát, chuyển động quay này cung cấp cho chúng mô men động lượng và mô men lưỡng cực từ; thứ nhất là do khối lượng của chúng, thứ hai là vì tất cả hoặc một phần điện tích của chúng có thể quay theo vật chất đó."[48]
- ^ Basilius Valentinus được cho là đã mô tả được fluorit vào cuối thế kỷ 15, nhưng vì bút tích của ông chỉ được tìm thấy 200 năm sau nên độ chính xác của nó là đáng ngờ.[71][72][73]
- ^ Hoặc có lẽ sớm nhất là từ sau năm 1670; Partington[77] và Weeks[76] đưa ra các mốc thời gian khác nhau.
- ^ Fl, kể từ năm 2012, được dùng làm ký hiệu của nguyên tố flerovi.
- ^ Davy, Gay-Lussac, Thénard cùng hai nhà hóa học Thomas và George Knox người Ireland bị thương tật. Nhà hóa học Paulin Louyet người Bỉ và Jérôme Nicklès người Pháp tử vong. Moissan cũng bị ngộ độc hydro fluoride nặng.[76][87]
- ^ Một thành tựu khác của Moissan được vinh danh là phát minh về lò hồ quang điện.
- ^ Fluor trong F
2 có trạng thái oxy hóa là 0 theo định nghĩa. Các ion không bền F−
2 và F−
3, vốn bị phân hủy ở nhiệt độ 40 K, có trạng thái oxy hóa trung gian;[98] F+
4 và một số ion liên quan khác được dự đoán là các ion bền.[99] - ^ Muối nửa bền bor và nitơ monofluoride có liên kết fluor bậc cao hơn, và một số phức chất kim loại sử dụng nó dưới dạng phối tử liên kết. Liên kết hydro là một khả năng khác.
- ^ ZrF
4 nóng chảy tại 932 °C (1710 °F),[112] HfF
4 thăng hoa tại 968 °C (1774 °F),[109] và UF
4 nóng chảy tại 1036 °C (1897 °F).[113] - ^ Đó là muối của molypden, tecneti, rutheni, rhodi, wolfram, rheni, osmi, iridi, platin (bạch kim), poloni, urani, neptuni, và plutoni.
- ^ Xem thêm phần giải thích của Clark.[131]
- ^ Carbon tetrafluoride được xem là chất hữu cơ, nhưng được liệt kê tại đây thay vì phần hóa học cơ fluor – tại đó có nhiều hợp chất carbon−fluor phức tạp hơn được xét – để so sánh với SiF
4 và GeF
4. - ^ Perfluorocarbon và fluorocarbon là hai từ đồng nghĩa trong IUPAC chỉ các phân tử chỉ chứa carbon và fluor, nhưng thông thường fluorocarbon còn có thể dùng để chỉ bất kỳ phân tử nào chứa carbon và fluor, và có thể có thêm các nguyên tố khác.
- ^ Thuật ngữ này (perfluorinated compound trong tiếng Anh) là chưa chính xác, và thuật ngữ vật chất perfluor hóa (perfluorinated substance) cũng được sử dụng.[162]
- ^ Thương hiệu của DuPont này đôi khi bị dùng sai để chỉ chất CFC, HFC, hoặc HCFC.
- ^ Người chăn nuôi cừu và gia súc tại Hoa Kỳ có thể sử dụng 1080 để ngăn chặn động vật ăn thịt, chẳng hạn như sói đồng cỏ.
Tham khảo[sửa | sửa mã nguồn]
Chú thích[sửa | sửa mã nguồn]
- ^ CIAAW 2021.
- ^ a b c d e f Jaccaud và đồng nghiệp 2000, tr. 381.
- ^ a b c d Haynes 2011, tr. 4.121.
- ^ a b c d e Jaccaud và đồng nghiệp 2000, tr. 382.
- ^ a b c Compressed Gas Association 1999, tr. 365.
- ^ a b c Dean 1999, tr. 4.6.
- ^ Dean 1999, tr. 4.35.
- ^ Matsui 2006, tr. 257.
- ^ Yaws & Braker 2001, tr. 385.
- ^ Mackay, Mackay & Henderson 2002, tr. 72.
- ^ Cheng và đồng nghiệp 1999.
- ^ Chisté & Bé 2011.
- ^ Dean 1999, tr. 564.
- ^ Lide 2004, tr. 10.137–10.138.
- ^ Moore, Stanitski & Jurs 2010, tr. 156.
- ^ Cordero và đồng nghiệp 2008.
- ^ Pyykkö & Atsumi 2009.
- ^ a b Greenwood & Earnshaw 1998, tr. 804.
- ^ Macomber 1996, tr. 230
- ^ Nelson 1947.
- ^ Lidin, Molochko & Andreeva 2000, tr. 442–455.
- ^ a b Wiberg, Wiberg & Holleman 2001, tr. 404.
- ^ Patnaik 2007, tr. 472.
- ^ Aigueperse và đồng nghiệp 2000, tr. 400.
- ^ Greenwood & Earnshaw 1998, tr. 76, 804.
- ^ Kuriakose & Margrave 1965.
- ^ Hasegawa và đồng nghiệp 2007.
- ^ Lagow 1970, tr. 64–78.
- ^ Lidin, Molochko & Andreeva 2000, tr. 252.
- ^ Tanner Industries 2011.
- ^ Morrow, Perry & Cohen 1959.
- ^ Emeléus & Sharpe 1974, tr. 111.
- ^ Wiberg, Wiberg & Holleman 2001, tr. 457.
- ^ Brantley 1949, tr. 26.
- ^ Jaccaud và đồng nghiệp 2000, tr. 383.
- ^ Pitzer 1975.
- ^ a b Khriachtchev và đồng nghiệp 2000.
- ^ Burdon, Emson & Edwards 1987.
- ^ Lide 2004, tr. 4.12.
- ^ a b Dean 1999, tr. 523.
- ^ Pauling, Keaveny & Robinson 1970.
- ^ Bürgi 2000.
- ^ Müller 2009.
- ^ a b Young 1975, tr. 10.
- ^ a b Barrett, Meyer & Wasserman 1967.
- ^ National Nuclear Data Center & NuDat 2.1, Fluorine-19.
- ^ Vigoureux 1961.
- ^ Meusinger, Chippendale & Fairhurst 2012, tr. 752, 754.
- ^ Warner & Harrison 1993, bảng 1.9, mục 1.4.5.2
- ^ a b National Nuclear Data Center & NuDat 2.1.
- ^ NUBASE 2016, tr. 030001-23—030001-27.
- ^ NUBASE 2016, tr. 030001-24, 030001-26.
- ^ Cameron 1973.
- ^ a b c Croswell 2003.
- ^ Clayton 2003, tr. 101–104.
- ^ Renda và đồng nghiệp 2004.
- ^ a b Jaccaud và đồng nghiệp 2000, tr. 384.
- ^ Schulze-Makuch & Irwin 2008, tr. 121.
- ^ Haxel, Hedrick & Orris 2005.
- ^ a b c d e Greenwood & Earnshaw 1998, tr. 795.
- ^ a b Norwood & Fohs 1907, tr. 52.
- ^ a b c d e f g h i j k l m n Villalba, Ayres & Schroder 2008.
- ^ Kelly & Miller 2005.
- ^ Lusty và đồng nghiệp 2008.
- ^ a b Gribble 2002.
- ^ Richter, Hahn & Fuchs 2001, tr. 3.
- ^ a b Schmedt, Mangstl & Kraus 2012.
- ^ Greenwood & Earnshaw 1998, tr. 790.
- ^ Senning 2007, tr. 149.
- ^ Stillman 1912.
- ^ Principe 2012, tr. 140, 145.
- ^ Agricola, Hoover & Hoover 1912, phần chú thích và bình luận, tr. xxx, 38, 409, 430, 461, 608.
- ^ Greenwood & Earnshaw 1998, tr. 109.
- ^ Agricola, Hoover & Hoover 1912, lời nói đầu, tr. 380–381.
- ^ a b c d e Weeks 1932.
- ^ Partington 1923.
- ^ Marggraf 1770.
- ^ a b c d e f g h Kirsch 2004, tr. 3–10.
- ^ Scheele 1771.
- ^ Ampère 1816.
- ^ Ampère 1812.
- ^ Davy 1813, tr. 278.
- ^ Tressaud 2019, tr. 3.
- ^ Banks 1986, tr. 11.
- ^ a b Storer 1864, tr. 278–280.
- ^ a b c d e Toon 2011.
- ^ a b Asimov 1966, tr. 162.
- ^ Greenwood & Earnshaw 1998, tr. 789–791.
- ^ Moissan 1886.
- ^ Viel & Goldwhite 1993, tr. 35.
- ^ a b c d Okazoe 2009.
- ^ a b Hounshell & Smith 1988, tr. 156–157.
- ^ DuPont 2013a.
- ^ Meyer 1977, tr. 111.
- ^ Kirsch 2004, tr. 60–66.
- ^ Riedel & Kaupp 2009.
- ^ Wiberg, Wiberg & Holleman 2001, tr. 422.
- ^ Schlöder & Riedel 2012.
- ^ Harbison 2002.
- ^ Edwards 1994, tr. 515.
- ^ Katakuse và đồng nghiệp 1999, tr. 267.
- ^ a b Aigueperse và đồng nghiệp 2000, tr. 420–422.
- ^ Walsh 2009, tr. 99–102, 118–119.
- ^ Emeléus & Sharpe 1983, tr. 89–97.
- ^ Babel & Tressaud 1985, tr. 91–96.
- ^ Einstein và đồng nghiệp 1967.
- ^ Brown và đồng nghiệp 2005, tr. 144.
- ^ a b Perry 2011, tr. 193.
- ^ Kern và đồng nghiệp 1994.
- ^ Lide 2004, tr. 4.60, 4.76, 4.92, 4.96.
- ^ Lide 2004, tr. 4.96.
- ^ Lide 2004, tr. 4.92.
- ^ Greenwood & Earnshaw 1998, tr. 964.
- ^ Becker & Müller 1990.
- ^ Greenwood & Earnshaw 1998, tr. 990.
- ^ Lide 2004, tr. 4.72, 4.91, 4.93.
- ^ a b Greenwood & Earnshaw 1998, tr. 561–563.
- ^ Emeléus & Sharpe 1983, tr. 256–277.
- ^ Mackay, Mackay & Henderson 2002, tr. 355–356.
- ^ Greenwood & Earnshaw 1998, (nhiều trang, theo kim loại ở các chương tương ứng).
- ^ Lide 2004, tr. 4.71, 4.78, 4.92.
- ^ Drews và đồng nghiệp 2006.
- ^ Greenwood & Earnshaw 1998, tr. 819.
- ^ Bartlett 1962.
- ^ Pauling 1960, tr. 454–464.
- ^ Atkins & Jones 2007, tr. 184–185.
- ^ Emsley 1981.
- ^ Greenwood & Earnshaw 1998, tr. 812–816.
- ^ Wiberg, Wiberg & Holleman 2001, tr. 425.
- ^ Clark 2002.
- ^ Smith & Martell 1976, tr. 96.
- ^ Chambers & Holliday 1975, tr. 328–329.
- ^ Air Products and Chemicals 2004, tr. 1.
- ^ Noury, Silvi & Gillespie 2002.
- ^ Chang & Goldsby 2013, tr. 706.
- ^ Ellis 2001, tr. 69.
- ^ Aigueperse và đồng nghiệp 2000, tr. 423.
- ^ Wiberg, Wiberg & Holleman 2001, tr. 897.
- ^ Raghavan 1998, tr. 164–165.
- ^ Godfrey và đồng nghiệp 1998, tr. 98.
- ^ Aigueperse và đồng nghiệp 2000, tr. 432.
- ^ Murthy, Mehdi Ali & Ashok 1995, tr. 180–182, 206–208.
- ^ Greenwood & Earnshaw 1998, tr. 638–640, 683–689, 767–778.
- ^ Wiberg, Wiberg & Holleman 2001, tr. 435–436.
- ^ Greenwood & Earnshaw 1998, tr. 828–830.
- ^ Patnaik 2007, tr. 478–479.
- ^ Moeller, Bailar & Kleinberg 1980, tr. 236.
- ^ Wiberg, Wiberg & Holleman 2001, tr. 392–393.
- ^ Wiberg, Wiberg & Holleman 2001, tr. 395–397, 400.
- ^ Lewars 2008, tr. 68.
- ^ Pitzer 1993, tr. 111.
- ^ Lewars 2008, tr. 67.
- ^ a b Bihary, Chaban & Gerber 2002.
- ^ Lewars 2008, tr. 71.
- ^ Hoogers 2002, tr. 4–12.
- ^ O'Hagan 2008.
- ^ Siegemund và đồng nghiệp 2005, tr. 444.
- ^ Sandford 2000, tr. 455.
- ^ Siegemund và đồng nghiệp 2005, tr. 451–452.
- ^ Barbee, McCormack & Vartanian 2000, tr. 116.
- ^ Posner và đồng nghiệp 2013, tr. 187–190.
- ^ a b Posner 2011, tr. 27.
- ^ Salager 2002, tr. 45.
- ^ a b Carlson & Schmiegel 2000, tr. 3.
- ^ a b Carlson & Schmiegel 2000, tr. 3–4.
- ^ Rhoades 2008, tr. 2.
- ^ Okada và đồng nghiệp 1998.
- ^ Carlson & Schmiegel 2000, tr. 4.
- ^ Jaccaud và đồng nghiệp 2000, tr. 386.
- ^ a b Jaccaud và đồng nghiệp 2000, tr. 384–385.
- ^ Greenwood & Earnshaw 1998, tr. 796–797.
- ^ a b Jaccaud và đồng nghiệp 2000, tr. 390–391.
- ^ Shriver & Atkins 2010, tr. 427.
- ^ Greenwood & Earnshaw 1998, tr. 821.
- ^ Tressaud 2019, tr. 48–49.
- ^ Christe 1986.
- ^ Christe Research Group n.d.
- ^ Carey 2008, tr. 173.
- ^ Miller 2003b.
- ^ PRWeb 2012.
- ^ Bombourg 2012.
- ^ TMR 2013.
- ^ Fulton & Miller 2006, tr. 471.
- ^ a b Jaccaud và đồng nghiệp 2000, tr. 392.
- ^ Aigueperse và đồng nghiệp 2000, tr. 430.
- ^ Jaccaud và đồng nghiệp 2000, tr. 391–392.
- ^ El-Kareh 1994, tr. 317.
- ^ Arana và đồng nghiệp 2007.
- ^ Miller 2003a.
- ^ Energetics, Inc. 1997, tr. 41, 50.
- ^ Aigueperse và đồng nghiệp 2000, tr. 428.
- ^ Willey 2007, tr. 113.
- ^ PRWeb 2010.
- ^ a b c Renner 2006.
- ^ Green và đồng nghiệp 1994, tr. 91–93.
- ^ DuPont 2013b.
- ^ a b Walter 2013.
- ^ a b Buznik 2009.
- ^ PRWeb 2013.
- ^ a b c d e Martin 2007, tr. 187–194.
- ^ DeBergalis 2004.
- ^ Grot 2011, tr. 1–10.
- ^ Ramkumar 2012, tr. 567.
- ^ Burney 1999, tr. 111.
- ^ Slye 2012, tr. 10.
- ^ Kissa 2001, tr. 516–551.
- ^ Ullmann 2008, tr. 538, 543–547.
- ^ ICIS 2006.
- ^ a b Theodoridis 2006.
- ^ EPA 1996.
- ^ DG Environment 2007.
- ^ Beasley 2002.
- ^ a b Proudfoot, Bradberry & Vale 2006.
- ^ Eisler 1995.
- ^ Pizzo 2007.
- ^ CDC 2001.
- ^ Ripa 1993.
- ^ a b Cheng, Chalmers & Sheldon 2007.
- ^ NHMRC 2007; xem tóm tắt trong Yeung 2008.
- ^ Marya 2011, tr. 343.
- ^ Armfield 2007.
- ^ a b Baelum, Sheiham & Burt 2008, tr. 518.
- ^ Cracher 2012, tr. 12.
- ^ Emsley 2011, tr. 178.
- ^ Johnson 2011.
- ^ a b Swinson 2005.
- ^ Hagmann 2008.
- ^ Mitchell 2004, tr. 37–39.
- ^ Preskorn 1996, chương 2.
- ^ Werner và đồng nghiệp 2011.
- ^ Brody 2012.
- ^ Nelson và đồng nghiệp 2007.
- ^ King, Malone & Lilley 2000.
- ^ Parente 2001, tr. 40.
- ^ Raj & Erdine 2012, tr. 58.
- ^ Filler & Saha 2009.
- ^ Bégué & Bonnet-Delpon 2008, tr. 335–336.
- ^ a b Schmitz và đồng nghiệp 2000.
- ^ Bustamante & Pedersen 1977.
- ^ Alavi & Huang 2007, tr. 41.
- ^ Gabriel và đồng nghiệp 1996.
- ^ Sarkar 2008.
- ^ Schimmeyer 2002.
- ^ Davis 2006.
- ^ Gains 1998.
- ^ Taber 1999.
- ^ Shaffer, Wolfson & Clark 1992, tr. 102.
- ^ Kacmarek và đồng nghiệp 2006.
- ^ Nielsen 2009.
- ^ Olivares & Uauy 2004.
- ^ Institute of Medicine, National Academies 2011.
- ^ a b Murphy, Schaffrath & O'Hagan 2003.
- ^ O'Hagan và đồng nghiệp 2002.
- ^ National Oceanic and Atmospheric Administration.
- ^ The National Institute for Occupational Safety and Health 1994a.
- ^ The National Institute for Occupational Safety and Health 1994b.
- ^ a b Keplinger & Suissa 1968.
- ^ Emsley 2011, tr. 179.
- ^ Biller 2007, tr. 939.
- ^ Eaton 1997.
- ^ Blodgett, Suruda & Crouch 2001.
- ^ Hoffman và đồng nghiệp 2007, tr. 1333.
- ^ a b HSM 2006.
- ^ Fischman 2001, tr. 458–459.
- ^ El Saadi và đồng nghiệp 1989.
- ^ Roblin và đồng nghiệp 2006.
- ^ Hultén và đồng nghiệp 2004.
- ^ Zorich 1991, tr. 182–183.
- ^ Liteplo và đồng nghiệp 2002, tr. 100.
- ^ a b c d Shin & Silverberg 2013.
- ^ Reddy 2009.
- ^ Baez, Baez & Marthaler 2000.
- ^ a b Augenstein và đồng nghiệp 1991.
- ^ Gessner và đồng nghiệp 1994.
- ^ CDC 2013.
- ^ Shulman & Wells 1997.
- ^ Beck và đồng nghiệp 2011.
- ^ Aucamp & Björn 2010, tr. 4–6, 41, 46–47.
- ^ Crow 2011.
- ^ Barry & Phillips 2006.
- ^ EPA 2013a.
- ^ a b EPA 2013b.
- ^ McCoy 2007.
- ^ Forster và đồng nghiệp 2007, tr. 212–213.
- ^ Schwarcz 2004, tr. 37.
- ^ Giesy & Kannan 2002.
- ^ a b c d Steenland, Fletcher & Savitz 2010.
- ^ a b c d Betts 2007.
- ^ EPA 2012.
- ^ Zareitalabad và đồng nghiệp 2013.
- ^ a b Lau và đồng nghiệp 2007.
Thư mục[sửa | sửa mã nguồn]
- Agricola, Georgius; Hoover, Herbert Clark; Hoover, Lou Henry (1912). De Re Metallica. London: The Mining Magazine.
- Aigueperse, J.; Mollard, P.; Devilliers, D.; Chemla, M.; Faron, R.; Romano, R. E.; Cue, J. P. (2000). “Fluorine Compounds, Inorganic”. Trong Ullmann, Franz (biên tập). Ullmann's Encyclopedia of Industrial Chemistry. 15. Weinheim: Wiley-VCH. tr. 397–441. doi:10.1002/14356007. ISBN 3527306730.
- Air Products and Chemicals (2004). “Safetygram #39 Chlorine Trifluoride” (PDF). Air Products and Chemicals. Bản gốc (PDF) lưu trữ ngày 18 tháng 3 năm 2006. Truy cập ngày 10 tháng 2 năm 2021.
- Alavi, Abbas; Huang, Steve S. (2007). “Positron Emission Tomography in Medicine: An Overview”. Trong Hayat, M. A. (biên tập). Cancer Imaging, Volume 1: Lung and Breast Carcinomas. Burlington: Academic Press. tr. 39–44. ISBN 978-0-12-370468-9.
- Ampère, André-Marie (ngày 26 tháng 8 năm 1812). “231. Ampère à Humphry Davy”. Trong de Launay, Louis (biên tập). Correspondance du grand Ampère (bằng tiếng Pháp). II. Paris: Gauthier-Villars. tr. 414–417.
- Ampère, André-Marie (1816). “Suite d'une classification naturelle pour les corps simples”. Annales de chimie et de physique (bằng tiếng Pháp). 2: 1–5.
- Arana, L. R.; Mas, N.; Schmidt, R.; Franz, A. J.; Schmidt, M. A.; Jensen, K. F. (2007). “Isotropic Etching of Silicon in Fluorine Gas for MEMS Micromachining”. Journal of Micromechanics and Microengineering. 17 (2): 384. Bibcode:2007JMiMi..17..384A. doi:10.1088/0960-1317/17/2/026. S2CID 135708022.
- Armfield, J. M. (2007). “When Public Action Undermines Public Health: A Critical Examination of Antifluoridationist Literature”. Australia and New Zealand Health Policy. 4: 25. doi:10.1186/1743-8462-4-25. PMC 2222595. PMID 18067684.
- Asimov, Isaac (1966). The Noble Gases. New York: Basic Books. ISBN 978-0-465-05129-8.
- Atkins, Peter; Jones, Loretta (2007). Chemical Principles: The Quest for Insight (ấn bản 4). New York: W. H. Freeman. ISBN 978-1-4292-0965-6.
- Aucamp, Pieter J.; Björn, Lars Olof (2010). “Questions and Answers about the Environmental Effects of the Ozone Layer Depletion and Climate Change: 2010 Update” (PDF). United Nations Environmental Programme. Bản gốc (PDF) lưu trữ ngày 3 tháng 9 năm 2013. Truy cập ngày 10 tháng 2 năm 2021.
- Audi, G.; Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S. (2017). “The NUBASE2016 evaluation of nuclear properties” (PDF). Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001. Lưu trữ (PDF) bản gốc ngày 16 tháng 3 năm 2018. Truy cập ngày 11 tháng 2 năm 2021.
- Augenstein, W. L.; và đồng nghiệp (1991). “Fluoride Ingestion in Children: A Review of 87 cases”. Pediatrics. 88 (5): 907–912. doi:10.1542/peds.88.5.907. PMID 1945630. S2CID 22106466.
- Babel, Dietrich; Tressaud, Alain (1985). “Crystal Chemistry of Fluorides”. Trong Hagenmuller, Paul (biên tập). Inorganic Solid Fluorides: Chemistry And Physics. Orlando: Academic Press. tr. 78–203. ISBN 978-0-12-412490-5.
- Baelum, Vibeke; Sheiham, Aubrey; Burt, Brian (2008). “Caries Control for Populations”. Trong Fejerskov, Ole; Kidd, Edwina (biên tập). Dental Caries: The Disease and Its Clinical Management (ấn bản 2). Oxford: Blackwell Munksgaard. tr. 505–526. ISBN 978-1-4051-3889-5.
- Baez, Ramon J.; Baez, Martha X.; Marthaler, Thomas M. (2000). “Urinary Fluoride Excretion by Children 4–6 Years Old in a South Texas Community”. Revista Panamericana de Salud Pública. 7 (4): 242–248. doi:10.1590/S1020-49892000000400005.
- Banks, R. E. (1986). “Journal of Fluorine Chemistry”. Journal of Fluorine Chemistry. 33 (1–4): 3–26. doi:10.1016/S0022-1139(00)85269-0.
- Barbee, K.; McCormack, K.; Vartanian, V. (2000). “EHS Concerns with Ozonated Water Spray Processing”. Trong Mendicino, L. (biên tập). Environmental Issues in the Electronics and Semiconductor Industries. Pennington, NJ: The Electrochemical Society. tr. 108–121. ISBN 978-1-56677-230-3.
- Barrett, C. S.; Meyer, L.; Wasserman, J. (1967). “Argon—Fluorine Phase Diagram”. The Journal of Chemical Physics. 47 (2): 740–743. Bibcode:1967JChPh..47..740B. doi:10.1063/1.1711946.
- Barry, Patrick L.; Phillips, Tony (ngày 26 tháng 5 năm 2006). “Good News and a Puzzle”. National Aeronautics and Space Administration. Lưu trữ bản gốc ngày 27 tháng 5 năm 2010. Truy cập ngày 10 tháng 2 năm 2021.
- Bartlett, N. (1962). “Xenon Hexafluoroplatinate (V) Xe+[PtF6]−”. Proceedings of the Chemical Society (6): 218. doi:10.1039/PS9620000197.
- Beasley, Michael (tháng 8 năm 2002). Guidelines for the safe use of sodium fluoroacetate (1080) (PDF). Wellington: Occupational Safety & Health Service, Department of Labour (New Zealand). ISBN 0-477-03664-3. Bản gốc (PDF) lưu trữ ngày 11 tháng 11 năm 2013. Truy cập ngày 10 tháng 2 năm 2021.
- Beck, Jefferson; Newman, Paul; Schindler, Trent L.; Perkins, Lori (2011). “What Would have Happened to the Ozone Layer if Chlorofluorocarbons (CFCs) had not been Regulated?”. National Aeronautics and Space Administration. Bản gốc lưu trữ ngày 4 tháng 8 năm 2020. Truy cập ngày 10 tháng 2 năm 2021.
- Becker, S.; Müller, B. G. (1990). “Vanadium Tetrafluoride”. Angewandte Chemie International Edition in English. 29 (4): 406. doi:10.1002/anie.199004061.
- Bégué, Jean-Pierre; Bonnet-Delpon, Danièle (2008). Bioorganic and Medicinal Chemistry of Fluorine. Hoboken: John Wiley & Sons. ISBN 978-0-470-27830-7.
- Betts, K. S. (2007). “Perfluoroalkyl Acids: What is the Evidence Telling Us?”. Environmental Health Perspectives. 115 (5): A250–A256. doi:10.1289/ehp.115-a250. PMC 1867999. PMID 17520044.
- Bihary, Z.; Chaban, G. M.; Gerber, R. B. (2002). “Stability of a Chemically Bound Helium Compound in High-pressure Solid Helium”. The Journal of Chemical Physics. 117 (11): 5105–5108. Bibcode:2002JChPh.117.5105B. doi:10.1063/1.1506150.
- Biller, José (2007). Interface of Neurology and Internal Medicine . Philadelphia: Lippincott Williams & Wilkins. ISBN 0-7817-7906-5.
- Blodgett, D. W.; Suruda, A. J.; Crouch, B. I. (2001). “Fatal Unintentional Occupational Poisonings by Hydrofluoric Acid in the U.S” (PDF). American Journal of Industrial Medicine. 40 (2): 215–220. doi:10.1002/ajim.1090. PMID 11494350. Bản gốc (PDF) lưu trữ ngày 6 tháng 3 năm 2015. Truy cập ngày 11 tháng 2 năm 2021.
- Bombourg, Nicolas (ngày 4 tháng 7 năm 2012). “World Fluorochemicals Market, Freedonia”. Reporterlinker. Lưu trữ bản gốc ngày 2 tháng 8 năm 2013. Truy cập ngày 10 tháng 2 năm 2021.
- Bộ Thực phẩm và Dinh dưỡng, Viện Y học, Viện Hàn lâm Khoa học Quốc gia Hoa Kỳ (2011). “Dietary Reference Intakes (DRIs): Recommended Dietary Allowances and Adequate Intakes, Elements” (PDF). Bản gốc (PDF) lưu trữ ngày 13 tháng 11 năm 2018. Truy cập ngày 24 tháng 2 năm 2021.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- Brantley, L. R. (1949). Squires, Roy; Clarke, Arthur C. (biên tập). “Fluorine”. Pacific Rockets: Journal of the Pacific Rocket Society. South Pasadena: Sawyer Publishing/Pacific Rocket Society Historical Library. 3 (1): 11–18. ISBN 978-0-9794418-5-1.
- Brody, Jane E. (ngày 10 tháng 9 năm 2012). “Popular Antibiodics May Carry Serious Side Effects”. The New York Times Well Blog. Truy cập ngày 10 tháng 2 năm 2021.
- Brown, Paul L.; Mompean, Federico J.; Perrone, Jane; Illemassène, Myriam (2005). Chemical Thermodynamics of Zirconium. Amsterdam: Elsevier B. V. ISBN 978-0-444-51803-3.
- Burdon, J.; Emson, B.; Edwards, A. J. (1987). “Is Fluorine Gas Really Yellow?”. Journal of Fluorine Chemistry. 34 (3–4): 471. doi:10.1016/S0022-1139(00)85188-X.
- Bürgi, H. B. (2000). “Motion and Disorder in Crystal Structure Analysis: Measuring and Distinguishing them”. Annual Review of Physical Chemistry. 51: 275–296. Bibcode:2000ARPC...51..275B. doi:10.1146/annurev.physchem.51.1.275. PMID 11031283.
- Burney, H. (1999). “Past, Present and Future of the Chlor-Alkali Industry”. Trong Burney, H. S.; Furuya, N.; Hine, F.; Ota, K.-I. (biên tập). Chlor-Alkali and Chlorate Technology: R. B. MacMullin Memorial Symposium. Pennington: The Electrochemical Society. tr. 105–126. ISBN 1-56677-244-3.
- Bustamante, E.; Pedersen, P. L. (1977). “High Aerobic Glycolysis of Rat Hepatoma Cells in Culture: Role of Mitochondrial Hexokinase”. Proceedings of the National Academy of Sciences. 74 (9): 3735–3739. Bibcode:1977PNAS...74.3735B. doi:10.1073/pnas.74.9.3735. PMC 431708. PMID 198801.
- Buznik, V. M. (2009). “Fluoropolymer Chemistry in Russia: Current Situation and Prospects”. Russian Journal of General Chemistry. 79 (3): 520–526. doi:10.1134/S1070363209030335.
- Cameron, A. G. W. (1973). “Abundance of the Elements in the Solar System” (PDF). Space Science Review. 15: 121–146. Bibcode:1973SSRv...15..121C. doi:10.1007/BF00172440. Bản gốc (PDF) lưu trữ ngày 21 tháng 10 năm 2011.
- Carey, Charles W. (2008). African Americans in Science. Santa Barbara: ABC-CLIO. ISBN 978-1-85109-998-6.
- Carlson, D. P.; Schmiegel, W. (2000). “Fluoropolymers, Organic”. Trong Ullmann, Franz (biên tập). Ullmann's Encyclopedia of Industrial Chemistry. 15. Weinheim: Wiley-VCH. tr. 495–533. doi:10.1002/14356007.a11_393. ISBN 3527306730.
- Chambers, C.; Holliday, A. K. (1975). Modern Inorganic Chemistry: An Intermediate Text (PDF). London: Butterworth & Co. ISBN 978-0-408-70663-6. Bản gốc (PDF) lưu trữ ngày 18 tháng 10 năm 2007. Truy cập ngày 11 tháng 2 năm 2021.
- Chang, Raymond; Goldsby, Kenneth A. (2013). Chemistry (ấn bản 11). New York: McGraw-Hill. ISBN 978-0-07-131787-0.
- Cheng, H.; Fowler, D. E.; Henderson, P. B.; Hobbs, J. P.; Pascolini, M. R. (1999). “On the Magnetic Susceptibility of Fluorine”. The Journal of Physical Chemistry A. 103 (15): 2861–2866. doi:10.1021/jp9844720.
- Cheng, K. K.; Chalmers, I.; Sheldon, T. A. (2007). “Adding Fluoride to Water Supplies” (PDF). BMJ. 335 (7622): 699–702. doi:10.1136/bmj.39318.562951.BE. PMC 2001050. PMID 17916854. Bản gốc (PDF) lưu trữ ngày 3 tháng 3 năm 2016. Truy cập ngày 11 tháng 2 năm 2021.
- Chisté, V.; Bé, M. M. (2011). “F-18”. Trong Bé, M. M.; Coursol, N.; Duchemin, B.; Lagoutine, F.; và đồng nghiệp (biên tập). Table de radionucléides (PDF) (Bản báo cáo). CEA (Commissariat à l'énergie atomique et aux énergies alternatives), LIST, LNE-LNHB (Laboratoire National Henri Becquerel/Commissariat à l'Energie Atomique). Bản gốc (PDF) lưu trữ ngày 11 tháng 8 năm 2020. Truy cập ngày 10 tháng 2 năm 2021.
- Christe, Karl O. (1986). “Chemical Synthesis of Elemental Fluorine”. Inorganic Chemistry. 25 (21): 3721–3722. doi:10.1021/ic00241a001.
- Christe Research Group (n.d.). “Chemical Synthesis of Elemental Fluorine:”. Bản gốc lưu trữ ngày 4 tháng 3 năm 2016. Truy cập ngày 10 tháng 2 năm 2021.
- Clark, Jim (2002). “The Acidity of the Hydrogen Halides”. chemguide.co.uk. Truy cập ngày 10 tháng 2 năm 2021.
- Clayton, Donald (2003). Handbook of Isotopes in the Cosmos: Hydrogen to Gallium. New York: Cambridge University Press. ISBN 978-0-521-82381-4.
- Compressed Gas Association (1999). Handbook of Compressed Gases (ấn bản 4). Boston: Kluwer Academic Publishers. ISBN 978-0-412-78230-5.
- Cơ quan Bảo vệ Môi trường Hoa Kỳ (1996). “R.E.D. Facts: Trifluralin” (PDF). Truy cập ngày 10 tháng 2 năm 2021.
- Cơ quan Bảo vệ Môi trường Hoa Kỳ (2012). “Emerging Contaminants – Perfluorooctane Sulfonate (PFOS) and Perfluorooctanoic Acid (PFOA)” (PDF). Bản gốc (PDF) lưu trữ ngày 29 tháng 10 năm 2013. Truy cập ngày 10 tháng 2 năm 2021.
- Cơ quan Bảo vệ Môi trường Hoa Kỳ (2013). “Class I Ozone-depleting Substances”. Bản gốc lưu trữ ngày 10 tháng 12 năm 2010. Truy cập ngày 10 tháng 2 năm 2021.
- Cơ quan Bảo vệ Môi trường Hoa Kỳ (2013). “Phaseout of HCFCs (Class II Ozone-Depleting Substances)”. Truy cập ngày 10 tháng 2 năm 2021.
- Cơ quan Quản lý Khí quyển và Đại dương Quốc gia Hoa Kỳ. “UN/NA 1045 (United Nations/North America Fluorine Data Sheet)”. Truy cập ngày 10 tháng 2 năm 2021.
- Cordero, B.; Gómez, V.; Platero-Prats, A. E.; Revés, M.; Echeverría, J.; Cremades, E.; Barragán, F.; Alvarez, S. (2008). “Covalent Radii Revisited”. Dalton Transactions (21): 2832–2838. doi:10.1039/b801115j.
- Cracher, Connie M. (2012). “Current Concepts in Preventive Dentistry” (PDF). dentalcare.com. Bản gốc (PDF) lưu trữ ngày 14 tháng 10 năm 2013. Truy cập ngày 10 tháng 2 năm 2021.
- Croswell, Ken (tháng 9 năm 2003). “Fluorine: An element–ary Mystery”. Sky and Telescope. Truy cập ngày 10 tháng 2 năm 2021.
- Mitchell Crow, James (2011). “First signs of ozone-hole recovery spotted”. Nature. doi:10.1038/news.2011.293.
- Davis, Nicole. “Better than blood”. Popular Science (tháng 11 năm 2006). Bản gốc lưu trữ ngày 4 tháng 6 năm 2011. Truy cập ngày 10 tháng 2 năm 2021.
- Davy, Humphry (1813). “Some experiments and observations on the substances produced in different chemical processes on fluor spar”. Philosophical Transactions of the Royal Society. 103: 263–279. doi:10.1098/rstl.1813.0034.
- Dean, John A. (1999). Lange's Handbook of Chemistry (ấn bản 15). New York: McGraw-Hill. ISBN 0-07-016190-9.
- Debergalis, Michael (2004). “Fluoropolymer films in the photovoltaic industry”. Journal of Fluorine Chemistry. 125 (8): 1255. doi:10.1016/j.jfluchem.2004.05.013.
- Drews, T.; Supeł, J.; Hagenbach, A.; Seppelt, K. (2006). “Solid State Molecular Structures of Transition Metal Hexafluorides”. Inorganic Chemistry. 45 (9): 3782–3788. doi:10.1021/ic052029f. PMID 16634614.
- DuPont (2013). “Freon”. Bản gốc lưu trữ ngày 21 tháng 2 năm 2015. Truy cập ngày 10 tháng 2 năm 2021.
- DuPont (2013). “Understanding the Refrigerant 'R' Nomenclature”. Lưu trữ bản gốc ngày 3 tháng 10 năm 2014. Truy cập ngày 10 tháng 2 năm 2021.
- Eaton, Charles (1997). “Figure hfl”. E-Hand.com: The Electronic Textbook of Hand Surgery. The Hand Center (former practice of Dr. Eaton). Truy cập ngày 10 tháng 2 năm 2021.
- Edwards, Philip Neil (1994). “Use of Fluorine in Chemotherapy”. Trong Banks, R. E.; Smart, B. E.; Tatlow, J. C. (biên tập). Organofluorine Chemistry: Principles and Commercial Applications. New York: Plenum Press. tr. 501–542. ISBN 978-0-306-44610-8.
- Einstein, F. W. B.; Rao, P. R.; Trotter, J.; Bartlett, N. (1967). “The Crystal Structure of Gold Trifluoride”. Journal of the Chemical Society A: Inorganic, Physical, Theoretical. 4: 478–482. doi:10.1039/J19670000478.
- Eisler, Ronald (1995). Sodium Monofluoroacetate (1080) Hazards to Fish, Wildlife and Invertebrates: A Synoptic Review (PDF) (Bản báo cáo). Patuxent Environmental Science Center (U.S. National Biological Service). Truy cập ngày 10 tháng 2 năm 2021.
- Ellis, Brian (2001). Scientific Essentialism. Cambridge: Cambridge University Press. ISBN 978-0-521-80094-5.
- El-Kareh, Badih (1994). Fundamentals of Semiconductor Processing Technology. Norwell and Dordrecht: Kluwer Academic Publishers. ISBN 978-0-7923-9534-8.
- El Saadi, M. S.; Hall, A. H.; Hall, P. K.; Riggs, B. S.; Augenstein, W. L.; Rumack, B. H. (1989). “Hydrofluoric Acid Dermal Exposure”. Veterinary and Human Toxicology. 31 (3): 243–247. PMID 2741315.
- Emeléus, H. J.; Sharpe, A. G. (1974). Advances in Inorganic Chemistry and Radiochemistry. 16. New York: Academic Press. ISBN 978-0-08-057865-1.
- Emeléus, H. J.; Sharpe, A. G. (1983). Advances in Inorganic Chemistry and Radiochemistry. 27. Academic Press. ISBN 0-12-023627-3.
- Emsley, John (1981). “The Hidden Strength of Hydrogen”. New Scientist. 91 (1264): 291–292. Bản gốc lưu trữ ngày 22 tháng 7 năm 2023. Truy cập ngày 11 tháng 2 năm 2021.
- Emsley, John (2011). Nature's Building Blocks: An A–Z Guide to the Elements (ấn bản 2). Oxford: Oxford University Press. ISBN 978-0-19-960563-7.
- Energetics, Inc. (1997). Energy and Environmental Profile of the U.S. Aluminum Industry (PDF) (Bản báo cáo). Lưu trữ (PDF) bản gốc ngày 31 tháng 10 năm 2013. Truy cập ngày 10 tháng 2 năm 2021.
- Filler, R.; Saha, R. (2009). “Fluorine in Medicinal Chemistry: A Century of Progress and a 60-year Retrospective of Selected Highlights” (PDF). Future Medicinal Chemistry. 1 (5): 777–791. doi:10.4155/fmc.09.65. PMID 21426080. Bản gốc (PDF) lưu trữ ngày 22 tháng 10 năm 2013.
- Fischman, Michael L. (2001). “Semiconductor Manufacturing Hazards”. Trong Sullivan, John B.; Krieger, Gary R. (biên tập). Clinical Environmental Health and Toxic Exposures (ấn bản 2). Philadelphia: Lippincott Williams & Wilkins. tr. 431–465. ISBN 978-0-683-08027-8.
- Forster, P.; Ramaswamy, V.; Artaxo, P.; Berntsen, T.; Betts, R.; Fahey, D. W.; Haywood, J.; Lean, J.; Lowe, D. C.; Myhre, G.; Nganga, J.; Prinn, R.; Raga, G.; Schulz, M.; Van Dorland, R. (2007). “Changes in Atmospheric Constituents and in Radiative Forcing”. Trong Solomon, S.; Manning, M.; Chen, Z.; Marquis, M.; Averyt, K. B.; Tignor, M.; Miller, H. L. (biên tập). Climate Change 2007: The Physical Science Basis. Contribution of Working Group I to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge: Cambridge University. tr. 129–234. ISBN 978-0-521-70596-7.
- Fulton, Robert B.; Miller, M. Michael (2006). “Fluorspar”. Trong Kogel, Jessica Elzea; Trivedi, Nikhil C.; Barker, James M.; Krukowski, Stanley T. (biên tập). Industrial Minerals & Rocks: Commodities, Markets, and Uses. Littleton: Society for Mining, Metallurgy, and Exploration (U.S.). tr. 461–473. ISBN 978-0-87335-233-8.
- Gabriel, J. L.; Miller Jr, T. F.; Wolfson, M. R.; Shaffer, T. H. (1996). “Quantitative Structure-Activity Relationships of Perfluorinated Hetero-Hydrocarbons as Potential Respiratory Media”. ASAIO Journal. 42 (6): 968–973. doi:10.1097/00002480-199642060-00009. PMID 8959271.
- Gains, Paul (ngày 18 tháng 10 năm 1998). “A New Threat in Blood Doping”. The New York Times. Truy cập ngày 10 tháng 2 năm 2021.
- Gessner, B. D.; Beller, M.; Middaugh, J. P.; Whitford, G. M. (1994). “Acute Fluoride Poisoning from a Public Water System”. New England Journal of Medicine. 330 (2): 95–99. doi:10.1056/NEJM199401133300203. PMID 8259189.
- Giesy, J. P.; Kannan, K. (2002). “Perfluorochemical Surfactants in the Environment”. Environmental Science & Technology. 36 (7): 146A–152A. doi:10.1021/es022253t. PMID 11999053.
- Godfrey, S. M.; McAuliffe, C. A.; Mackie, A. G.; Pritchard, R. G. (1998). “Inorganic Derivatives of the Elements”. Trong Norman, Nicholas C. (biên tập). Chemistry of Arsenic, Antimony and Bismuth. London: Blackie Academic & Professional. tr. 67–158. ISBN 978-0-7514-0389-3.
- Green, S. W.; Slinn, D. S. L.; Simpson, R. N. F.; Woytek, A. J. (1994). “Perfluorocarbon Fluids”. Trong Banks, R. E.; Smart, B. E.; Tatlow, J. C. (biên tập). Organofluorine Chemistry: Principles and Applications. New York: Plenum Press. tr. 89–119. ISBN 978-0-306-44610-8.
- Greenwood, N. N.; Earnshaw, A. (1998). Chemistry of the Elements (ấn bản 2). Oxford: Butterworth Heinemann. ISBN 0-7506-3365-4.
- Gribble, G. W. (2002). “Naturally Occuring Organofluorines”. Trong Neison, A. H. (biên tập). Organofluorines. The Handbook of Environmental Chemistry. 3N. Berlin: Springer. tr. 121–136. doi:10.1007/10721878_5. ISBN 3-540-42064-9.
- Grot, Walter (2011). Fluorinated Ionomers (ấn bản 2). Oxford and Waltham: Elsevier. ISBN 978-1-4377-4457-6.
- Hagmann, W. K. (2008). “The Many Roles for Fluorine in Medicinal Chemistry”. Journal of Medicinal Chemistry. 51 (15): 4359–4369. doi:10.1021/jm800219f. PMID 18570365.
- Harbison, G. S. (2002). “The Electric Dipole Polarity of the Ground and Low-lying Metastable Excited States of NF”. Journal of the American Chemical Society. 124 (3): 366–367. doi:10.1021/ja0159261. PMID 11792193.
- Hasegawa, Y.; Otani, R.; Yonezawa, S.; Takashima, M. (2007). “Reaction Between Carbon Dioxide and Elementary Fluorine”. Journal of Fluorine Chemistry. 128 (1): 17–28. doi:10.1016/j.jfluchem.2006.09.002. hdl:10098/1665. S2CID 95754841.
- Haxel, G. B.; Hedrick, J. B.; Orris, G. J. (2005). Stauffer, P. H.; Hendley II, J. W. (biên tập). Rare Earth Elements—Critical Resources for High Technology, Fact Sheet 087-02 (Bản báo cáo). U.S. Geological Survey. Truy cập ngày 10 tháng 2 năm 2021.
- Haynes, William M. biên tập (2011). Handbook of Chemistry and Physics (ấn bản 92). Boca Raton: CRC Press. ISBN 1-4398-5511-0.
- Hoffman, Robert; Nelson, Lewis; Howland, Mary; Lewin, Neal; Fluormenbaum, Neal; Goldfrank, Lewis (2007). Goldfrank's Manual of Toxicologic Emergencies. New York: McGraw-Hill Professional. ISBN 978-0-07-144310-4.
- Hội đồng y tế và y khoa quốc gia Australia (2007). “A Systematic Review of the Efficacy and Safety of Fluoridation, Part A: Review of Methodology and Results” (PDF). Canberra: Chính phủ Australia. ISBN 1-86496-421-9. Bản gốc (PDF) lưu trữ ngày 13 tháng 1 năm 2012. Truy cập ngày 10 tháng 2 năm 2021.
- Honeywell (2006). Recommended medical treatment for hydrofluoric acid exposure (PDF). Moristown: Honeywell International. Bản gốc (PDF) lưu trữ ngày 8 tháng 10 năm 2013. Truy cập ngày 10 tháng 2 năm 2021.
- Hoogers, G. (2002). “Fuel Cell Components and Their Impact on Performance”. Trong Hoogers, G. (biên tập). Fuel Cell Technology Handbook. Boca Raton: CRC Press. tr. 4–1–4–27. ISBN 0-8493-0877-1.
- Hounshell, David A.; Smith, John Kelly (1988). Science and Corporate Strategy: DuPont R & D, 1902–1980. Cambridge: Cambridge University Press. ISBN 0-521-32767-9.
- Hultén, P.; Höjer, J.; Ludwigs, U.; Janson, A. (2004). “Hexafluorine vs. Standard Decontamination to Reduce Systemic Toxicity After Dermal Exposure to Hydrofluoric Acid”. Clinical Toxicology. 42 (4): 355–361. doi:10.1081/CLT-120039541. PMID 15461243.
- ICIS (ngày 2 tháng 10 năm 2006). “Fluorine's Treasure Trove”. Reed Business Information. Lưu trữ bản gốc ngày 26 tháng 2 năm 2009. Truy cập ngày 10 tháng 2 năm 2021.
- Jaccaud, M.; Faron, R.; Devilliers, D.; Romano, R. (2000). “Fluorine”. Trong Ullmann, Franz (biên tập). Ullmann's Encyclopedia of Industrial Chemistry. 15. Weinheim: Wiley-VCH. tr. 381–395. doi:10.1002/14356007.a11_293. ISBN 3527306730.
- Johnson, Linda A. (ngày 28 tháng 12 năm 2011). “Against Odds, Lipitor Became World's Top Seller”. The Boston Globe. Lưu trữ bản gốc ngày 25 tháng 8 năm 2016. Truy cập ngày 10 tháng 2 năm 2021.
- Kacmarek, Robert M.; Wiedemann, Herbert P.; Lavin, Philip T.; Wedel, Mark K.; Tütüncü, Ahmet S.; Slutsky, Arthur S. (2006). “Partial Liquid Ventilation in Adult Patients with Acute Respiratory Distress Syndrome”. American Journal of Respiratory and Critical Care Medicine. 173 (8): 882. doi:10.1164/rccm.200508-1196OC. PMID 16254269.
- Katakuse, Itsuo; Ichihara, Toshio; Ito, Hiroyuki; Sakurai, Tohru; Matsuo, Takekiyo (1999). “SIMS Experiment”. Trong Arai, T.; Mihama, K.; Yamamoto, K.; Sugano, S. (biên tập). Mesoscopic Materials and Clusters: Their Physical and Chemical Properties. Tokyo: Kodansha. tr. 259–273. ISBN 4-06-208635-2.
- Kelly, T. D.; Miller, M. M. (2005). “Historical Fluorspar Statistics”. U.S. Geological Service. Lưu trữ bản gốc ngày 12 tháng 3 năm 2013. Truy cập ngày 10 tháng 2 năm 2021.
- Keplinger, M. L.; Suissa, L. W. (1968). “Toxicity of Fluorine Short-Term Inhalation”. American Industrial Hygiene Association Journal. 29 (1): 10–18. doi:10.1080/00028896809342975. PMID 5667185.
- Kern, S.; Hayward, J.; Roberts, S.; Richardson, J. W.; Rotella, F. J.; Soderholm, L.; Cort, B.; Tinkle, M.; West, M.; Hoisington, D.; Lander, G. A. (1994). “Temperature Variation of the Structural Parameters in Actinide Tetrafluorides”. The Journal of Chemical Physics. 101 (11): 9333–9337. Bibcode:1994JChPh.101.9333K. doi:10.1063/1.467963.
- Khriachtchev, L.; Pettersson, M.; Runeberg, N.; Lundell, J.; Räsänen, M. (2000). “A Stable Argon Compound”. Nature. 406 (6798): 874–876. doi:10.1038/35022551. PMID 10972285.
- King, D. E.; Malone, R.; Lilley, S. H. (2000). “New Classification and Update on the Quinolone Antibiodics”. American Family Physician. 61 (9): 2741–2748. PMID 10821154. Truy cập ngày 10 tháng 2 năm 2021.
- Kirsch, Peer (2004). Modern Fluoroorganic Chemistry: Synthesis, Reactivity, Applications. Weinheim: Wiley-VCH. ISBN 978-3-527-30691-6.
- Kissa, Erik (2001). Fluorinated Surfactants and Repellents (ấn bản 2). New York: Marcel Dekker. ISBN 978-0-8247-0472-8.
- Kuriakose, A. K.; Margrave, J. L. (1965). “Kinetics of the Reactions of Elemental Fluorine. IV. Fluorination of Graphite”. Journal of Physical Chemistry. 69 (8): 2772–2775. doi:10.1021/j100892a049.
- Lagow, R. J. (1970). The Reactions of Elemental Fluorine; A New Approach to Fluorine Chemistry (PDF) (PhD thesis, Rice University, TX). Ann Arbor: UMI.
- Lau, C.; Anitole, K.; Hodes, C.; Lai, D.; Pfahles-Hutchens, A.; Seed, J. (2007). “Perfluoroalkyl Acids: A Review of Monitoring and Toxicological Findings” (PDF). Toxicological Sciences. 99 (2): 366–394. doi:10.1093/toxsci/kfm128. PMID 17519394. Lưu trữ (PDF) bản gốc ngày 3 tháng 2 năm 2013. Truy cập ngày 11 tháng 2 năm 2021.
- Lewars, Errol G. (2008). Modeling Marvels: Computational Anticipation of Novel Molecules. Dordrecht: Springer. ISBN 1-4020-6972-3.
- Lide, David R. (2004). Handbook of Chemistry and Physics (ấn bản 84). Boca Raton: CRC Press. ISBN 0-8493-0566-7.
- Lidin, R.; Molochko, V. A.; Andreeva, L. L. (2000). Химические свойства неорганических веществ [Chemical Properties of Inorganic Substances] (bằng tiếng Nga). Moscow: Khimiya. ISBN 5-7245-1163-0.
- Liteplo, R.; Gomes, R.; Howe, P.; Malcolm, H. (2002). Environmental Health Criteria 227 (Fluoride). Geneva: Chương trình Môi trường Liên Hợp Quốc; Tổ chức Lao động Quốc tế; Tổ chức Y tế Thế giới. ISBN 92-4-157227-2. Truy cập ngày 10 tháng 2 năm 2021.
- Lusty, P. A. J.; Brown, T. J.; Ward, J.; Bloomfield, S. (2008). “The Need for Indigenous Fluorspar Production in England”. British Geological Survey. Truy cập ngày 10 tháng 2 năm 2021.
- Mackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. (2002). Introduction to Modern Inorganic Chemistry (ấn bản 6). Cheltenham: Nelson Thornes. ISBN 0-7487-6420-8.
- Macomber, Roger (1996). Organic chemistry. 1. Sausalito: University Science Books. ISBN 978-0-935702-90-3.
- Marggraf, Andreas Sigismun (1770). “Observation concernant une volatilisation remarquable d'une partie de l'espece de pierre, à laquelle on donne les noms de fluorsse, flüsse, flus-spaht, et aussi celui d'hesperos; laquelle volatilisation a été effectuée au moyen des acides” [Observation of a remarkable volatilization of part of a type of stone to which one gives the name fluorsse, flüsse, flus-spaht, as well as that of hesperos; which volatilization was effected by means of acids]. Mémoires de l'Académie royale des sciences et belles-lettres (bằng tiếng Pháp). XXIV: 3–11.
- Martin, John W. biên tập (2007). Concise Encyclopedia of the Structure of Materials. Oxford and Amsterdam: Elsevier. ISBN 978-0-08-045127-5.
- Marya, C. M. (2011). A Textbook of Public Health Dentistry. New Delhi: Jaypee Brothers Medical Publishers. ISBN 978-93-5025-216-1.
- Matsui, M. (2006). “Fluorine-containing Dyes”. Trong Kim, Sung-Hoon (biên tập). Functional dyes. Orlando: Academic Press. tr. 257–266. ISBN 978-0-12-412490-5.
- Meusinger, Reinhard; Chippendale, A. Margaret; Fairhurst, Shirley A. (2012). “Nuclear Magnetic Resonance and Electron Spin Resonance Spectroscopy”. Trong Ullmann, Franz (biên tập). Ullmann's Encyclopedia of Industrial Chemistry. 24. Weinheim: Wiley-VCH. tr. 609–660. doi:10.1002/14356007.b05_471.
- Meyer, Eugene (1977). Chemistry of Hazardous Materials. Englewood Cliffs: Prentice Hall. ISBN 978-0-13-129239-0.
- Miller, M. Michael (2003). “Fluorspar” (PDF). U.S. Geological Survey Minerals Yearbook. U.S. Geological Survey. tr. 27.1–27.12. Lưu trữ (PDF) bản gốc ngày 1 tháng 11 năm 2004. Truy cập ngày 11 tháng 2 năm 2021.
- Miller, M. Michael (2003). “Mineral Resource of the Month, Fluorspar” (PDF). U.S. Geological Survey. Lưu trữ (PDF) bản gốc ngày 12 tháng 8 năm 2009. Truy cập ngày 10 tháng 2 năm 2021.
- Mitchell, E. Siobhan (2004). Antidepressants. New York: Chelsea House Publishers. ISBN 978-1-4381-0192-7.
- Moeller, T.; Bailar, J. C.; Kleinberg (1980). Chemistry, with Inorganic Qualitative Analysis (ấn bản 3). New York: Academic Press. ISBN 0-12-503350-8.
- Moissan, Henri (1886). “Action d'un courant électrique sur l'acide fluorhydrique anhydre”. Comptes rendus hebdomadaires des séances de l'Académie des sciences (bằng tiếng Pháp). 102: 1543–1544. Truy cập ngày 10 tháng 2 năm 2021.
- McCoy, M. (2007). “SURVEY Market Challenges Dim the Confidence of the World's Chemical CEOs”. Chemical & Engineering News. 85 (23): 11. doi:10.1021/cen-v085n023.p011a.
- Moore, John W.; Stanitski, Conrad L.; Jurs, Peter C. (2010). Principles of Chemistry: The Molecular Science. Belmont: Brooks/Cole. ISBN 978-0-495-39079-4.
- Morrow, S. I.; Perry, D. D.; Cohen, M. S. (1959). “The Formation of Dinitrogen Tetrafluoride in the Reaction of Fluorine and Ammonia”. Journal of the American Chemical Society. 81 (23): 6338–6339. doi:10.1021/ja01532a066.
- Müller, Peter (2009). “5.067 Crystal Structure Refinement” (PDF). Cambridge: MIT OpenCourseWare. Truy cập ngày 10 tháng 2 năm 2021.
- Murphy, C. D.; Schaffrath, C.; O'Hagan, D. (2003). “Fluorinated Natural Products: The Biosynthesis of Fluoroacetate and 4-Fluorothreonine in Streptomyces cattleya”. Chemosphere. 52 (2): 455–461. doi:10.1016/S0045-6535(03)00191-7. PMID 12738270.
- Murthy, C. Parameshwara; Mehdi Ali, S. F.; Ashok, D. (1995). University Chemistry. I. New Delhi: New Age International. ISBN 978-81-224-0742-6.
- Nelson, Eugene W. (1947). “'Bad Man' of The Elements”. Popular Mechanics. 88 (2): 106–108, 260.
- Nelson, J. M.; Chiller, T. M.; Powers, J. H.; Angulo, F. J. (2007). “Food Safety: Fluoroquinolone‐ResistantCampylobacterSpecies and the Withdrawal of Fluoroquinolones from Use in Poultry: A Public Health Success Story” (PDF). Clinical Infectious Diseases. 44 (7): 977–980. doi:10.1086/512369. PMID 17342653.
- Nha Tổng giám đốc về môi trường (2007). Trifluralin (PDF) (Bản báo cáo). Ủy ban châu Âu. Truy cập ngày 10 tháng 2 năm 2021.
- Nielsen, Forrest H. (2009). “Micronutrients in Parenteral Nutrition: Boron, Silicon, and Fluoride”. Gastroenterology. 137 (5): S55–60. doi:10.1053/j.gastro.2009.07.072. PMID 19874950.
- Norwood, Charles J.; Fohs, F. Julius (1907). Kentucky Geological Survey, Bulletin No. 9: Fluorspar Deposits of Kentucky. Kentucky Geological Survey.
- Noury, S.; Silvi, B.; Gillespie, R. J. (2002). “Chemical Bonding in Hypervalent Molecules: Is the Octet Rule Relevant?” (PDF). Inorganic Chemistry. 41 (8): 2164–2172. doi:10.1021/ic011003v. PMID 11952370. Truy cập ngày 10 tháng 2 năm 2021.
- O'Hagan, D. (2008). “Understanding Organofluorine Chemistry. An Introduction to the C–F Bond”. Chemical Society Reviews. 37 (2): 308–319. doi:10.1039/b711844a. PMID 18197347.
- O'Hagan, D.; Schaffrath, C.; Cobb, S. L.; Hamilton, J. T. G.; Murphy, C. D. (2002). “Biochemistry: Biosynthesis of an Organofluorine Molecule”. Nature. 416 (6878): 279. Bibcode:2002Natur.416..279O. doi:10.1038/416279a. PMID 11907567.
- Okada, T.; Xie, G.; Gorseth, O.; Kjelstrup, S.; Nakamura, N.; Arimura, T. (1998). “Ion and Water Transport Characteristics of Nafion Membranes as Electrolytes”. Electrochimica Acta. 43 (24): 3741–3747. doi:10.1016/S0013-4686(98)00132-7.
- Okazoe, T. (2009). “Overview on the History of Organofluorine Chemistry from the Viewpoint of Material Industry”. Proceedings of the Japan Academy, Series B. 85 (8): 276–289. Bibcode:2009PJAB...85..276O. doi:10.2183/pjab.85.276.
- Olivares, M.; Uauy, R. (2004). Essential Nutrients in Drinking Water (Draft) (PDF) (Bản báo cáo). Tổ chức Y tế Thế giới. Bản gốc (PDF) lưu trữ ngày 19 tháng 10 năm 2012. Truy cập ngày 10 tháng 2 năm 2021.
- Parente, Luca (2001). “The Development of Synthetic Glucocorticoids”. Trong Goulding, Nicolas J.; Fluorwer, Rod J. (biên tập). Glucocorticoids. Basel: Birkhäuser. tr. 35–53. ISBN 978-3-7643-6059-7.
- Partington, J. R. (1923). “The early history of hydrofluoric acid”. Memoirs and Proceedings of the Manchester Literary and Philosophical Society. 67 (6): 73–87.
- Patnaik, Pradyot (2007). A Comprehensive Guide to the Hazardous Properties of Chemical Substances (ấn bản 3). Hoboken: John Wiley & Sons. ISBN 978-0-471-71458-3.
- Pauling, Linus (1960). The Nature of the Chemical Bond (ấn bản 3). Ithaca: Cornell University Press. ISBN 978-0-8014-0333-0.
- Pauling, L.; Keaveny, I.; Robinson, A. B. (1970). “The Crystal Structure of α-Fluorine”. Journal of Solid State Chemistry. 2 (2): 225–227. Bibcode:1970JSSCh...2..225P. doi:10.1016/0022-4596(70)90074-5.
- Perry, Dale L. (2011). Handbook of Inorganic Compounds (ấn bản 2). Boca Raton: CRC Press. ISBN 978-1-4398-1461-1.
- Pitzer, K. S. (1975). “Fluorides of Radon and Element 118”. Journal of the Chemical Society, Chemical Communications (18): 760b–761. doi:10.1039/C3975000760B.
- Pitzer, Kenneth S. biên tập (1993). Molecular Structure and Statistical Thermodynamics: Selected Papers of Kenneth S. Pitzer. Singapore: World Scientific Publishing. ISBN 978-981-02-1439-5.
- Pizzo, G.; Piscopo, M. R.; Pizzo, I.; Giuliana, G. (2007). “Community Water Fluoridation and Caries Prevention: A Critical Review” (PDF). Clinical Oral Investigations. 11 (3): 189–193. doi:10.1007/s00784-007-0111-6. PMID 17333303.
- Posner, Stefan (2011). “Perfluorinated Compounds: Occurrence and Uses in Products”. Trong Knepper, Thomas P.; Large, Frank T. (biên tập). Polyfluorinated Chemicals and Transformation Products. Heidelberg: Springer Science+Business Media. tr. 25–40. ISBN 978-3-642-21871-2.
- Posner, Stefan; và đồng nghiệp (2013). Per- and Polyfluorinated Substances in the Nordic Countries: Use Occurrence and Toxicology. Copenhagen: Nordic Council of Ministers. doi:10.6027/TN2013-542. ISBN 978-92-893-2562-2.
- Preskorn, Sheldon H. (1996). Clinical Pharmacology of Selective Serotonin Reuptake Inhibitors. Caddo: Professional Communications. ISBN 978-1-884735-08-0.
- Principe, Lawrence M. (2012). The Secrets of Alchemy. Chicago: University of Chicago Press. ISBN 978-0-226-68295-2.
- Proudfoot, A. T.; Bradberry, S. M.; Vale, J. A. (2006). “Sodium Fluoroacetate Poisoning”. Toxicological Reviews. 25 (4): 213–219. doi:10.2165/00139709-200625040-00002. PMID 17288493.
- PRWeb (ngày 28 tháng 10 năm 2010). “Global Fluorochemicals Market to Exceed 2.6 Million Tons by 2015, According to a New Report by Global Industry Analysts, Inc”. prweb.com. Bản gốc lưu trữ ngày 31 tháng 7 năm 2020. Truy cập ngày 10 tháng 2 năm 2021.
- PRWeb (ngày 23 tháng 2 năm 2012). “Global Fluorspar Market to Reach 5.94 Million Metric Tons by 2017, According to New Report by Global Industry Analysts, Inc”. prweb.com. Bản gốc lưu trữ ngày 31 tháng 7 năm 2020. Truy cập ngày 10 tháng 2 năm 2021.
- PRWeb (ngày 7 tháng 4 năm 2013). “Fluoropolymers Market is Poised to Grow at a CAGR of 6.5% & to Reach $9,446.0 Million by 2016 – New report by MarketsandMarkets”. prweb.com. Bản gốc lưu trữ ngày 31 tháng 7 năm 2020. Truy cập ngày 10 tháng 2 năm 2021.
- Pyykkö, Pekka; Atsumi, Michiko (2009). “Molecular Double-Bond Covalent Radii for Elements Li–E112”. Chemistry: A European Journal. 15 (46): 12770. doi:10.1002/chem.200901472.
- Raghavan, P. S. (1998). Concepts and Problems in Inorganic Chemistry. Delhi: Discovery Publishing House. ISBN 978-81-7141-418-5.
- Raj, P. Prithvi; Erdine, Serdar (2012). Pain-Relieving Procedures: The Illustrated Guide. Chichester: John Wiley & Sons. ISBN 978-0-470-67038-5.
- Ramkumar, Jayshree (2012). “Nafion Perfluorosulphonate Membrane: Unique Properties and Various Applications”. Trong Banerjee, S.; Tyagi, A. K. (biên tập). Functional Materials: Preparation, Processing and Applications. London and Waltham: Elsevier. tr. 549–578. ISBN 978-0-12-385142-0.
- Reddy, D. (2009). “Neurology of Endemic Skeletal Fluorosis”. Neurology India. 57 (1): 7–12. doi:10.4103/0028-3886.48793. PMID 19305069.
- Renda, Agostino; Fenner, Yeshe; Gibson, Brad K.; Karakas, Amanda I.; Lattanzio, John C.; Campbell, Simon; Chieffi, Alessandro; Cunha, Katia; Smith, Verne V. (2004). “On the origin of fluorine in the Milky Way”. Monthly Notices of the Royal Astronomical Society. 354 (2): 575. Bibcode:2004MNRAS.354..575R. doi:10.1111/j.1365-2966.2004.08215.x.
- Renner, R. (2006). “The Long and the Short of Perfluorinated Replacements”. Environmental Science & Technology. 40 (1): 12–13. Bibcode:2006EnST...40...12R. doi:10.1021/es062612a. PMID 16433328.
- Rhoades, David Walter (2008). Broadband Dielectric Spectroscopy Studies of Nafion (PhD dissertation, University of Southern Mississippi, MS). Ann Arbor: ProQuest. ISBN 978-0-549-78540-8.
- Richter, M.; Hahn, O.; Fuchs, R. (2001). “Purple Fluorite: A Little Known Artists' Pigment and Its Use in Late Gothic and Early Renaissance Painting in Northern Europe”. Studies in Conservation. 46 (1): 1–13. doi:10.1179/sic.2001.46.1.1. JSTOR 1506878.
- Riedel, Sebastian; Kaupp, Martin (2009). “The highest oxidation states of the transition metal elements”. Coordination Chemistry Reviews. 253 (5–6): 606. doi:10.1016/j.ccr.2008.07.014.
- Ripa, L. W. (2008). “A Half-century of Community Water Fluoridation in the United States: Review and Commentary” (PDF). Journal of Public Health Dentistry. 53 (1): 17–44. doi:10.1111/j.1752-7325.1993.tb02666.x. PMID 8474047. Bản gốc (PDF) lưu trữ ngày 13 tháng 10 năm 2006. Truy cập ngày 11 tháng 2 năm 2021.
- Roblin, I.; Urban, M.; Flicoteau, D.; Martin, C.; Pradeau, D. (2006). “Topical Treatment of Experimental Hydrofluoric Acid Skin Burns by 2.5% Calcium Gluconate”. Journal of Burn Care & Research. 27 (6): 889–894. doi:10.1097/01.BCR.0000245767.54278.09. PMID 17091088.
- Salager, Jean-Louis (2002). Surfactants: Types and Uses (PDF). FIRP Booklet # 300-A. Laboratory of Formulation, Interfaces, Rheology, and Processes, Universidad de los Andes. Bản gốc (PDF) lưu trữ ngày 31 tháng 7 năm 2020. Truy cập ngày 10 tháng 2 năm 2021.
- Sandford, Graham (2000). “Organofluorine Chemistry”. Philosophical Transactions. 358 (1766): 455–471. doi:10.1098/rsta.2000.0541.
- Sarkar, S. (2008). “Artificial Blood”. Indian Journal of Critical Care Medicine. 12 (3): 140–144. doi:10.4103/0972-5229.43685. PMC 2738310. PMID 19742251.
- Scheele, Carl Wilhelm (1771). “Undersŏkning om fluss-spat och dess syra” [Investigation of Fluorite and Its Acid]. Kungliga Svenska Vetenskapsademiens Handlingar [Proceedings of the Royal Swedish Academy of Science] (bằng tiếng Thụy Điển). 32: 129–138.
- Schimmeyer, S. (2002). “The Search for a Blood Substitute”. Illumin. Columbia: University of Southern Carolina. 15 (1). Bản gốc lưu trữ ngày 2 tháng 10 năm 2011. Truy cập ngày 10 tháng 2 năm 2021.
- Schlöder, T.; Riedel, S. (2012). “Investigation of Heterodimeric and Homodimeric Radical Cations of the Series: [F2O2]+, [F2Cl2]+, [Cl2O2]+, [F4]+, and [Cl4]+”. RSC Advances. Royal Society of Chemistry. 2 (3): 876–881. doi:10.1039/C1RA00804H.
- Schmedt auf der Günne, Jörn; Mangstl, Martin; Kraus, Fluorian (2012). “Occurrence of Difluorine F2 in Nature – In Situ Proof and Quantification by NMR Spectroscopy”. Angewandte Chemie International Edition. 51 (31): 7847–7849. doi:10.1002/anie.201203515. PMID 22763992.
- Schmitz, A.; Kälicke, T.; Willkomm, P.; Grünwald, F.; Kandyba, J.; Schmitt, O. (2000). “Use of Fluorine-18 Fluoro-2-deoxy-D-glucose Positron Emission Tomography in Assessing the Process of Tuberculous Spondylitis” (PDF). Journal of Spinal Disorders. 13 (6): 541–544. doi:10.1097/00002517-200012000-00016. PMID 11132989. Truy cập ngày 10 tháng 2 năm 2021.
- Schulze-Makuch, D.; Irwin, L. N. (2008). Life in the Universe: Expectations and Constraints (ấn bản 2). Berlin: Springer-Verlag. ISBN 978-3-540-76816-6.
- Schwarcz, Joseph A. (2004). The Fly in the Ointment: 70 Fascinating Commentaries on the Science of Everyday Life. Toronto: ECW Press. ISBN 1-55022-621-5.
- Senning, A. (2007). Elsevier's Dictionary of Chemoetymology: The Whies and Whences of Chemical Nomenclature and Terminology. Amsterdam and Oxford: Elsevier. ISBN 978-0-444-52239-9.
- Shaffer, T. H.; Wolfson, M. R.; Clark Jr, L. C. (1992). “Liquid Ventilation”. Pediatric Pulmonology. 14 (2): 102–109. doi:10.1002/ppul.1950140208. PMID 1437347.
- Shin, Richard D.; Silverberg, Mark A. (2013). “Fluoride Toxicity”. Medscape. Lưu trữ bản gốc ngày 15 tháng 10 năm 2013. Truy cập ngày 10 tháng 2 năm 2021.
- Shriver, Duward; Atkins, Peter (2010). Solutions Manual for Inorganic Chemistry. New York: W. H. Freeman. ISBN 978-1-4292-5255-3.
- Shulman, J. D.; Wells, L. M. (1997). “Acute Fluoride Toxicity from Ingesting Home-use Dental Products in Children, Birth to 6 Years of Age”. Journal of Public Health Dentistry. 57 (3): 150–158. doi:10.1111/j.1752-7325.1997.tb02966.x. PMID 9383753.
- Siegemund, G. N.; Schwertfeger, W.; Feiring, A.; Smart, B.; Behr, F.; Vogel, H.; McKusick, B. (2000). “Fluorine Compounds, Organic”. Trong Ullmann, Franz (biên tập). Ullmann's Encyclopedia of Industrial Chemistry. 15. Weinheim: Wiley-VCH. tr. 443–494. doi:10.1002/14356007.a11_349. ISBN 3527306730.
- Slye, Orville M. (2012). “Fire Extinguishing Agents”. Trong Ullmann, Franz (biên tập). Ullmann's Encyclopedia of Industrial Chemistry. 15. Weinheim: Wiley-VCH. tr. 1–11. doi:10.1002/14356007.a11_113.pub2.
- Smith, Robert M.; Martell, Arthur E. (1976). Critical Stability Constants Volume 4: Inorganic Complexes. New York: Springer Science+Business Media. ISBN 978-1-4757-5508-4.
- Steenland, K.; Fletcher, T.; Savitz, D. A. (2010). “Epidemiologic Evidence on the Health Effects of Perfluorooctanoic Acid (PFOA)”. Environmental Health Perspectives. 118 (8): 1100–1108. doi:10.1289/ehp.0901827. PMC 2920088. PMID 20423814.
- Stillman, John Maxson (tháng 12 năm 1912). “Basil Valentine, A Seventeenth Century Hoax”. Popular Science Monthly. 81. Truy cập ngày 10 tháng 2 năm 2021.
- Storer, Frank H. (1864). First Outlines of a Dictionary of Solubilities of Chemical Substances. Cambridge: Sever and Francis.
- Swinson, Joel (tháng 6 năm 2005). “Fluorine – A Vital Element in the Medicine Chest” (PDF). PharmaChem. Pharmaceutical Chemistry: 26–27. Bản gốc (PDF) lưu trữ ngày 23 tháng 7 năm 2007. Truy cập ngày 10 tháng 2 năm 2021.
- Taber, Andrew (ngày 22 tháng 4 năm 1999). “Dying to ride”. Salon. Truy cập ngày 10 tháng 2 năm 2021.
- Tanner Industries (tháng 1 năm 2011). “Anhydrous Ammonia: (MSDS) Material Safety Data Sheet”. tannerind.com. Truy cập ngày 10 tháng 2 năm 2021.
- Theodoridis, George (2006). “Fluorine-Containing Agrochemicals: An Overview of Recent Developments”. Trong Tressaud, Alain (biên tập). Fluorine and the Environment: Agrochemicals, Archaeology, Green Chemistry & Water. Amsterdam and Oxford: Elsevier. tr. 121–176. ISBN 978-0-444-52672-4.
- Toon, Richard (2011). “Fluorine, An Obsession with a Tragic Past” (PDF). Education in Chemistry. 48 (5): 148–151. Lưu trữ (PDF) bản gốc ngày 12 tháng 11 năm 2013. Truy cập ngày 11 tháng 2 năm 2021.
- Transparency Market Research (ngày 17 tháng 5 năm 2013). “Fluorochemicals Market is Expected to Reach USD 21.5 Billion Globally by 2018: Transparency Market Research”. Transparency Market Research Blog. Bản gốc lưu trữ ngày 20 tháng 5 năm 2013. Truy cập ngày 10 tháng 2 năm 2021.
- Tressaud, Alain (2019). Fluorine: A Paradoxical Element. Progress in Fluorine Science. 5. Amsterdam and Oxford: Elsevier. ISBN 978-0-12-812990-6.
- Trung tâm Dữ liệu Hạt nhân Quốc gia Hoa Kỳ. “NuDat 2.1 Database”. Brookhaven National Laboratory. Truy cập ngày 10 tháng 2 năm 2021.
- Trung tâm kiểm soát và phòng ngừa dịch bệnh Hoa Kỳ (2001). “Recommendations for Using Fluoride to Prevent and Control Dental Caries in the United States”. MMWR Recommendations and Reports. 50 (RR–14): 1–42. PMID 11521913. Truy cập ngày 10 tháng 2 năm 2021.
- Trung tâm kiểm soát và phòng ngừa dịch bệnh Hoa Kỳ (ngày 10 tháng 7 năm 2013). “Community Water Fluoridation”. Truy cập ngày 10 tháng 2 năm 2021.
- Ullmann, Fritz (2008). Ullmann's Fibers (2 volumes). Weinheim: Wiley-VCH. ISBN 978-3-527-31772-1.
- Ủy ban Đồng vị và Khối lượng Nguyên tử (2021). “Standard Atomic Weights: Fluorine”. Lưu trữ bản gốc ngày 21 tháng 3 năm 2023. Truy cập ngày 28 tháng 11 năm 2022.
- Viel, Claude; Goldwhite, Harold (1993). “1906 Nobel Laureate: Henri Moissan, 1852–1907”. Trong Laylin, K. James (biên tập). Nobel Laureates in Chemistry, 1901–1992. Washington: American Chemical Society; Chemical Heritage Foundation. tr. 35–41. ISBN 978-0-8412-2690-6.
- Viện Quốc gia về An toàn và Sức khỏe Nghề nghiệp Hoa Kỳ (1994). “Fluorine”. Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs). Truy cập ngày 10 tháng 2 năm 2021.
- Viện Quốc gia về An toàn và Sức khỏe Nghề nghiệp Hoa Kỳ (1994). “Chlorine”. Documentation for Immediately Dangerous To Life or Health Concentrations (IDLHs). Truy cập ngày 10 tháng 2 năm 2021.
- Vigoureux, P. (1961). “The Gyromagnetic Ratio of the Proton”. Contemporary Physics. 2 (5): 360–366. Bibcode:1961ConPh...2..360V. doi:10.1080/00107516108205282. S2CID 5092147.
- Villalba, Gara; Ayres, Robert U.; Schroder, Hans (2008). “Accounting for Fluorine: Production, Use, and Loss”. Journal of Industrial Ecology. 11: 85. doi:10.1162/jiec.2007.1075. S2CID 153740615.
- Walsh, Kenneth A. (2009). Beryllium Chemistry and Processing. Materials Park: ASM International. ISBN 978-0-87170-721-5.
- Walter, P. (2013). “Honeywell Invests $300m in Green Refrigerant”. Chemistry World.
- Warner, Frederick; Harrison, Roy M. biên tập (1993). Radioecology After Chernobyl: Biogeochemical Pathways of Artificial Radionuclides. SCOPE 50. New York: Wiley. ISBN 0-471-93168-3. Bản gốc lưu trữ ngày 13 tháng 5 năm 2014. Truy cập ngày 1 tháng 4 năm 2023.
- Weeks, M. E. (1932). “The Discovery of the Elements. XVII. The Halogen Family”. Journal of Chemical Education. 9 (11): 1915–1939. Bibcode:1932JChEd...9.1915W. doi:10.1021/ed009p1915.
- Werner, N. L.; Hecker, M. T.; Sethi, A. K.; Donskey, C. J. (2011). “Unnecessary use of Fluoroquinolone Antibiodics in Hospitalized Patients”. BMC Infectious Diseases. 11: 187–193. doi:10.1186/1471-2334-11-187. PMC 3145580. PMID 21729289.
- Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 978-0-12-352651-9.
- Willey, Ronald R. (2007). Practical Equipment, Materials, and Processes for Optical Thin Films. Charlevoix: Willey Optical. ISBN 978-0-615-14397-2.
- Yaws, Carl L.; Braker, William (2001). “Fluorine”. Matheson Gas Data Book (ấn bản 7). Parsippany: Matheson Tri-Gas. ISBN 978-0-07-135854-5.
- Yeung, C. A. (2008). “A Systematic Review of the Efficacy and Safety of Fluoridation”. Evidence-Based Dentistry. 9 (2): 39–43. doi:10.1038/sj.ebd.6400578. PMID 18584000.
- Young, David A. (1975). Phase Diagrams of the Elements (Bản báo cáo). Lawrence Livermore Laboratory. Truy cập ngày 10 tháng 2 năm 2021.
- Zareitalabad, P.; Siemens, J.; Hamer, M.; Amelung, W. (2013). “Perfluorooctanoic acid (PFOA) and perfluorooctanesulfonic acid (PFOS) in surface waters, sediments, soils and wastewater – A review on concentrations and distribution coefficients”. Chemosphere. 91 (6): 725. doi:10.1016/j.chemosphere.2013.02.024. PMID 23498059.
- Zorich, Robert (1991). Handbook of Quality Integrated Circuit Manufacturing. San Diego: Academic Press. ISBN 978-0-323-14055-3.
Liên kết ngoài[sửa | sửa mã nguồn]
| Wikimedia Commons có thêm hình ảnh và phương tiện truyền tải về Fluor. |
- Fluorine (chemical element) tại Encyclopædia Britannica (tiếng Anh)
- WebElements.com – Fluorine (tiếng Anh)
- Fluor tại Từ điển bách khoa Việt Nam
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |













