Natri molybdat
 | Bài viết này thuộc nhóm bài về hóa học cần phải cập nhật nội dung theo TCVN 5529:2010 và TCVN 5530:2010. Xin hỗ trợ sửa lại danh pháp hóa học trong bài viết theo quy định tại Wikipedia:Tên bài (hóa học) |
| Natri molybdat | |
|---|---|
 Mẫu natri molybdat | |
 | |
 | |
| Danh pháp IUPAC | Natri molybdat |
| Tên khác | Natri tetroxomolybdat(VI) |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| Số EINECS | |
| Số RTECS | QA5075000 |
| Thuộc tính | |
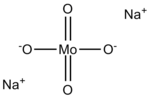
| Công thức phân tử | Na2MoO4 |
| Khối lượng mol | 205,9256 g/mol (khan) 241,95616 g/mol (2 nước) |
| Bề ngoài | bột trắng |
| Khối lượng riêng | 3,78 g/cm³, rắn |
| Điểm nóng chảy | 687 °C (960 K; 1.269 °F) |
| Điểm sôi | |
| Độ hòa tan trong nước | 84 g/100 ml (100°C) |
| Chiết suất (nD) | 1,714 |
| Các nguy hiểm | |
| MSDS | External MSDS |
| Chỉ mục EU | không có trong danh sách |
| NFPA 704 |
|
| Điểm bắt lửa | không cháy |
| Các hợp chất liên quan | |
| Anion khác | Natri chromat Natri tungstat |
| Cation khác | Amoni molybdat |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Natri molybdat, Na2MoO4, là nguồn cung cấp molybden.[1] Nó thường gặp dưới dạng hydrat hoá, Na2MoO4·2H2O.
Anion molybdat(VI) có dạng tứ diện. Hai cation natri liên kết với mỗi một anion.[2]
Lịch sử[sửa | sửa mã nguồn]
Natri molybdat được tổng hợp trước tiên bằng phương pháp hydrat hoá.[3] Một cách khác thuận tiện hơn được tiến hành bằng cách hoà tan MoO3 vào natri hydroxide ở 50–70 °C và làm kết tinh sản phẩm thu được.[2] Muối khan được tạo thành khi nung nóng lên nhiệt độ 100 °C.
- MoO3 + 2NaOH → Na2MoO4·2H2O
Sử dụng[sửa | sửa mã nguồn]
Ngành công nghiệp, nông nghiệp sử dụng 1 triệu pound mỗi năm để làm phân bón. Đặc biệt, việc sử dụng nó đang được đề xuất cho việc xử lý ở bông cải xanh và súp lơ ở các cánh đồng thiếu molybden.[4][5] Tuy nhiên, sự chăm bón phải được giới hạn vì một lượng nhỏ khoảng 0,3 ppm natri molybdat có thể gây ra hiện tượng thiếu hụt đồng ở động vật, đặc biệt là gia súc.[2]
Nó được dùng trong công nghiệp cho mục đích ức chế ăn mòn, vì nó là chất ức chế anot không oxi hoá.[2] Sự thêm vào natri molybdat làm giảm đáng kể nhu cầu nitrit của chất lưu bị ức chế với nitrit-amin, và cải thiện khả năng bảo vệ ăn mòn của dung dịch muối carboxylat.[6]
Phản ứng[sửa | sửa mã nguồn]
Khi phản ứng với natri borohydride, molybden bị khử xuống các oxit hoá trị thấp hơn:[7]
- Na2MoO4 + NaBH4 + 2H2O → NaBO2 + MoO2 + 2NaOH + 3H2↑
Natri molybdat phản ứng với các axit của đithiophotphat:[2]
- Na2MoO4 + (RO)2PS2H (R = Me, Et) → [MoO2(S2P(OR)2)2]
trong đó phản ứng tiếp tạo ra [MoO3(S2P(OR)2)4].
An toàn[sửa | sửa mã nguồn]
Natri molybdat kỵ với kim loại kiềm, hầu hết các kim loại thông thường và các chất oxy hoá. Nó sẽ phát nổ khi tiếp xúc magnesi nóng chảy. Nó sẽ phản ứng mãnh liệt với các liên halogen (interhalogen) (ví dụ như brom pentafluoride, chlor trifluoride). Phản ứng của nó với natri, kali hay lithi nóng đều phát sáng.[8]
Xem thêm[sửa | sửa mã nguồn]
Enzym chứa molybden như là một đồng cấu tử:
Chú thích[sửa | sửa mã nguồn]
- ^ Greenwood, Norman N.; Earnshaw, Alan (1984). Chemistry of the Elements. Oxford: Pergamon Press. ISBN 978-0-08-022057-4.
- ^ a b c d e Braithwaite, E.R.; Haber, J. Molybdenum: An outline of its Chemistry and Uses. 1994. Elsevier Science B.V. Amsterdam, The Netherlands.
- ^ Spitsyn, Vikt. I.; Kuleshov, I. M. Zhurnal Obshchei Khimii 1951. 21. 1701-15.
- ^ Plant, W. (1950). “Use of Lime and Sodium Molybdate for the Control of 'Whiptail' in Broccoli”. Nature. 165 (4196): 533. doi:10.1038/165533b0.
- ^ Davies, E. B. (1945). “A Case of Molybdenum Deficiency in New Zealand”. Nature. 156 (3961): 392. doi:10.1038/156392b0.
- ^ Vukasovich, Mark S. Lubrication Engineering 1980. 36(12). 708-12.
- ^ Chi Fo Tsang and Arumugam Manthiram. Journal of Materials Chemistry 1997. 7(6). 1003–1006.
- ^ http://www.mallbaker.com/americas/msds/english/s4394_msds_us_default.pdf[liên kết hỏng]
Liên kết ngoài[sửa | sửa mã nguồn]
| Wikimedia Commons có thêm hình ảnh và phương tiện truyền tải về Natri molybdat. |

