Natri carbonat
Bài viết này cần thêm chú thích nguồn gốc để kiểm chứng thông tin. |
| Natri cacbonat | |
|---|---|
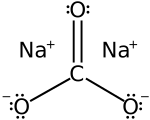 | |
 | |
| Danh pháp IUPAC | Sodium carbonate |
| Tên khác | Cacbonat natri Natron ([1]) |
| Nhận dạng | |
| Số CAS | |
| PubChem | |
| ChEBI | |
| ChEMBL | |
| Số RTECS | VZ4050000 |
| Ảnh Jmol-3D | ảnh |
| SMILES | đầy đủ
|
| InChI | đầy đủ
|
| ChemSpider | |
| UNII | |
| Thuộc tính | |
| Công thức phân tử | Na2CO3 |
| Khối lượng mol | 105,9872 g/mol (khan) 124,00248 g/mol (1 nước) 196,0636 g/mol (5 nước) 232,09416 g/mol (7 nước) 286,14 g/mol (10 nước) |
| Bề ngoài | Tinh thể màu trắng |
| Khối lượng riêng | 2,54 g/cm³, thể rắn |
| Điểm nóng chảy | 851 °C (1.124 K; 1.564 °F) |
| Điểm sôi | 1.600 °C (1.870 K; 2.910 °F) |
| Độ hòa tan trong nước | 22 g/100 mL (20 ℃), xem thêm bảng độ tan |
| Độ bazơ (pKb) | 3,67 |
| Các nguy hiểm | |
| MSDS | ngoài |
| NFPA 704 |
|
| Điểm bắt lửa | Không bắt lửa. |
| Các hợp chất liên quan | |
| Anion khác | Natri bicacbonat |
| Cation khác | Lithi cacbonat Kali cacbonat Rubidi cacbonat Xezi cacbonat |
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |
Natri cacbonat, còn gọi là soda, là một loại muối cacbonat của natri có công thức hóa học là Na2CO3. Natri cacbonat là một muối bền trong tự nhiên, thường có trong nước khoáng, nước biển và muối mỏ trong lòng đất. Một số rất ít tồn tại ở dạng tinh thể có lẫn canci cacbonat. Quá trình hình thành trong tự nhiên chủ yếu do sự thay đổi địa hình Trái Đất làm một số hồ gần biển hoặc vịnh bị khép kín, dần dần lượng muối tích tụ lại và bị chôn vùi vào lòng đất tạo thành mỏ muối. Lượng muối còn lại trong tự nhiên (nước biển) được hình thành do hòa tan khí CO2 trong không khí.
Vì có trữ lượng lớn và quá trình khai thác, điều chế đơn giản nên giá bán natri cacbonat trên thị trường rẻ: 16.000 đồng/1 kg năm 2010 (~ $0,84/1 kg).
Không nhầm natri cacbonat với natri bicacbonat. Natri cacbonat là một chất tính ăn mòn cao, không dùng trong ăn uống, đặc biệt trong khuôn khổ gia đình hay thủ công.
Tính chất vật lý[sửa | sửa mã nguồn]
Na2CO3 khan là chất bột màu trắng, hút ẩm và nóng chảy ở 851 ℃, nóng chảy không phân hủy tới 853 ℃[1], còn cao hơn nhiệt độ này thì bắt đầu phân hủy[2].
Na2CO3 dễ tan trong nước, khi tan trong nước phát ra nhiều nhiệt do tạo thành hydrat. Từ trong dung dịch, ở dưới 32,5 ℃ natri cacbonat kết tinh tạo Na2CO3·10H2O, giữa khoảng 32,5–37,5 ℃ tạo Na2CO3·7H2O, trên 37,5 ℃ biến thành Na2CO3·H2O, và đến 107 ℃ thì mất nước hoàn toàn thành natri cacbonat khan[1].
Độ tan của các hydrat chứa nhiều phân tử nước tăng theo nhiệt độ, còn của monohydrat thì ngược lại[1]. Trong không khí, decahydrat Na2CO3·10H2O dễ mất bớt nước kết tinh, tạo thành bột trắng vụn Na2CO3·5H2O.[2]
Tính chất hóa học[sửa | sửa mã nguồn]
- Tác dụng với axít mạnh tạo thành muối, nước và giải phóng khí CO2:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
- Tác dụng với base tạo thành muối mới và base mới:
Na2CO3 + Ca(OH)2 → 2NaOH + CaCO3↓
- Tác dụng với muối tạo thành hai muối mới:
Na2CO3 + CaCl2 → 2NaCl + CaCO3
- Chuyển đổi qua lại với natri bicacbonat theo phản ứng:
Na2CO3 + CO2 + H2O ⇌ 2NaHCO3
- Khi tan trong nước, Na2CO3 bị thủy phân mạnh tạo môi trường base, làm đổi màu các chất chỉ thị: dung dịch phenolphtalein không màu thành màu hồng, quỳ tím hóa xanh:
Na2CO3 → 2Na+ + CO32−
CO32− + H2O ⇌ HCO3− + OH− ⇒ Dung dịch Na2CO3 có tính base yếu.
Ứng dụng[sửa | sửa mã nguồn]
- Trong công nghiệp, natri cacbonat được dùng để nấu thủy tinh, xà phòng, làm giấy, đồ gốm, phẩm nhuộm, dệt, điều chế nhiều muối khác của natri như borat, cromat…[1][3]
- Sản xuất keo dán gương, thủy tinh lỏng.[1]
Sản xuất[sửa | sửa mã nguồn]
Natri cacbonat có sẵn trong tự nhiên: trong các hồ muối, muối mỏ và tro của rong biển. Người Ai Cập cổ đã biết khai thác nguồn muối này từ 4000 năm trước, và từ thế kỷ XV–XVI, tro rong biển đã được dùng để sản xuất xà phòng và thủy tinh.[1]
Trước đây trong công nghiệp thì Na2CO3 được sản xuất theo phương pháp sunfat, còn gọi là phương pháp Leblanc, do nhà hóa học Pháp N.Leblanc (1742–1806) đề ra năm 1791[2]. Cụ thể như sau:
- Nung hỗn hợp natri sunfat (Na2SO4) với than (C) và đá vôi (CaCO3) ở 1000 ℃, sẽ có hai phản ứng xảy ra:
- Hòa tan hỗn hợp sản phẩm vào nước sẽ tách được CaS không tan ra khỏi Na2CO3. CaS sau đó có thể được dùng để sản xuất lưu huỳnh.
Natri cacbonat ngày nay hầu như được điều chế theo phương pháp amonia, hay còn gọi là phương pháp Solvay, do nhà hóa học Bỉ E.Solvay (1838–1922) đề ra năm 1864. Phương pháp này dựa vào phản ứng hóa học:
- NaCl + NH3 + CO2 + H2O ⇌ NaHCO3 + NH4Cl
NaHCO3 ít tan trong nước được tách ra, nhiệt phân tạo thành Na2CO3:
- 2NaHCO3 → Na2CO3 + CO2 + H2O
Tham khảo[sửa | sửa mã nguồn]
- ^ a b c d e f Hoàng Nhâm; Hóa học vô cơ cơ bản, tập hai - Các nguyên tố hóa học điển hình (2017); Nhà xuất bản Giáo dục; trang 47.
- ^ a b c Mai Văn Ngọc; Giáo trình Hóa học vô cơ 1 - Các nguyên tố nhóm A (2014); Nhà xuất bản Đại học Sư phạm TP. Hồ Chí Minh; trang 236.
- ^ Sách giáo khoa Hóa học 12 nâng cao (2013); Nhà xuất bản Giáo dục; trang 156.

