Rutheni
| Rutheni, 44Ru | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất chung | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tên, ký hiệu | Rutheni, Ru | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phiên âm | /ruːˈθiːniəm/ roo-THEE-nee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hình dạng | Ánh kim bạc trắng | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rutheni trong bảng tuần hoàn | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số nguyên tử (Z) | 44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Khối lượng nguyên tử chuẩn (Ar) | 101,07 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phân loại | kim loại chuyển tiếp | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhóm, phân lớp | 8, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chu kỳ | Chu kỳ 5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cấu hình electron | [Kr] 4d7 5s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
mỗi lớp | 2, 8, 18, 15, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất vật lý | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Màu sắc | Ánh kim bạc trắng | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái vật chất | Chất rắn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt độ nóng chảy | 2607 K (2334 °C, 4233 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt độ sôi | 4423 K (4150 °C, 7502 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mật độ | 12,45 g·cm−3 (ở 0 °C, 101.325 kPa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mật độ ở thể lỏng | ở nhiệt độ nóng chảy: 10,65 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt lượng nóng chảy | 38,59 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt bay hơi | 591,6 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt dung | 24,06 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Áp suất hơi
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất nguyên tử | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái oxy hóa | 8, 7, 6, 4, 3, 2, 1,[1], -2 Acid trung bình | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ âm điện | 2,3 (Thang Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Năng lượng ion hóa | Thứ nhất: 710,2 kJ·mol−1 Thứ hai: 1620 kJ·mol−1 Thứ ba: 2747 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính cộng hoá trị | thực nghiệm: 134 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính liên kết cộng hóa trị | 146±7 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thông tin khác | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cấu trúc tinh thể | Lục phương | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vận tốc âm thanh | que mỏng: 5970 m·s−1 (ở 20 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ giãn nở nhiệt | 6,4 µm·m−1·K−1 (ở 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ dẫn nhiệt | 117 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Điện trở suất | ở 0 °C: 71 n Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất từ | Thuận từ[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun Young | 447 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun cắt | 173 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun khối | 220 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hệ số Poisson | 0,30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ cứng theo thang Mohs | 6,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ cứng theo thang Brinell | 2160 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số đăng ký CAS | 7440-18-8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Đồng vị ổn định nhất | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bài chính: Đồng vị của Rutheni | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Rutheni (tiếng Latinh: Ruthenium) là một nguyên tố hóa học có ký hiệu Ru và số nguyên tử 44. Là một kim loại chuyển tiếp trong nhóm platin của bảng tuần hoàn, rutheni được tìm thấy trong các quặng platin và được sử dụng như là chất xúc tác trong một số hợp kim platin.
Lịch sử[sửa | sửa mã nguồn]
Rutheni được nhà khoa học Nga là Karl Klaus phát hiện và cô lập năm 1844 tại Đại học Kazan, Kazan. Klaus chỉ ra rằng oxide rutheni chứa một kim loại mới và thu được 6 gam rutheni từ phần platin thô không hòa tan trong nước cường toan.
Jöns Berzelius và Gottfried Osann gần như đã phát hiện ra rutheni năm 1827. Hai người này đã kiểm tra phần cặn bã còn lại sau khi hòa tan platin thô từ dãy núi Ural trong nước cường toan. Berzelius không tìm thấy bất kỳ kim loại không thông thường nào nhưng Osann thì cho rằng ông đã tìm ra ba kim loại mới và đặt tên một trong ba kim loại này là ruthenium (cùng pluranium và polinium).
Tên gọi có nguồn gốc từ Ruthenia, một từ La tinh để chỉ Rus, một khu vực lịch sử mà ngày nay là miền tây Nga, Ukraina, Belarus, một phần Slovakia và Ba Lan. Karl Klaus đặt tên cho nguyên tố như vậy để vinh danh quê hương ông, do ông sinh ra tại Tartu, Estonia, khi đó là một phần của đế quốc Nga.
Cũng có thể là nhà hóa học Ba Lan Jędrzej Śniadecki đã cô lập được nguyên tố số 44 (ông gọi là vestium) từ quặng platin vào năm 1807. Tuy nhiên, công trình của ông đã không bao giờ được xác nhận và sau đó ông đã tự rút yêu cầu về phát kiến của mình.
Đặc trưng[sửa | sửa mã nguồn]

Là một kim loại màu trắng, cứng, nhiều hóa trị, rutheni là thành viên của nhóm platin, có 4 biến thể kết tinh và không bị xỉn đi ở nhiệt độ bình thường, nhưng bị oxy hóa dễ dàng trong không khí để tạo thành tetraoxide rutheni (RuO4), một tác nhân oxy hóa mạnh với các tính chất tương tự như của tetraoxide osmi. Rutheni hòa tan trong kiềm nóng chảy, không bị các acid ăn mòn nhưng bị các halogen ăn mòn ở nhiệt độ cao. Một lượng nhỏ rutheni có thể làm tăng độ cứng của platin và paladi. Khả năng chống ăn mòn của titan tăng lên đáng kể nhờ bổ sung một lượng nhỏ rutheni.
Kim loại này có thể mạ thông qua mạ điện hay bằng các phương pháp phân hủy nhiệt. Một hợp kim của rutheni với molypden có tính siêu dẫn ở 10,6 K. Các trạng thái oxy hóa của rutheni nằm trong khoảng từ +1 tới +8, và trạng thái -2 cũng đã được biết đến, mặc dù các trạng thái +2, +3 và +4 là phổ biến nhất.
Phổ biến[sửa | sửa mã nguồn]
Khai thác thông thường[sửa | sửa mã nguồn]
Nguyên tố này nói chung được tìm thấy trong các loại quặng với các kim loại khác thuộc nhóm platin trong khu vực dãy núi Ural cũng như ở Bắc và Nam Mỹ. Những lượng nhỏ nhưng có tầm quan trọng thương mại cũng được tìm thấy trong pentlandit tách ra ở Sudbury, Ontario, Canada và trong các trầm tích pyroxenit ở Nam Phi.
Rutheni là cực hiếm và nó đứng thứ 74 về độ phổ biến trong số các kim loại trên Trái Đất[6]. Khoảng 12 tấn rutheni được khai thác mỗi năm với tổng trữ lượng toàn thế giới khoảng 5000 tấn[6].
Kim loại này được cô lập ở quy mô thương mại thông qua công nghệ hóa học phức tạp trong đó hiđrô được dùng để khử ammoni rutheni chloride để sinh ra một chất bột. Chất bột đó được làm đặc chắc bằng các kỹ thuật luyện kim bột hay bằng hàn hồ quang agon.
Từ nhiên liệu hạt nhân đã sử dụng[sửa | sửa mã nguồn]
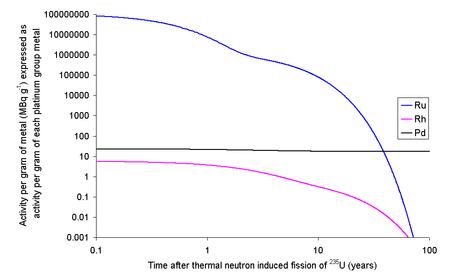
Cũng có thể tách ra rutheni từ nhiên liệu hạt nhân đã sử dụng. Mỗi kilôgam các sản phẩm phân hạch của U235 chứa khoảng 63,44 gam các đồng vị rutheni với chu kỳ bán rã dài hơn 1 ngày. Do nhiên liệu hạt nhân đã sử dụng điển hình chứa khoảng 3% các sản phẩm phân hạch nên 1 tấn nhiên liệu hạt nhân đã sử dụng chứa khoảng 1,9 kg rutheni. Ru103 và Ru106 sẽ làm cho rutheni phân hạch có tính phóng xạ cao. Nếu như sự phân hạch diễn ra ngay lập tức thì rutheni được tạo thành từ đó sẽ có độ hoạt hóa cho Ru103 là 109 TBq g−1 và cho Ru106 là 1,52 TBq g−1. Ru103 có chu kỳ bán rã khoảng 39 ngày nghĩa là trong phạm vi 390 ngày thì nó sẽ phân rã gần như tới trạng thái nền, đủ tốt để cho việc tái chế có thể diễn ra. Ru106 có chu kỳ bán rã khoảng 373 ngày, nghĩa là nếu nhiên liệu đã qua sử dụng để nguội trong 5 năm trước khi tái chế thì chỉ còn khoảng 3% lượng ban đầu còn đọng lại, phần còn lại đã phân rã tới trạng thái nền.
Xem thêm Khoáng vật rutheni.
Hợp chất[sửa | sửa mã nguồn]
Các hợp chất của rutheni thường tương tự về tính chất như các hợp chất của osmi và thể hiện ít nhất 8 trạng thái oxy hóa, nhưng các trạng thái +2, +3, +4 là phổ biến nhất. Các ví dụ là oxide rutheni (IV) (Ru(IV)O2, trạng thái oxy hóa +4), ruthenat dikali (K2Ru(VI)O4, +6), perruthenat kali (KRu(VII)O4, +7) và tetroxide rutheni (Ru(VIII)O4, +8). Các hợp chất của rutheni với clo là chloride rutheni (II) (RuCl2) và chloride rutheni (III) (RuCl3).
Xem thêm Hợp chất của rutheni.
Đồng vị[sửa | sửa mã nguồn]
Rutheni nguồn gốc tự nhiên là hỗn hợp của 7 đồng vị. Đồng vị phóng xạ ổn định nhất là Ru106 với chu kỳ bán rã 373,59 ngày, Ru103 với chu kỳ bán rã 39,26 ngày và Ru97 có chu kỳ bán rã 2,9 ngày.
Mười lăm đồng vị phóng xạ khác cũng được nêu đặc trưng với nguyên tử lượng nằm trong khoảng từ 89,93 (Ru90) tới 114,928 (Ru115). Phần lớn trong số này có chu kỳ bán rã nhỏ hơn 5 phút, ngoại trừ Ru95 (1,643 giờ) và Ru105 (4,44 giờ).
Phương thức phân rã chủ yếu của các đồng vị nhẹ hơn đồng vị phổ biến nhất (Ru102) là bắt điện tử còn phương thức phân rã chủ yếu của các đồng vị nặng hơn là bức xạ beta. Sản phẩm phân rã chủ yếu của các đồng vị nhẹ hơn Ru102 là tecneti còn sản phẩm phân rã chủ yếu của các đồng vị nặng hơn là rhodi.
Hóa hữu cơ kim loại[sửa | sửa mã nguồn]
Rutheni là kim loại rất linh hoạt, có thể dễ dàng tạo ra các hợp chất với các liên kết cacbon-rutheni, do vậy các hợp chất này có xu hướng sẫm màu hơn và phản ứng nhanh hơn so với các hợp chất của osmi. Gần đây, Anthony Hill và đồng nghiệp đã tạo ra các hợp chất của rutheni trong đó các nguyên tử bo liên kết với nguyên tử kim loại[7].
Hợp chất hữu cơ kim loại của rutheni dễ dàng tạo ra là RuHCl(CO)(PPh3)3. Hợp chất này có 2 dạng (màu vàng và màu hồng) là đồng nhất khi chúng hòa tan nhưng khác biệt khi ở trạng thái rắn.
Hợp chất hữu cơ kim loại tương tự như ruthenocen, bis(2,4-dimethylpentadienyl)rutheni, dễ dàng tổng hợp ở khối lượng gần định lượng được và có ứng dụng trong ngưng đọng rutheni kim loại pha hơi cũng như trong xúc tác, bao gồm tổng hợp Fischer-Tropsch đê tạo ra nhiên liệu lỏng cho ngành vận tải từ mônoxide cacbon và hiđrô.
Các chất xúc tác quan trọng dựa trên rutheni là xúc tác Grubbs và phức chất Roper.
Ngưng đọng hơi hóa học rutheni[sửa | sửa mã nguồn]
Thách thức duy nhất phát sinh trong cố gắng phát triển các màng rutheni tinh khiết để làm chất xúc tác. Rutheni kim loại hoạt hóa các liên kết C-H và C-C, hỗ trợ sự phân cắt liên kết C-H và C-C. Nó tạo ra con đường phân hủy xúc tác tiềm năng cho mọi tiền chất ngưng đọng hơi hóa học (CVD) hữu cơ kim loại mà có thể nhất dẫn tới sự hợp nhất cacbon đáng kể. Platin, một chất xúc tác tương tự về mặt hóa học, xúc tác quá trình khử hiđrô của các hydrocarbon mạch vòng 5- và 6-thành viên thành benzen.[8] Các dải d của rutheni nằm cao hơn các dải d của platin, nói chung dự báo các liên kết hút bám-rutheni mạnh hơn so với platin. Vì thế, rất có thể là rutheni cũng xúc tác cho quá trình khử hiđrô của các vòng hydrocarbon 5- và 6-thành viên thành benzen. Benzen bị khử hiđrô tiếp trên bề mặt rutheni thành các đoạn hydrocarbon tương tự như những gì tạo thành bởi acetylen và ethen trên bề mặt rutheni.[9][10] Ngoài benzen, acetylen và ethen thì pyridin cũng bị phân hủy trên bề mặt rutheni, để lại các đoạn đã liên kết trên bề mặt.[10]
Rutheni cũng được nghiên cứu kỹ trong khoa học bề mặt và trong các tài liệu về xúc tác do tầm quan trọng của nó như là một chất xúc tác trong công nghiệp. Có nhiều nghiên cứu về hành vi của các phân tử đơn lẻ trên rutheni trong khoa học bề mặt. Tuy nhiên, việc hiểu bản chất hành vi của mỗi phối thể một cách riêng lẻ không tương đương với việc hiểu bản chất hành vi của chúng khi đồng hút bám với nhau và cùng với tiền chất. Trong khi không có khác biệt về áp suất một cách đáng kể giữa các nghiên cứu khoa học bề mặt và CVD, nhưng thường có khoảng trống nhiệt độ giữa các nhiệt độ được báo cáo trong các nghiên cứu khoa học bề mặt và nhiệt độ phát triển CVD. Mặc cho các phức tạp này, rutheni là ứng viên tiềm năng cho việc hiểu CVD và thiết kế tiền chất của các màng xúc tác.
Các phối thể là các hợp chất ổn định theo đúng nghĩa, thời gian tiếp xúc phối thể-rutheni ngắn và nhiệt độ chất nền vừa phải giúp tối thiểu hóa sự phân hủy phối thể không mong muốn trên bề mặt.[11][12][13] Sự hoạt hóa liên kết C-H và C-C là phụ thuộc nhiệt độ. Sự khử hút thấm bề mặt của sản phẩm cũng phụ thuộc nhiệt độ, nếu như sản phẩm không liên kết vào bề mặt rutheni. Điều này gợi ý rằng có một nhiệt độ tối ưu nào đó, mà tại đó phần lớn các phối thể ổn định độc lập có vừa đủ năng lượng nhiệt để khử hút thấm từ bề mặt màng rutheni trước khi sự hoạt hóa C-H có thể xảy ra. Ví dụ, benzen bắt đầu phân hủy trên bề mặt rutheni ở 87 °C. Tuy nhiên, phản ứng khử hiđrô không dẫn tới phân đoạn cho đến khi đạt 277 °C và sự phân đoạn trọn vẹn không quan sát thấy ở các độ bao phủ bề mặt thấp. Điều này gợi ý rằng các phân tử benzen hút bám đã cung cấp là không gần với nhau trên bề mặt và khi nhiệt độ dưới 277 °C thì phần lớn các phân tử benzen có thể không góp phần vào sự hợp nhất cacbon trên màng xúc tác. Vì thế, lưu ý cơ bản trong phát triển các màng xúc tác kim loại cho CVD, như rutheni, là sự kết hợp của thiết kế phân tử và các khía cạnh động lực học của sự phát triển theo cách thức thuận lợi nhất.
Trước khi các tiền chất hữu cơ-kim loại được khảo sát, trirutheni dodecacacbonyl (Ru3(CO)12) đã được thử nghiệm như là tiền chất CVD.[14][15] Trong khi tiền chất này tạo ra các màng chất lượng tốt thì áp suất hơi lại kém, làm phức tạp hóa việc sử dụng trên thực tế của nó trong công nghệ CVD. Ruthenocen[16][17] và bis(ethylcyclopentadienyl)rutheni (II)[18][19][20][21] và beta-diketonat rutheni (II)[22][23][24] đã được khảo sát tương đối kỹ. Mặc dù các tiền chất này cũng có thể tạo ra các màng tinh khiết với suất kháng thấp khi phản ứng với oxy, nhưng tốc độ phát triển lại rất thấp hay không được thông báo. Một tiền chất phát triển nhanh, cyclopentadienyl-propylcyclopentadienylrutheni (II) (RuCp(i-PrCp)), đã được nhận dạng.[25] RuCp(i-PrCp đạt được tốc độ phát triển từ 7,5 nm/phút tới 20 nm/phút cũng như có suất kháng thấp. Tuy nhiên, nó không tạo nhân trong các oxide, loại bỏ việc sử dụng nó trong mọi ứng dụng, ngoại trừ trong các lớp hoạt động nối liền nhau bằng đồng.
Một mô hình thiết kế tiền chất nguồn đơn lẻ mới, hóa trị 0 đã được Schneider và ctv đề ra với (1,5-cyclooctadien)(toluen)Ru(0) ((1,5-COD)(toluen)Ru)[12] và (1,3-cyclohexadien)(benzen)Ru(0) ((1,3-CHD)(benzen)Ru)[11], cũng được thử nghiệm độc lập bởi Choi và ctv.[26] Sử dụng (1,5-COD)(toluen)Ru, Schneider phát hiện thấy các liên kết C-H dễ dàng hoạt hóa trong 1,5-COD. Mặc dù mức hợp nhất cacbon là thấp (1-3%), nhưng tốc độ phát triển chỉ ở mức khoảng 0,28 nm/phút khi tốt nhất. Sử dụng (1,3-CHD)(benzen)Ru thì 1,3-CHD bị khử hiđrô thành benzen như dự kiến, nhưng sự đa dạng lớn của các phản ứng bề mặt có thể với sự tham dự của 2 phối thể được tạo ra trong cửa sổ quy trình hẹp, trong đó hàm lượng cacbon là thấp.
Ứng dụng[sửa | sửa mã nguồn]
Do khả năng làm cứng platin và paladi nên rutheni được dùng trong các hợp kim platin và paladi để chế tạo các tiếp điểm điện chống mài mòn. Đôi khi nó được tạo hợp kim với vàng trong nghề kim hoàn. 0,1% rutheni được bổ sung vào titan để cải thiện khả năng chống ăn mòn của nó lên hàng trăm lần.[27]
Rutheni cũng được sử dụng trong một số các siêu hợp kim đơn tinh thể chịu nhiệt độ cao, với các ứng dụng như các cánh của tuabin trong các động cơ phản lực.
Ngòi của bút máy cũng hay được bịt đầu bằng hợp kim chứa rutheni. Từ năm 1944 trở đi, bút máy Parker 51 có ngòi làm bằng "RU", là ngòi bằng vàng 14K với mũi bịt hợp kim chứa 96,2% rutheni và 3,8% iridi.
Rutheni cũng là chất xúc tác đa năng. Sulfide hiđrô có thể bị phân tách bằng ánh sáng với xúc tác là thể vẩn lỏng chứa các hạt CdS cùng dioxide rutheni. Điều này có thể là có ích để loại bỏ H2S từ các thiết bị tinh lọc dầu mỏ và từ các quy trình công nghệ khác trong công nghiệp.
Rutheni là thành phần của các anôt oxide kim loại hỗn hợp (MMO) được dùng để bảo vệ catôt cho các kết cấu ngầm dưới nước hay dưới đất và cho các điện cực điện phân trong các công nghệ sản xuất hóa chất như clo từ nước muối.
Các phức chất kim loại hữu cơ của rutheni như cacben và allenyliden gần đây được phát hiện như là các chất xúc tác hiệu suất cao cho hoán vị olefin với các ứng dụng quan trọng trong hóa hữu cơ và hóa dược phẩm.
Một vài phức chất rutheni hấp thụ ánh sáng trong cả dải phổ nhìn thấy và đang được nghiên cứu tích cực trong nhiều công nghệ tiềm năng trong năng lượng mặt trời. Các chất nhuộm gốc rutheni được sử dụng như là nguồn tạo điện tử trong các tế bào năng lượng mặt trời nhạy thuốc nhuộm, một hệ thống tế bào năng lượng mặt trời mới đầy triển vọng với giá thành thấp.
Sự phát huỳnh quang của một vài phức chất gốc rutheni bị oxy làm tắt, vì thế chúng được dùng làm các bộ phận trong thiết bị cảm biến quang học nhận diện oxy.
Rutheni đỏ, [(NH3)5Ru-O-Ru(NH3)4-O-Ru(NH3)5]6+, là chất biến màu sinh học được sử dụng để biến màu các phân tử nhiều anion như pectin và các acid nucleic cho kính hiển vi quang và kính hiển vi điện tử.
Đồng vị phân rã beta 106 của rutheni được sử dụng trong liệu pháp phóng xạ đối với các khối u mắt, chủ yếu là u ác tính hắc tố của lớp phủ màng mạch.
Các phức chất tâm rutheni đang được nghiên cứu để tìm kiếm các tính chất chống ung thư.[28] Các phức chất này của rutheni, khác với các phức chất truyền thống của platin, thể hiện sự kháng lại thủy phân cao hơn và tác động chọn lọc hơn đối với các khối u. NAMI-A và KP1019 là hai loại dược phẩm đang được thử nghiệm và đánh giá lâm sàng về tác đụng chống các khối u di căn và ung thư ruột già.
Ứng dụng của màng mỏng rutheni trong vi điện tử[sửa | sửa mã nguồn]
Gần đây, rutheni được gợi ý như là vật liệu có thể thay thế hữu ích cho các kim loại khác và các silicit trong các thành phần vi điện tử. Tetroxide rutheni (RuO4) dễ bay hơi, giống như trioxide rutheni (RuO3).[29] Bằng cách oxy hóa rutheni (ví dụ bằng dòng oxy plasma) thành các oxide dễ bay hơi, rutheni có thể dễ dàng tạo ra các khuôn mẫu.[30][31][32][33] Các tính chất của các oxide thông thường của rutheni làm cho nó là kim loại tương thích với các kỹ thuật xử lý bán dẫn cần thiết để sản xuất các loại thiết bị vi điện tử.
Nhằm tiếp tục thu nhỏ kích thước của thiết bị vi điện tử, các vật liệu mới là cần thiết do có sự thay đổi về kích thước. Có ba ứng dụng chính cho các màng rutheni mỏng trong vi điện tử học.
Thứ nhất là sử dụng các màng mỏng rutheni như là các điện cực ở cả hai bên của pentoxide tantal (Ta2O5) hay titanat stronti bari ((Ba, Sr)TiO3, còn gọi là BST) trong các thế hệ sau của bộ nhớ truy cập ngẫu nhiên động (DRAM) ba chiều.[18][34][35] Các điện cực màng mỏng rutheni cũng có thể được phủ trên zirconat titanat chì (Pb(ZrxTi1-x)O3, hay PZT) trong kiểu khác của RAM, bộ nhớ truy cập ngẫu nhiên sắt từ (FeRAM).[36][37] Platin cũng được sử dụng như là các điện cực trong RAM trong các môi trường phòng thí nghiệm, nhưng rất khó tạo khuôn mẫu. Rutheni về mặt hóa học rất giống với platin, bảo tồn các chức năng của RAM, nhưng ngược lại với Pt ở chỗ dễ tạo khuôn mẫu hơn.
Thứ hai là sử dụng các màng mỏng rutheni như là các cổng kim loại trong các transitor hiệu ứng trường kim loại-oxide-bán dẫn kích thích kiểu p (p-MOSFET).[38] Khi thay thế cho các cổng silicit bằng các cổng kim loại trong các MOSFET, tính chất quyết định của kim loại là hàm số công của nó. Hàm số công cần phù hợp với các vật liệu bao quanh. Đối với các p-MOSFET, hàm số công của rutheni là thuộc tính vật liệu tốt nhất phù hợp với các vật liệu bao quanh như HfO2, HfSiOx, HfNOx, HfSiNOx, để thu được các tính chất điện học mong muốn.
Ứng dụng ở thang độ lớn thứ ba của màng rutheni là làm tác nhân hoạt hóa tổ hợp bám dính và lớp mầm mạ điện giữa TaN và Cu trong quy trình nạm đồng đối ngẫu.[39][40][41][42][43] Đồng có thể mạ trực tiếp trên rutheni[44], trái ngược với ni0trua tantal (TaN). Đồng cũng bám dính kém với TaN, nhưng tốt với Ru. Bằng cách trầm lắng một lớp rutheni trên lớp cản TaN, sự kết dính của đồng có thể được cải thiện và sự lắng đọng của lớp mầm đồng sẽ không còn là cần thiết.
Cũng có những ứng dụng khác. Năm 1990, các nhà khoa học của IBM phát hiện thấy một lớp mỏng các nguyên tử rutheni tạo ra sự móc nối phản song song mạnh giữa các lớp sắt từ cận kề, mạnh hơn so với bất kỳ nguyên tố tạo lớp không gian phi từ nào khác. Vì thế lớp rutheni đã được dùng trong thành phần đọc từ điện trở khổng lồ đầu tiên cho các đĩa cứng. Năm 2001, IBM thông báo một lớp dày 3 nguyên tử của rutheni, một cách không chính thức gọi là bụi yêu tinh, có thể cho phép tăng gấp 4 lần mật độ lưu trữ dữ liệu của các thiết bị đĩa cứng hiện tại.[45]
Phòng ngừa[sửa | sửa mã nguồn]
Hợp chất tetroxide rutheni (RuO4), tương tự như tetroxide osmi, là dễ bay hơi, có độc tính cao và có thể gây nổ nếu như nó tiếp xúc được với các vật liệu dễ cháy.[46] Rutheni không đóng vai trò sinh học gì nhưng có thể làm sạm màu da người, và có thể là chất gây ung thư[47] và tích lũy sinh học trong xương.
Tham khảo[sửa | sửa mã nguồn]
- ^ “Ruthenium: ruthenium(I) fluoride compound data”. OpenMOPAC.net. Bản gốc lưu trữ ngày 23 tháng 4 năm 2013. Truy cập ngày 10 tháng 12 năm 2007.
- ^ Magnetic susceptibility of the elements and inorganic compounds Lưu trữ 2012-01-12 tại Wayback Machine, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ Được cho là trải qua phân rã β+β+ thành 96Mo với chu kỳ bán rã hơn 6,7×1016 năm.
- ^ a b c d e Về mặt lý thuyết có khả năng phân hạch tự phát.
- ^ Được cho là phân rã β−β− thành 104Pd.
- ^ a b Nature's Building Block, John Emsley, Nhà in Đại học Oxford, 2001
- ^ – Giáo sư Anthony Hill – Nghiên cứu hiện tại
- ^ Manner W. L.; Girolami G. S.; Nuzzo R. G., Sequential Dehydrogenation of Unsaturated Cyclic C5 and C6 Hydrocarbons on Pt(111). J. Phys. Chem. B 1998, 102, (50), 10295-10306.
- ^ Jakob P.; Menzel D., The adsorption of benzene on Ru(001). Surface Science 1988, 210, 503-530.
- ^ a b Jakob P. Adsorption und thermische Evolution von aromatischen Molekülen auf Ru(001): Benzol, Benzol+O, CO, H und Pyridin. Doctoral, Technische Universität München, München, 1989.
- ^ a b Schneider A.; Popovska N.; Jipa I.; Atakan B.; Siddiqi M. A.; Siddiqui R.; Zenneck U., Minimizing the carbon content of thin ruthenium films by MOCVD precursor complex design and process control. Chemical Vapor Deposition 2007, 13, (8), 389-395.
- ^ a b Schneider A.; Popovska N.; Holzmann F.; Gerhard H.; Topf C.; Zenneck U., [(1,5-Cyclooctadiene)(toluene)ruthenium(0)]: A Novel Precursor for the MOCVD of Thin Ruthenium Films. Chemical Vapor Deposition 2005, 11, (2), 99-105.
- ^ Schneider A. Metallorganische Chemische Dasphasenabscheidung (MOCVD) von Übergangsmetallen am Beispiel von Eisen, Ruthenium und Wolfram. Doctoral, Universität Erlangen-Nürnberg, Erlangen, 2006.
- ^ Green M. L.; Gross M. L.; Papa L. E.; Schnoes K. J.; Brasen D., Chemical Vapor Deposition of Ruthenium and Ruthenium Dioxide Films. Journal of The Electrochemical Society 1985, (132), 2677.
- ^ Wang Q.; Ekerdt J. G.; Gay D.; Sun Y.-M.; White J. M., Low-temperature chemical vapor deposition and scaling limit of ultrathin Ru films. Applied Physics Letters 2004, 84, (8), 1380-1382.
- ^ Trent D. E.; Paris B.; Krause H. H., Vapor Deposition of Pure Ruthenium Metal from Ruthenocene. Inorg. Chem. 1964, 3, (7), 1057-1058.
- ^ Park S. E.; Kim H. M.; Kim K. B.; Min S. H., Metallorganic chemical vapor deposition of Ru and RuO2 using ruthenocene precursor and oxygen gas. Journal of the Electrochemical Society 2000, 147, (1), 203-209.
- ^ a b Aoyama T.; Eguchi K., Ruthenium films prepared by liquid source chemical vapor deposition using bis-(ethylcyclopentadienyl)ruthenium. Japanese Journal of Applied Physics 1999, 38, (10A), 1134-6.
- ^ Kang S. Y.; Choi K. H.; Lee S. K.; Hwang C. S.; Kim H. J., Thermodynamic Calculations and Metallorganic Chemical Vapor Deposition of Ruthenium Thin Films Using Bis(ethyl-pi-cyclopentadienyl)Ru for Memory Applications. Journal of The Electrochemical Society 2000, 147, (3), 1161-1167.
- ^ Matsui Y.; Hiratani M.; Nabatame T.; Shimamoto Y.; Kimura S., Characteristics of Ruthenium Films Prepared by Chemical Vapor Deposition Using Bis(ethylcyclopentadienyl)ruthenium Precursor. Electrochemical and Solid-State Letters 2002, 5, (1), C18-C21.
- ^ Nabatame T.; Hiratani M.; Kadoshima M.; Shimamoto Y.; Matsui Y.; Ohji Y.; Asano I.; Fujiwara T.; Suzuki T., Properties of ruthenium films prepared by liquid source metalorganic chemical vapor deposition using Ru(EtCp)2 with tetrahydrofuran solvent. Japanese Journal of Applied Physics 2000, 39, (11B), 1188-90.
- ^ Kadoshima M.; Nabatame T.; Hiratani M.; Nakamura Y.; Asano I.; Suzuki T., Ruthenium Films Prepared by Liquid Source Metalorganic Chemical Vapor Deposition Using Ru(dpm)3 Dissolved with Tetrahydrofuran Solvent. Japanese Journal of Applied Physics 2002, 41 Phần 2, (3B), L347-L350.
- ^ Lai Y.-H.; Chen Y.-L.; Chi Y.; Liu C.-S.; Carty A. J.; Peng S.-M.; Lee G.-H., Deposition of Ru and RuO2 thin films employing dicarbonyl bis-diketonate ruthenium complexes as CVD source reagents. Journal of Materials Chemistry 2003, 13, 1999-2006.
- ^ Lee J.-H.; Kim J.-Y.; Rhee S.-W.; Yang D.; Kim D.-H.; Yang C.-H.; Han Y.-K.; Hwang C.-J., Chemical vapor deposition of Ru thin films by direct liquid injection of Ru(OD)3 (OD=octanedionate). Journal of Vacuum Science & Technology A 2000, 18, (5), 2400-2403.
- ^ Kang S. Y.; Lim H. J.; Hwang C. S.; Kim H. J., Metallorganic chemical vapor deposition of Ru films using cyclopentadienyl-propylcyclopentadienylruthenium(II) and oxygen. Journal of the Electrochemical Society 2002, 149, (6), C317-C323.
- ^ Choi J.; Choi Y.; Hong J.; Tian H.; Roh J.-S.; Kim Y.; Chung T.-M.; Woo Oh Y.; Kim Y.; Kim C. G.; No K., Composition and Electrical Properties of Metallic Ru Thin Films Deposited Using Ru(C6H6)(C6H8) Precursor. Japanese Journal of Applied Physics 2002, 41, (11B), 6852-6856.
- ^ It's Elemental - Ruthenium
- ^ Richards A.D. & Rodger A. (2007). Synthetic metallomolecules as agents for the control of DNA structure Chem. Soc. Rev. 36 471-483.
- ^ Wei P.; Desu S. B., Reactive ion etching of RuO2 films: the role of additive gases in O2 discharge. Physica Status Solidi A 1997, 161, (1), 201-15.
- ^ Lesaicherre P. Y.; Yamamichi S.; Takemura K.; Yamaguchi H.; Tokashiki K.; Miyasaka Y.; Yoshida M.; Ono H., A Gbit-scale DRAM stacked capacitor with ECR MOCVD SrTiO3 over RIE patterned RuO2/TiN storage nodes. Integrated Ferroelectrics 1995, 11, (1-4), 81-100.
- ^ Pan W.; Desu S. B., Reactive Ion Etching of RuO2, Thin-Films Using the Gas-Mixture O2 Cf3cfh2. Journal of Vacuum Science & Technology B 1994, 12, (6), 3208-3213.
- ^ Vijay D. P.; Desu S. B.; Pan W., Reactive Ion Etching of Lead-Zirconate-Titanate (PZT) Thin-Film Capacitors. Journal of the Electrochemical Society 1993, 140, (9), 2635-2639.
- ^ Saito S.; Kuramasu K., Plasma etching of RuO2 thin films. Japanese Journal of Applied Physics 1992, 31, (1), 135-8.
- ^ Iizuka T.; Arita K.; Yamamoto I.; Yamamichi S., (Ba,Sr)TiO3 thin film capacitors with Ru electrodes for application to ULSI processes. NEC Research and Development 2001, 42, (1), 64-9.
- ^ Yamamichi S.; Lesaicherre P. Y.; Yamaguchi H.; Takemura K.; Sone S.; Yabuta H.; Sato K.; Tamura T.; Nakajima K.; Ohnishi S.; Tokashiki K.; Hayashi Y.; Kato Y.; Miyasaka Y.; Yoshida M.; Ono H., A stacked capacitor technology with ECR plasma MOCVD (Ba,Sr)TiO3 and RuO2/Ru/TiN/TiSix storage nodes for Gb-scale DRAM's. IEEE Transactions on Electron Devices 1997, 44, (7), 1076-1083.
- ^ Bandaru J.; Sands T.; Tsakalakos L., Simple Ru electrode scheme for ferroelectric (Pb,La)(Zr,Ti)O3 capacitors directly on silicon. Journal of Applied Physics 1998, 84, (2), 1121-1125.
- ^ Maiwa H.; Ichinose N.; Okazaki K., Preparation and properties of Ru and RuO2 thin film electrodes for ferroelectric thin films. Jpn. J. Appl. Phys. 1994, 33, (9B), 5223-6.
- ^ Misra V.; Lucovsky G.; Parsons G., Issues in high-kappa gate stack interfaces. MRS Bulletin 2002, 27, (3), 212-216.
- ^ Chan R.; Arunagiri T. N.; Zhang Y.; Chyan O.; Wallace R. M.; Kim M. J.; Hurd T. Q., Diffusion Studies of Copper on Ruthenium Thin Film. Electrochemical and Solid-State Letters 2004, 7, (8), G154-G157.
- ^ Cho S. K.; Kim S.-K.; Kim J. J.; Oh S. M., Damascene Cu electrodeposition on metal organic chemical vapor deposition-grown Ru thin film barrier. Journal of Vacuum Science and Technology B 2004, 22, (6), 2649-2653.
- ^ Chyan O.; Arunagiri T. N.; Ponnuswamy T., Electrodeposition of Copper Thin Film on Ruthenium. Journal of The Electrochemical Society 2003, 150, (5), C347-C350.
- ^ Kwon O.-K.; Kwon S.-H.; Park H.-S.; Kang S.-W., PEALD of a Ruthenium Adhesion Layer for Copper Interconnects. Journal of The Electrochemical Society 2004, 151, (12), C753-C756.
- ^ Kwon O.-K.; Kim J.-H.; Park H.-S.; Kang S.-W., Atomic Layer Deposition of Ruthenium Thin Films for Copper Glue Layer. Journal of The Electrochemical Society 2004, 151, (2), G109-G112.
- ^ Moffat T. P.; Walker M.; Chen P. J.; Bonevich J. E.; Egelhoff W. F.; Richter L.; Witt C.; Aaltonen T.; Ritala M.; Leskelä M.; Josella D., Electrodeposition of Cu on Ru Barrier Layers for Damascene Processing. Journal of The Electrochemical Society 2006, 153, (1), C37-C50.
- ^ Brian Hayes, Terabyte Territory Lưu trữ 2008-04-14 tại Wayback Machine, American Scientist, quyển 90 số 3 (tháng 5/6-2002) trang 212
- ^ Ruthenium Tetroxide and Other Ruthenium Compounds?[liên kết hỏng]
- ^ inhalation of radionuclides and carcinogenesis
- Phòng thí nghiệm quốc gia Los Alamos – Rutheni Lưu trữ 2007-04-05 tại Wayback Machine
Liên kết ngoài[sửa | sửa mã nguồn]
| Wikimedia Commons có thêm hình ảnh và phương tiện truyền tải về Rutheni. |
| Tra ruthenium hoặc Rutheni trong từ điển mở tiếng Việt Wiktionary |
- Nano-layer of ruthenium stabilizes magnetic sensors Lưu trữ 2016-04-05 tại Wayback Machine
- WebElements.com – Ruthenium
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |

