Caesi
| Caesi, 55Cs | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Quang phổ của caesi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất chung | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tên, ký hiệu | Caesi, Cs | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phiên âm | /ˈsiːziəm/ SEE-zee-əm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hình dạng | Bạc ngà | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Caesi trong bảng tuần hoàn | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số nguyên tử (Z) | 55 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Khối lượng nguyên tử chuẩn (±) (Ar) | 132,9054519(6)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Phân loại | kim loại kiềm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhóm, phân lớp | 1, s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chu kỳ | Chu kỳ 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cấu hình electron | [Xe] 6s1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
mỗi lớp | 2, 8, 18, 18, 8, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất vật lý | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Màu sắc | Bạc ngà | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái vật chất | Chất lỏng | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt độ nóng chảy | 301,59 K (28,44 °C, 83,19 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt độ sôi | 944 K (671 °C, 1240 °F) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mật độ | 1,93 g·cm−3 (ở 0 °C, 101.325 kPa) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mật độ ở thể lỏng | ở nhiệt độ nóng chảy: 1,843 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Điểm tới hạn | 1.938 K, 9,4 MPa[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt lượng nóng chảy | 2,09 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt bay hơi | 63,9 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nhiệt dung | 32,210 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Áp suất hơi
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất nguyên tử | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Trạng thái oxy hóa | +1, −1[3] Bazơ mạnh | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ âm điện | 0,79 (Thang Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Năng lượng ion hóa | Thứ nhất: 375,7 kJ·mol−1 Thứ hai: 2.234,3 kJ·mol−1 Thứ ba: 3.400 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính cộng hoá trị | thực nghiệm: 265 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính liên kết cộng hóa trị | 244±11 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bán kính van der Waals | 343 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Thông tin khác | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cấu trúc tinh thể | Lập phương tâm khối | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ giãn nở nhiệt | 97 µm·m−1·K−1 (ở 25 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ dẫn nhiệt | 35,9 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Điện trở suất | ở 20 °C: 205 n Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tính chất từ | Thuận từ[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun Young | 1,7 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mô đun khối | 1,6 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ cứng theo thang Mohs | 0,2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Độ cứng theo thang Brinell | 0,14 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Số đăng ký CAS | 7440-46-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Đồng vị ổn định nhất | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bài chính: Đồng vị của Caesi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Caesi (hay còn gọi là Xê-si, tiếng Anh: cesium, tiếng Latinh: "caesius")[ghi chú 1] là một nguyên tố hóa học trong bảng tuần hoàn có ký hiệu Cs và số nguyên tử bằng 55. Nó là một kim loại kiềm mềm, màu bạc, và với điểm nóng chảy là 28,4 °C (83,1 °F) khiến cho nó trở thành một trong các kim loại ở dạng lỏng tại hay gần nhiệt độ phòng.[ghi chú 2] Caesi là một kim loại kiềm, có tính chất vật lý và hóa học giống với rubidi, kali; là kim loại hoạt động mạnh, có khả năng tự cháy, phản ứng với nước thậm chí ở nhiệt độ −116 °C (−177 °F). Nó là nguyên tố có độ âm điện thấp thứ hai sau franci, và chỉ có một đồng vị bền là caesi-133. Caesi được khai thác trong mỏ chủ yếu từ khoáng chất pollucit, trong khi các đồng vị phóng xạ khác, đặc biệt là caesi-137 - một sản phẩm phân hạch hạt nhân, được tách ra từ chất thải của các lò phản ứng hạt nhân.
Nhà hóa học người Đức Robert Bunsen và nhà vật lý học Gustav Robert Kirchhoff đã phát hiện ra caesi năm 1860 bằng một phương pháp mới được phát triển là "quang phổ phát xạ nung bằng ngọn lửa". Các ứng dụng quy mô nhỏ đầu tiên của caesi là "chất bắt giữ" trong ống chân không và trong tế bào quang điện. Năm 1967, dựa trên nguyên lý của Einstein về sự không đổi của tốc độ ánh sáng trong vũ trụ, Ủy ban Quốc tế về Cân đo đã tách biệt hệ đếm 2 sóng riêng biệt từ quang phổ phát xạ của caesi-133 để đồng định nghĩa giây và mét trong hệ SI. Từ đó caesi được ứng dụng rộng rãi trong các đồng hồ nguyên tử độ chính xác cao.
Từ thập niên 1990, ứng dụng của nguyên tố này trên quy mô lớn nhất là caesi format trong dung dịch khoan. Nó có nhiều ứng dụng trong kỹ thuật điện, điện tử, và hóa học. Đồng vị phóng xạ caesi-137[9] có chu kỳ bán rã khoảng 30 năm và được sử dụng trong y học, thiết bị đo công nghiệp và thủy văn học. Mặc dù nguyên tố chỉ có độ độc tính trung bình, nó là vật liệu nguy hại ở dạng kim loại và các đồng vị phóng xạ của nó ảnh hưởng đến sức khỏe cao nếu được phóng thích ra môi trường.
Đặc trưng
[sửa | sửa mã nguồn]Tính chất vật lý
[sửa | sửa mã nguồn]
Caesi là một kim loại có màu nhạt rất dẻo, độ cứng thấp và rất mềm (độ cứng của nó là 0,2, là nguyên tố mềm nhất), nó chuyển sang màu tối khi có mặt oxy ở dạng vết.[10][11][12] Caesi có điểm nóng chảy ở 28,4 °C (83,1 °F), là một trong ít các kim loại nguyên tố ở dạng lỏng trong điều kiện gần nhiệt độ phòng. Thủy ngân là kim loại nguyên tố duy nhất có điểm nóng chảy thấp hơn caesi.[ghi chú 3][14] Thêm vào đó, kim loại caesi có điểm sôi khá thấp, 641 °C (1.186 °F), thấp thứ hai trong tất cả các kim loại, sau thủy ngân.[15] Các hợp chất của nó cháy cho ngọn lửa màu xanh dương[16][17] hoặc tím.[17]

Caesi tạo hợp kim với các kim loại kiềm khác, cũng như với vàng, và tạo hỗn hống với thủy ngân. Ở nhiệt độ dưới 650 °C (1.202 °F), nó không tạo hợp kim với cobalt, sắt, molybden, nickel, platin, tantal hay wolfram. Nó tạo thành các hợp chất đa kim với antimon, gali, indi và thori, có tính cảm quang.[10] Caesi tạo hỗn hợp với đa số các kim loại kiềm, trừ lithi; hợp kim với tỉ lệ mol chiếm 41% caesi, 47% kali, và 12% natri có điểm nóng chảy thấp nhất trong bất kỳ hợp kim kim loại nào đã được biết đến, ở −78 °C (−108 °F).[14][18] Một vài hỗn hống đã được nghiên cứu như: CsHg
2 có màu đen tạo ra ánh kim màu tía, trong khi CsHg có màu vàng ánh bạc.[19]
Tính chất hóa học
[sửa | sửa mã nguồn]Kim loại caesi có độ hoạt động mạnh và tự bốc cháy. Nó phản ứng nổ với nước thậm chí ở nhiệt độ thấp, mạnh hơn các kim loại khác trong nhóm 1.[10] Phản ứng với nước đá ở nhiệt độ thấp −116 °C (−177 °F).[14] Do có tính hoạt động mạnh, kim loại caesi được xếp vào nhóm vật liệu nguy hại. Nó được trữ và vận chuyển trong hydrocarbon khô, như dầu khoáng. Tương tự, nó phải được xử lý trong khí trơ như argon. Tuy nhiên, phản ứng nổ caesi-nước thường ít mạnh hơn phản ứng nổ natri-nước với cùng một lượng natri. Điều này là do caesi phát nổ ngay lập tức khi tiếp xúc với nước, nên có ít thời gian để tích tụ hydro.[20] Caesi có thể được chứa trong ống thủy tinh borosilicat được hút chân không. Với một lượng hơn 100 gam (3,5 oz), caesi được vận chuyển trong các thùng chứa bằng thép không gỉ được bịt kín.[10]
Tính chất hóa học của caesi tương tự các kim loại kiếm khác như gần với tính chất của rubidi hơn.[21] Là một kim loại kiềm, trạng thái oxy hóa phổ biến của nó là +1.[ghi chú 4] Có một số khác biệt nhỏ từ thực tế rằng nó khối lượng nguyên tử lớn hơn và độ dương điện lớn hơn so với các kim loại kiềm khác.[23] Caesi là nguyên tố hóa học có độ dương điện cao nhất.[ghi chú 5][14] Ion caesi cũng lớn hơn và ít "cứng" hơn so với các kim loại kiềm nhẹ hơn.
Hợp chất
[sửa | sửa mã nguồn]
Phần lớn các hợp chất của caesi chứa nguyên tố ở dạng cation Cs+
, nó tạo liên kết ion với nhiều loại anion. Một ngoại lệ đáng chú ý là trường hợp anion caesua (Cs−
).[3] Các ngoại lệ khác bao gồm nhiều suboxide (xem phần các oxide bên dưới).
Đối với các hợp chất thông thường, các muối Cs+ hầu như không màu trừ anion là có màu. Nhiều muối đơn giản là hygroscopic, nhưng ít hơn so với các muối tương ứng của các kim loại kiềm nhẹ hơn. Các muối phosphat,[25] acetat, carbonat, halide, oxide, nitrat, và sulfat đều tan trong nước. Các muối kép thường ít tan hơn, và tính tan thấp của caesi nhôm sulfat được khai thác để lấy Cs từ quặng của nó. Muối kép với antimon (như CsSbCl
4), bismuth, cadmi, đồng, sắt, và chì cũng ít tan.[10]
Caesi hydroxide (CsOH) là một base cực mạnh[21] và sẽ nhanh chóng ăn mòn bề mặt của bán dẫn như silicon.[26] CsOH thông thường được coi là "base mạnh nhất", phản ánh tính hút tương đối yếu giữa ion lớn Cs+ và OH−;[16] nhưng trên thực tế thì nhiều hợp chất khác không tan trong dung dịch, như n-butyllithi (C4H9Li) hay amit natri (NaNH2)[21] là các base mạnh hơn.
Hỗn hợp cân bằng hóa học của caesi và vàng sẽ phản ứng để tạo thành caesi auride vàng (Cs+Au−) trong điều kiện nung. Anion auride có ứng xử như một giả halogen. Hợp chất phản ứng mãnh liệt với nước tạo caesi hydroxide, vàng kim loại, và khí hydro; trong amonia lỏng nó có thể phản ứng với một loại nhựa trao đổi ion caesi đặc biệt tạo ra tetramethylammonium auride. Hợp chất với platin tương tự như caesi platinide đỏ (Cs2Pt) chứa ion platinide có ứng xử như một giả chalcogen.[27]
Phức
[sửa | sửa mã nguồn]Giống như các cation kim loại, Cs+ tạo phức với các base Lewis trong dung dịch. Do có kích thước lớn, Cs+ thường có số phối trí lớn hơn 6, là điển hình cho các cation kim loại kiềm nhẹ hơn. Xu hướng này thể hiện rõ bởi số phối trí 9 trong CsCl, so với mẫu halit khi các kim loại kiềm khác liên kết với chlorine. Nó có số phối trí cao và mềm (khuynh hướng tạo thành liên kết cộng hóa trị) là điểm cơ bản để tách Cs+ ra khỏi các cation khác, như xử lý chất thải hạt nhân khi 137Cs+ được tác ra khỏi một lượng lớn K+ không phóng xạ.[28]
Halide
[sửa | sửa mã nguồn]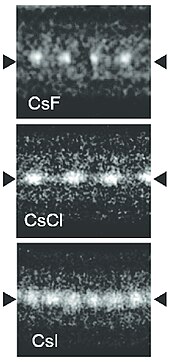
Caesi fluoride (CsF) là một chất rắn màu trắng háo nước được sử dụng rộng rãi trong hóa học carbon-fluor làm nguồn cung cấp anion fluoride.[30] Caesi fluoride có cấu trúc giống halit, nghĩa là các ion Cs+ và F− xếp trong một hình lập phương kết chặt giống như Na+ và Cl− trong natri chloride.[21]
Caesi chloride (CsCl) kết tinh theo hệ lập phương, còn được gọi là cấu trúc caesi chloride.[23] Kiểu cấu trúc này là một ô mạng lập phương nguyên thủy với một đơn vị cơ bản gồm 2 nguyên tử, mỗi nguyên tử có số phối trí là 8; các nguyên tử chloride nằm trên các đinh của ô mạng, còn caesi nằm ở trọng tâm của hình lập phương. Cấu trúc này giống với CsBr và CsI, và nhiều hợp chất khác không chứa Cs.[23] Cấu trúc CsCl được tham chiếu vì Cs+ có bán kính ion là 174 pm và Cl−
181 pm.[31]
Oxide
[sửa | sửa mã nguồn]
11O
3
Caesi tạo nhiều hợp chất hai cấu tử với oxy hơn các kim loại kiềm khác. Khi cháy trong không khí, superoxide CsO
2 là sản phẩm chính.[32] Caesi oxide (Cs
2O) "bình thường" tạo các tinh thể hệ sáu phương có màu vàng cam,[33] và chỉ có oxide loại anti-CdCl
2.[34] Nó hóa hơi ở 250 °C (482 °F), và phân hủy thành kim loại caesi và peroxide Cs
2O
2 ở nhiệt độ trên 400 °C (752 °F).[35] Ngoài các superoxide và ozonide CsO
3,[36][37] nhiều suboxide có màu sáng cũng được nghiên cứu,[38] như Cs
7O, Cs
4O, Cs
11O
3, Cs
3O (lục sẫm[39]), CsO, Cs
3O
2,[40] hay Cs
7O
2.[41][42] Chất Cs
7O
2 có thể được nung trong chân không để tạo ra Cs
2O.[34] Hợp chất hai cấu tử với lưu huỳnh, seleni, và teluri cũng tồn tại.[10]
Phổ biến
[sửa | sửa mã nguồn]
Caesi là một nguyên tố tương đối hiếm vì nó chiếm trung bình khoảng 3 ppm trong vỏ Trái Đất.[43] Nguyên tố này phổ biến thứ 45 trong số các nguyên tố và thứ 36 trong nhóm kim loại. Tuy vậy, nó phổ biến hơn các nguyên tố như antimon, cadmi, thiếc và wolfram, và lớn gấp 20 lần so với thủy ngân hoặc bạc, nhưng chỉ hơn 3,3% so với rubidi là loại cộng sinh với nó.[10]
Do có bán kính ion lớn, caesi là một trong những nguyên tố không tương hợp trong việc thay thế với các nguyên tố khác trong ô mạng tinh thể.[44] Trong sự kết tinh phân đoạn mắc ma, caesi được tập trung ở pha lỏng và kết tinh sau cùng. Do đó, các mỏ caesi lớn nhất là các thân quặng pecmatit được hình thành từ quá trình làm giàu quặng này. Do caesi không thể thay thế kali cũng như rubidi, các khoáng vật kiềm hình thành do quá trình bay hơi như sylvit (KCl) và cacnallit (KMgCl
3·6H
2O) chỉ có thể chứa 0,002% caesi. Từ đó, Cs được tìm thấy trong ít khoáng vật. Một phần caesi có thể được tìm thấy trong beryl (Be
3Al
2(SiO
3)
6) và avogadrit ((K,Cs)BF
4), lên đến 15% Cs2O trong khoáng pezzottait (Cs(Be2Li)Al2Si6O18), lên đến 8,4% Cs2O trong londonit ((Cs,K)Al
4Be
4(B,Be)
12O
28), và ít phổ biến hơn trong rhodizit.[10] Nguồn khoáng sản duy nhất quan trọng có giá trị kinh tế của caesi là pollucit Cs(AlSi
2O
6), nó được tìm thấy ở một vài nơi trên thế giới trong các pecmatit, và đồng sinh với nguyên tố có giá trị hơn là lithi trong lepidolit và petalit. Trong pecmatit, các hạt có kích thước lớn và các khoáng vật bị chia tách rõ tạo ra một loại quặng cao cấp trong khai thác mỏ.[45]
Một trong những nguồn tài nguyên giàu caesi và quan trọng nhất trên thế giới là mỏ Tanco ở Bernic Lake, Manitoba, Canada. Mỏ được ước tính chứa 350.000 tấn quặng pollucit, chiếm 2/3 trữ lượng trên thế giới.[45][46] Mặc dù cân bằng hàm lượng caesi trong pollucit là 42,6%, các mẫu pollucit tinh khiết từ mỏ này có thể chỉ chiếm khoảng 34% caesi, trong khi hàm lượng trung bình 24wt%.[46] Pollucit thương mại chứa hơn 19% caesi.[47] Mỏ pecmatit Bikita ở Zimbabwe được khai thác để lấy petalit, nhưng nó chỉ chứa một lượng đáng kể pollucit. Một lượng pollucit khá phong phú cũng được khai thác ở sa mạc Karibib, Namibia.[46] Với tốc độ khai thác các mỏ trên thế giới hiện nay với sản lượng 5 đến 10 tấn mỗn năm, với trữ lượng hiện tại việc khai thác có thể kéo dài hàng ngàn năm.[10]
Đồng vị
[sửa | sửa mã nguồn]Caesi có ít nhất 39 đồng vị đã biết, là nhiều hơn bất kỳ một nguyên tố nào (ngoại trừ franci). Nguyên tử lượng của các đồng vị này nằm trong khoảng từ 112 tới 151. Nhiều trong số này được tổng hợp từ các nguyên tố nhẹ hơn bằng quá trình bắt neutron chậm (quá trình S) bên trong các sao già,[48] cũng như trong các vụ nổ siêu tân tinh (quá trình R).[49] Mặc dù có nhiều đồng vị như vậy, song caesi chỉ có 1 đồng vị ổn định trong tự nhiên là Cs133 có 78 neutron. Mặc dù nó có spin hạt nhân lớn (7⁄2+), các nghiên cứu cộng hưởng từ hạt nhân có thể được tiến hành trên đồng vị này ở tần số cộng hưởng 11,7 MHz.[50]

135Cs có chu kỳ bán rã rất dài khoảng 2,3 triệu năm, dài nhất trong tất cả các đồng vị của caesi. 137Cs và 134Cs có chu kỳ bán rã lần lượt là 30 và 2 năm.137Cs phân rã beta tạo thành đồng vị 137mBa có thời gian tồn tại ngắn, và sau đó thành bari không phóng xạ, trong khi 134Cs chuyển trực tiếp thành 134Ba. Các đồng vị có số khối 129, 131, 132 và 136 có chu kỳ bán rã từ một ngày đến hai tuần, trong khi hầu hết các đồng vị còn lại có chu kỳ bán rã từ vài giây đến một giây. Có ít nhất 21 đồng phân hạt nhân ở trạng thái kích thích. Ngoài 134mCs (có chu kỳ bán rã dưới 3 giờ), tất cả đều rất không bền và phân rã có chu kỳ vài phút hay ngắn hơn.[51][52]
Đồng vị 135Cs là một trong những sản phẩm phân hạch hạt nhân của urani có thời gian tồn tại lâu, nó được tạo ra trong các lò phản ứng hạt nhân.[53] Tuy nhiên, sản lượng sản phẩm phân hạch của nó bị giảm trong hầu hết các lò phản ứng do nguyên tử trước đó của nó, 135Xe, là một neutron cực kỳ động và chuyển hóa thường xuyên thành 136Xe bền trước khi phân rã thành 135Cs.[54][55]
Do phân rã beta của nó (thành 137mBa), 137Cs là một nguồn phát phóng xạ gamma mạnh.[56] Chu kỳ bán rã của làm nó trở thành một sản phẩm phân hạch có thời gian tồn tại trung bình cùng với 90Sr—cả hai góp phần phát ra phóng xạ của các nhiên liệu hạt nhân đã qua sử dụng sau nhiều năm làm lạnh cho đến hàng trăm năm sau khi sử dụng.[57] Ví dụ, 137Cs cùng với 90Sr hiện tạo ra một nguồn phóng xạ lớn nhất ở khu vực xung quanh thảm họa Chernobyl.[58] Không khả thi để xử lý 137Cs bằng bắt neutron (do tỉ lệ bắt giữ thấp) và kết quả là nó phải được để cho phân rã.[59]
Hầu như tất cả caesi được tạo ra từ phân hạch hạt nhân đều từ phân rã beta của các sản phẩm phân hạch giàu neutron hơn, trải qua nhiều đồng vị iod và xenon khác nhau.[60] Do iod và xenon có bay hơi và có thể phân tán qua nhiên liệu hạt nhân hoặc không khí, caesi phóng xạ thường được tạo ra rất xa nguồn phân hạch.[61] Với vụ thử vũ khí hạt nhân khoảng năm 1945, 137Cs đã được giải phóng vào khí quyển và sau đó vào bề mặt Trái Đất ở dạng bụi phóng xạ.[10]
Sản xuất
[sửa | sửa mã nguồn]Khai thác quặng pollucit là một phương án sản xuất caesi và được tiến hành trên quy mô nhỏ so với hầu hết các mỏ kim loại khác. Quặng được nghiền, sàng, nhưng thường không tập trung, và sau đó nghiền mịn. Caesi sau đó được chiết tác từ chủ yếu pollucit bởi ba phương pháp: hòa tan bằng acid, phân rã kềm, và khử trực tiếp.[10][62]
Hòa tan acid, đá pollucit silicat được hòa tan trong các acid mạnh như acid hydrochloric (HCl), acid sulfuric (H
2SO
4), acid hydrobromic (HBr), hay acid hydrofluoric (HF). Với acid hydrochloric sẽ tạo ra hỗn hợp chloride tan và vác muối kép chloride không tan của caesi được kết tủa ở dạng caesi antimon chloride (Cs
4SbCl
7), caesi iod chloride (Cs
2ICl), hay caesi hexachlorocerat (Cs
2(CeCl
6)). sau khi tách, muối kép đã được kết tủa ở dạng tinh khiết được phân hủy, và thu được CsCl tinh khiết sau khi cho nước bốc hơi. Phương pháp sử dụng acid sulfuric cho ra muối kép không tan trực tiếp ở dạng phèn caesi (CsAl(SO
4)
2·12H
2O). Nhôm sulfat trong dung dịch được chuyển thành nhôm oxide không tan bằng cách nung phèn với carbon, và sản phẩm được thủy luyện với nước để tạo ra dung dịch Cs
2SO
4.[10]
Nung pollucit với calci carbonat và calci chloride tạo ra các calci silicat không tan và caesi chloride tan. Dùng nước hoặc amonia loãng (NH
4OH) tạo ra dung dịch chloride loãng (CsCl). Dung dịch này có thể cho bốc hơi tạo ra caesi chlorat hoặc chuyển thành phèn caesi hay caesi carbonat. Dù không có tính thương mại, việc khử trực tiếp quặng với kali, natri hay calcin trong chân không cũng tạo ra trực tiếp kim loại caesi.[10]
Hầu hết caesi được khai thác (ở dạng muối) được chuyển trực tiếp thành caesi format (HCOO−Cs+) cho các ứng dụng như khoan dầu. Để cung cấp cho sự phát triển của thị trường, Cabot Corporation đã xây dựng nhà máy năm 1997 ở mỏ Tanco gần Bernic Lake, Manitoba, với công suất 12.000 thùng (1.900 m3) mỗi năm ở dạng dung dịch caesi format.[63] Các hợp chất của caesi được sản xuất ở quy mô nhỏ ban đầu là caesi chloride và các nitrat của nó.[64]
Ngoài ra, kim loại caesi có thể thu được từ các hợp chất được làm tinh khiết từ quặng. Caesi chloride và các caesi halide khác có thể được khử ở 700 đến 800 °C (1.292 đến 1.472 °F) với calci hoặc bari, sau đó chưng cất kim loại. Bằng cách tương tự, aluminat, carbonat, hay hydroxide có thể được khử bằng magnesi.[10] Kim loại cũng có thể được tách ra bằng điện phân dung dịch caesi cyanide (CsCN). Ngoại lệ, caesi dạng khí và tinh khiết có thể được tạo ra bằng cách nhiệt phân caesi azua CsN
3 ở 390 °C (734 °F), loại Cyanide này được tạo ra từ dung dịch caesi sulfat và bạc azide.[62] Trong các ứng dụng chân không, caesi dichromat có thể được phản ứng với zirconi tạo ra kim loại caesi tinh khiết mà không tạo ra các sản phẩm khí khác.[64]
- Cs
2Cr
2O
7 + 2 Zr → 2 Cs + 2 ZrO
2+ Cr
2O
3
Giá caesi kim loại tinh khiết 99,8% năm 2009 khoảng 10 USD một gram (280 USD một ounce), nhưng các hợp chất của nó rẻ hơn đáng kể.[46]
Lịch sử
[sửa | sửa mã nguồn]
Caesi (tiếng Latinh caesius có nghĩa là "thiên thanh" hay "lam nhạt") được Robert Bunsen và Gustav Kirchhoff phát hiện nhờ quang phổ năm 1860 trong nước khoáng lấy từ Dürbheim, Đức.[ghi chú 6][65][66][67] Việc xác định nó dựa trên các vạch màu lam nhạt trong quang phổ của nó và nó là nguyên tố đầu tiên được phát hiện nhờ phân tích quang phổ, chỉ một năm sau khi Bunsen và Kirchhoff phát minh ra kính quang phổ.[14]
Để thu được một mẫu caesi tinh khiết, 44.000 lit nước khoáng đã được cho bốc hơi tạo ra 240 kilôgam (530 lb) dung dịch muối. Các kim loại kiềm thổ được kết tủa ở dạng sulfat hoặc oxalat, để lại các kim loại kiềm trong dung dịch. Sau khi chuyển thành các nitrat và tách ra bằng ethanol thì thu được một hỗn hợp không chứa natri. Từ hỗn hợp này, lithi được kết tũa bằng amoni carbonat. Kali, rubidi và caesi tạo thành các muối không tan với acid chloroplatinic, nhưng các muối này có độ hòa tan hơi khác nhau trong nước nóng. Do đó, caesi và rubidi hexachloroplatinat ((Cs,Rb)2PtCl6) ít tan hơn có thể thu được từ kết tinh phân đoạn. Sau khi khử hexachloroplatinat bằng hydro, caesi và rubidi có thể được tách ra dựa trên tính tan khác nhau của dạng carbonat của chúng trong cồn. Quá trình này tạo ra 9,2 gam (0,32 oz) rubidi chloride và 7,3 gam (0,26 oz) caesi chloride từ 44.000 lit nước khoáng ban đầu.[66]
Hai nhà khoa học đã sử dụng caesi chloride này để tính toán khối lượng nguyên tử của nguyên tố mới là 123,35 (so với con số hiện tại được chấp nhận là 132,9).[66] Họ đã cố gắng tạo ra caesi nguyên tố bằng cách điện phân caesi chloride nóng chảy, nhưng thay vì tạo ra kim loại, thì họ thu được một chất màu xanh đồng nhất "không thể nhìn bằng mắt thường cũng như bằng kính hiển vi" có thể thấy được kim loại ở dạng vết nhỏ nhất"; kết quả là họ đã gán cho nó tên là subchloride (Cs
2Cl). Trong thực tế, sản phẩm họ tạo ra có thể là một hỗn hợp keo của caesi kim loại và caesi chloride.[68] Việc điện phân dung dịch chloride với anot thủy ngân tạo ra hỗn hống caesi sẵn sàng phân hủy trong các điều kiện dung dịch.[66] Kim loại tinh khiết cuối cùng cũng được nhà hóa học Đức Carl Setterberg tách ra khi nghiên cứu luận án tiến sĩ của ông với Kekulé và Bunsen.[67] Năm 1882, ông tạo ra kim loại caesi bằng cách điện phân caesi cyanide, và điều này đã tránh các vấn đề như đã gặp khi sử dụng chloride.[69]
Trong lịch sử, ứng dụng quan trọng nhất của caesi là trong nghiên cứu và phát triển, chủ yếu là lĩnh vực điện và hóa. Rất ít ứng dụng phát triển trên caesi mãi cho đến thập niên 1920, khi nó được sử dụng trong các ống chân không radio. Nó có hai chức năng; là một getter, nó loại bỏ oxy thừa sau khi chế tạo, và làm chất áo trên cathode được nung nóng, nó làm tăng độ dẫn điện. Caesi không được công nhận là một kim loại trong công nghiệp hiệu suất cao mãi cho đến thập niên 1950.[70] Những ứng dụng của caesi không phóng xạ như tế bào năng lượng, photomultiplier, các bộ phận quang học của kính hồng ngoại, chất xúc tác cho một số phản ứng hữu cơ, các tinh thể dùng trong máy đếm nhấp nháy, và trong máy phát điện MHD.[10] Caesi cũng và vẫn được sử dụng làm nguồn cung cấp các ion dương trong quang phổ khối ion thứ cấp (secondary ion mass spectrometry).
Từ năm 1967, Hệ đo lường quốc tế xác định giây dựa trên tính chất của caesi. Hệ SI định nghĩa một giây là 9.192.631.770 chu kỳ phân rã tương ứng với sự chuyển hai mức năng lượng từ trạng thái ổn định của nguyên tử caesi-133.[71]
Ứng dụng
[sửa | sửa mã nguồn]Thăm dò dầu khí
[sửa | sửa mã nguồn]Có lẽ ứng dụng phổ biến nhất của caesi hiện nay là trong các dung dịch khoan dựa trên caesi format (Cs(HCOO)) trong công nghiệp khai thác dầu mỏ.[10] Dung dịch gốc nước của caesi format (HCOO−Cs+)—được tạo ra từ phản ứng của caesi hydroxide với acid formic—được phát triển giữa thập niên 1990 được sử dụng trong khoan giếng dầu và dung dịch hoàn thiện giếng. Chức năng của dung dịch khoan là bôi trơn mũi khoan, mang mùn khoan lên trên bề mặt, và duy trì áp suất thành hệ trong quá trình khoan giếng. Các dung dịch hoàn thiện hỗ trợ cho việc lắp đặt các thiết bị điều khiển (phần cứng) sau khi khoan nhưng phải trước khi khai thác để duy trì áp suất.[10] Tỷ trọng cao của format caesi (tới 2,3 sg),[72] cùng với tính tương đối lành tính của các hợp chất Cs, làm giảm các yêu cầu đối với các chất rắn huyền phù tỷ trọng cao và có độc trong dung dịch khoan, làm cho nó có một số ưu thế đáng kể về mặt công nghệ, môi trường và công trình.[73][74] Caesi format có thể được trộn với kali và natri format để giảm tỉ trọng dung dịch xuống bằng với tỉ trọng của nước (1.0 g·cm−3). Hơn nữa, nó có thể tự phân hủy và tái sử dụng, và có thể được tái chế, đây là một điểm quan trọng vì chi phí cao của nó (khoảng $4.000 một Barrel năm 2001).[75] Các format kiềm thì an toàn trong vận chuyển và không phá hỏng thành hệ hoặc các kim loại chìm xuống lỗ khoan như những muối tỉ trọng cao ăn mòn thay thế (như dung dịch kẽm bromide ZnBr
2); chúng cũng ít cần làm sạch hơn và giảm chi phí đổ thải.[10]
Đồng hồ nguyên tử
[sửa | sửa mã nguồn]Caesi cũng đáng chú ý vì các sử dụng trong đồng hồ nguyên tử, với độ chính xác ở mức giây trong hàng nghìn năm. Kể từ năm 1967, đơn vị đo lường thời gian của Hệ đo lường quốc tế (SI), giây, là dựa trên các thuộc tính của nguyên tử caesi. SI định nghĩa giây bằng 9.192.631.770 chu kỳ bức xạ, tương ứng với sự chuyển trạng thái của hai mức năng lượng spin điện tử trong trạng thái tĩnh của nguyên tử Cs133. Đồng hồ caesi chính xác đầu tiên được Louis Essen tạo ra năm 1955 ở National Physical Laboratory ở Anh.[76] Các đồng hồ này được cải tiến theo định kỳ cứ mỗi nửa thế kỷ, và hình thành các tiêu chuẩn tuân thủ thời gian và đo đạc tần số, và được xem là "đơn vị chính xác nhất mà còn người từng đạt được."[71] Các đồng hồ này đo đạc tần số với sai số 2 đến 3 phần 1014, tương ứng với độ chính xác thời gian là 2 nano giây mỗi ngày, hoặc 1 giây trong 1,4 triệu năm. Phiên bản mới nhất có độ chính xác hơn 1/1015, tức là chúng lệch 1 giây trong 20 triệu năm.[10] Các đồng hồ caesi cũng được dùng trong các mạng lưới quan sát thời gian trong truyền tín hiện điện thoại di động và truyền thông tin trên Internet.[77]
Năng lượng điện và điện tử
[sửa | sửa mã nguồn]Các máy phát điện ion nhiệt bằng hơi caesi là các thiết bị năng lượng thấp chuyển năng lượng nhiệt thành năng lượng điện. Trong bộ chuyển ống chân không hai điện cực, nó trung hòa điện tích trong khoảng không hình thành ở gần ca-tốt, và do vậy nó tăng cường dòng điện.[78]
Caesi cũng có những đặc điểm quan trọng do tính quang điện của nó, theo đó năng lượng ánh sáng được chuyển thành dòng điện. Nó được dùng trong các tế bào quang điện do các ca-tốt gốc caesi như hợp chất kim loại K
2CsSb, có người điện thế thấp để phát ra electron.[79] Các thiết bị quang điện sử dụng caesi như các thiết bị nhận dạng ký tự quang học, các đèn nhân quang điện, và các ống video camera.[80][81] Tuy nhiên, germani, rubidi, seleni, silic, teluri, và nhiều nguyên tố khác có thể thay thế caesi trong các loại vật liệu cảm quang.[10]
Các tinh thể caesi iodide (CsI), caesi bromide (CsBr) và caesi fluoride (CsF) được ứng dụng làm scintillator trong máy điềm scintillation trong nhiều nghiên cứu khoáng sản và vật lý hạt, vì chúng rất thích hợp để nhận dạng các tia phóng xạ gamma và tia X. Caesi với vai trò là một nguyên tố nặng cung cấp năng lượng dừng tốt, có khả năng nhận dạng tốt hơn. Các hợp chất của caesi cũng cung cấp chất phản ứng nhanh (CsF) và ít hút ẩm (CsI).
Hơi caesi được dùng phổ biến trong từ kế.[82] Nguyên tố cũng được dùng làm chuẩn nội trong quang phổ học.[83] Giống các kim loại kiềm khác, caesi có ái lực mạnh với oxy và được sử dụng làm "thắng" (phanh) trong ống chân không.[84] Các ứng dụng khác ở dạng kim loại như laser năng lượng cao, đèn huỳnh quang, và chỉnh lưu.[10]
Dung dịch ly tâm
[sửa | sửa mã nguồn]Do có tỉ trọng lớn, các dung dịch caesi chloride, caesi sulfat, và caesi trifluoroacetat (Cs(O
2CCF
3)) được sử dụng phổ biến trong sinh học phân tử để tách lọc ly tâm.[85] Công nghệ này được ứng dụng chủ yếu trong tách các virus, bào quan và các phần phân đoạn của tế bào, và các acid nucleic từ các mẫu sinh học.[86]
Hóa học và y học
[sửa | sửa mã nguồn]
Các ứng dụng về hóa của caesi tương đối ít.[87] Doping với các hợp chất Caesi được dùng để nâng cao hiệu quả một số chất xúc tác trong sản xuất chất hóa học như các monome acid acrylic, anthraquinone, ethylen oxide, methanol, anhydride phthalic, styren, methyl methacrylat, và nhiều olefin khác nhau. Nó cũng được sử dụng trong chuyển đổi xúc tác sulfur dioxide thành sulfur trioxide trong sản xuất acid sulfuric.[10]
Caesi fluoride sử dụng thích hợp trong hóa vô cơ làm chất base,[21] hoặc nguồn anhydrous tạo ra ion fluoride.[88] Các muối Caesi đôi khi thay các muối natri và kali trong tổng hợp hữu cơ như chất vòng hóa, ester hóa, và polymer hóa. Nó cũng được dùng trong dosimetry bức xạ thermoluminescent (TLD): Khi tiếp xúc với bức xạ, nó thu được những khuyết tật tinh thể do đó khi được nung nóng, chuyển thành phát ra ánh sáng thích hợp với liều nhậu được. Do vậy, việc đo đạc xung ánh sáng bằng đèn nhân quang điện có thể cho phép liều bức xạ tích tụ để có thể lượng hóa được.
Hạt nhân và đồng vị của nó
[sửa | sửa mã nguồn]Caesi-137 là một đồng vị phóng xạ rất phổ biến được sử dụng như nguồn phát tia gamma trong các ứng dụng công nghiệp. Ưu điểm của nó là có chu kỳ bán rã gần 30 năm, nó có trong chu trình nhiên liệu hạt nhân, và có 137Ba đồng vị bền cuối. Khả năng hòa tan lớn trong nước là một bất lợi làm cho nó không thích hợp với large pool irradiators trong việc cung ứng cho thực phẩm và dược phẩm.[89] Nó được dùng trong nông nghiệp, điều trị ung thư, và khử trùng vi sinh trong thực phẩm, bùn cống, và thiết bị phẫu thuật.[10][90] Các đồng vị phóng xạ của caesi trong các thiết bị xạ trị được dùng trong lĩnh vực y học để trị các loại ung thư nhất định,[91] nhưng những thay thế tốt hơn trong trường hợp khẩn cấp và sử dụng caesi chloride tan trong nước trong các nguồn có thể tạo ra sự ô nhiễm trên diện rộng, từ từ làm cho các caesi này không thể sử dụng được nữa.[92][93] Caesi-137 đã được sử dụng trong nhiều thiết bị đo đạc công nghiệp, như đo độ ẩm, tỉ trọng, thủy chuẩn, và đo bề dày.[94] Nó cũng được sử dụng trong các thiết bị đo địa vật lý giếng khoan để đo mật độ electron của các thành hệ đá, giá trị này tương tự như mật độ khối của thành hệ.[95]
Đồng vị 137 cũng được sử dụng trong các nghiên cứu thủy văn học tương tự như sử dụng triti. Caesi-137 là đồng vị con trong phản ứng phân hạch hạt nhân. Với việc bắt đầu thử nghiệm hạt nhân khoảng năm 1945, và tiếp tục những vụ thử sau đó trong suốt giữa thập niên 1980, caesi-137 đã được giải phóng vào không khí và nó dễ dàng được hấp thụ trong các dung dịch. Việc biết sự thay đổi theo năm trong khoảng thời gian đó cho phép thiết lập mối quan hệ giữa đất và các lớp trầm tích. Caesi-134, và các đồng vị ít phổ biến hơn là caesi-135, cũng được sử dụng trong thủy văn bằng cách đo lượng caesi đầu ra của công nghiệp hạt nhân. Trong khi chúng ít phổ biến hơn cả caesi-133 hay caesi-137, các đồng vị này có ưu điểm là được tạo ra độc lập từ các nguồn nhân tạo.[96]
Ứng dụng khác
[sửa | sửa mã nguồn]
Caesi và thủy ngân từng được dùng làm nhiên liệu trong động cơ đẩy của các động cơ ion thời kỳ đầu trên tàu không gian với các chuyến hành trình rất dài. Phương pháp ion hóa là việc tách các electron lớp ngoài cùng từ nhiên liệu khi tiếp xúc với điện cực wolfram có điện thế. Các vấn đề quan tâm như hoạt động ăn mòn của caesi đối với các bộ phận trên tàu không gian đã chuyển hướng phát triển sang ứng dụng nhiên liệu khí trơ, như xenon; loại này dễ xử lý trong các thí nghiệm ở mặt đất và ít có tiềm năng can thiệp trên phi thuyến không gian.[10] Cuối cùng, xenon đã được sử dụng trên phi thuyền thí nghiệm Deep Space 1 được phóng năm 1998.[97][98] Tuy nhiên, động cơ đẩy Field Emission Electric Propulsion sử dụng một hệ thống sơn giản các ion kim loại lỏng được tăng tốc như trường hợp của caesi để tạo ra lực đẩy đã được chế tạo.[99]
Caesi nitrat được sử dụng làm chất oxy hóa và chất tạo màu để đốt silic trong pháo sáng hồng ngoại,[100] như pháo sáng LUU-19,[101] do nó phát ra nhiều ánh sáng trong quang phổ cận hồng ngoại.[102] Caesi đã từng được sử dụng để giảm dấu vết khí thải động cơ trên màn hình radar của máy bay quân sự SR-71 Blackbird.[103] Caesi cùng với rubidi đã được thêm vào dạng carbonat trong thủy tinh do nó giảm độ dẫn điện và tăng độ ổn định và độ bền của sợi quang học và các thiết bị quan sát ban đêm. Caesi fluoride hoặc nhôm fluoride được sử dụng trong chất hỗ trợ cấu trúc hàn hợp kim nhôm có chứa magnesi.[10]
Máy phát điện MHD - hệ thống phát điện đã được nghiên cứu nhưng không được chấp nhận rộng rãi.[104] Kim loại caesi cũng được xem là chất lỏng làm việc trong các chu trình Rankine nhiệt độ cao của các máy phát điện turboelectric.[105] Các muối caesi được đánh giá là chất chống sốc đã được sử dụng sau khi tiêm do nhiễm độc asen. Do ảnh hưởng của nó lên nhịp tim, tuy nhiên, chúng có vẻ ít được dùng hơn so với các muối kali hay rubidi. Chúng cũng được dùng để trị động kinh.[10]
Cảnh báo
[sửa | sửa mã nguồn]
Các hợp chất caesi không phóng xạ có độ độc trung bình. Tiếp xúc một lượng lớn có thể gây khó chịu và co thắt, do tính chất tương tự của caesi so với kali, nhưng những lượng lớn như vậy không thể có được một cách thông thường trong các nguồn tự nhiên, vì thế caesi không bị coi là chất hóa học chính gây ô nhiễm môi trường.[107] Liều gây chết trung bình (LD50) của caesi chloride đối với chuột là 2,3 g/kg, so với LD50 của kali chloride và natri chloride.[108] Ứng dụng chính của caesi không phóng xạ, là caesi format trong dung dịch khoan dầu khí, lợi dụng độc tính thấp của nó để giảm chi phí thay thế.[72]
Tất cả các kim loại kiềm đều có độ hoạt động hóa học cao. Caesi, một trong các kim loại kiềm nặng nhất, là một trong số các kim loại hoạt động hóa học mạnh nhất và gây nổ mạnh khi tiếp xúc với nước, do khí hydro được giải phóng ra từ phản ứng bị nung nóng bởi nhiệt giải phóng ra từ chính phản ứng này, gây ra đánh lửa và gây nổ mạnh (như các kim loại kiềm khác) – nhưng do caesi là quá hoạt hóa nên phản ứng nổ này diễn ra ngay cả với nước lạnh hay nước đá.[10] Nhiệt độ bắt lửa của caesi là −116 °C, do đó nó có tính tự cháy cao, và bùng nổ trong không khí tạo thành caesi hydroxide và nhiều oxide khác. Caesi hydroxide là một base cực mạnh, có khả năng ăn mòn thủy tinh.[15]
Các đồng vị Cs134 và Cs137 (có trong sinh quyển ở mức một lượng rất nhỏ do rò rỉ phóng xạ) là gánh nặng phóng xạ, phụ thuộc vào vị trí của từng khu vực. Caesi phóng xạ không tích lũy trong cơ thể như nhiều sản phẩm từ phân rã hạt nhân khác (chẳng hạn như iod phóng xạ hay stronti phóng xạ). Khoảng 10% caesi phóng xạ hấp thụ được thải ra khỏi cơ thể tương đối nhanh trong mồ hôi và trong nước tiểu. 90% còn lại có chu kỳ bán rã sinh học khoảng 50 đến 150 ngày.[109] Caesi phóng xạ sau kali và có khuynh hướng tích lũy trong tế bào thực vật, như trong trái cây và rau.[110][111][112] Thực vật hấp thụ caesi ở các mức khác nhau, một số không hấp thụ nhiều, và một số hấp thụ lượng lớn. đôi khi thể hiện khả năng kháng hấp thụ nó. Nó được ghi nhận rằng nấm trong các khu rừng bị ô nhiễm tích tụ caesi phóng xạ (caesi-137) trong túi sinh bào tử.[113] Tích tụ caesi-137 trong các hồ được quan tâm nhiều sau thảm họa Chernobyl.[114][115] Các thí nghiệm trên chó cho thấy một liều đơn 3,8 millicuries (140 MBq, 4,1 μg caesi-137) trên mỗi kilogram gây tử vong trong 3 tuần;[116] một lượng nhỏ hơn có thể gây vô sinh và ung thư.[117] Cơ quan Năng lượng Nguyên tử Quốc tế và các nguồn khác cảnh báo rằng các vật liệu phóng xạ như caesi-137 có thể được dùng trong các thiết bị phân tán phóng xạ hoặc "bom bẩn".[118]
Xem thêm
[sửa | sửa mã nguồn]Ghi chú
[sửa | sửa mã nguồn]- ^ Hội hóa học Hoa Kỳ (ACS) sử dụng cesium từ năm 1921,[6][7] theo Webster's New International Dictionary. Nguyên tố được đặt theo từ Latinh caesius, nghĩa là "xám xanh".[8] Trong các văn bản thời kỳ Trung cổ và đầu hiện đại caesius được gọi æ là cæsius; do đó hệ thống chữ viết được thay thế loại lỗi thời là cæsium. Giải thích cách phát âm ae/oe với e.
- ^ Cùng với rubidi (39 °C), franci (27 °C), thủy ngân (-39 °C) và gali (30 °C); brom cũng có dạng lỏng ở nhiệt độ phòng (nóng chảy ở −7.2 °C, 19 °F), nhưng nó là halogen, không phải kim loại.
- ^ Nguyên tố franci có tính phóng xạ có thể có điểm nóng chảy thấp hơn, nhưng do tính phóng xạ của nó ngăn cản việc cô lập đủ số lượng nguyên tử trong các thí nghiệm trực tiếp.[13]
- ^ Có sự khác biệt về giá trị này trong các xêsua chứa anion Cs− và do đó caesi có trạng thái oxy hóa −1.[3] Thêm vào đó, các tính toán của Mao-sheng Miao năm 2013 chỉ ra rằng trong các điềm kiện áp suất cực lớn (hơn 30 GPa), các electron phân lớp 5p có thể tạo các liên kết hóa học, caesi có thể ứng sử như nguyên tố 5p nhóm 7. Phát hiện này chỉ ra rằng các caesi fluoride với caesi có trạng thái oxy hóa cao hơn +2 đến +6 có thể tồn tại trong các điều kiện như trên.[22]
- ^ Độ dương điện của franci không được đo đạc bằng thí nghiệp do tính phóng xạ cao của nó. Các đo đạc năng lượng ion hóa đầu tiên của fanxi cho thấy rằng hiệu ứng tương đối có thể giám khả năng phản ứng của nó và tăng độ dương diện hơn như được dự đoán trong bảng tuần hoàn.[24]
- ^ Bunsen quotes Aulus Gellius Noctes Atticae II, 26 by Nigidius Figulus: Nostris autem veteribus caesia dicts est quae Graecis, ut Nigidus ait, de colore coeli quasi coelia.
Tham khảo
[sửa | sửa mã nguồn]- ^ Standard Atomic Weights 2013. Commission on Isotopic Abundances and Atomic Weights
- ^ Haynes, William M. biên tập (2011). CRC Handbook of Chemistry and Physics (ấn bản thứ 92). Boca Raton, FL: CRC Press. tr. 4.121. ISBN 1439855110.
- ^ a b c Dye, J. L. (1979). “Compounds of Alkali Metal Anions”. Angewandte Chemie International Edition. 18 (8): 587–598. doi:10.1002/anie.197905871.
- ^ “Magnetic susceptibility of the elements and inorganic compounds”. Handbook of Chemistry and Physics (PDF) (ấn bản thứ 81). CRC press. Truy cập ngày 26 tháng 9 năm 2010.
- ^ “"NIST Radionuclide Half-Life Measurements"”. Truy cập ngày 13 tháng 3 năm 2011.
- ^ Coghill, Anne M.; Garson, Lorrin R. biên tập (2006). The ACS Style Guide: Effective Communication of Scientific Information (ấn bản thứ 3). Washington, D.C.: American Chemical Society. tr. 127. ISBN 0-8412-3999-1.
- ^ Coplen, T. B.; Peiser, H. S. (1998). “History of the recommended atomic-weight values from 1882 to 1997: a comparison of differences from current values to the estimated uncertainties of earlier values” (PDF). Pure Appl. Chem. 70 (1): 237–257. doi:10.1351/pac199870010237.
- ^ cesium - definition of cesium in English | Oxford Dictionaries Lưu trữ 2020-08-04 tại Wayback Machine. Tái bản lần thứ hai, 1989; phiên bản trực tuyến tháng 6 năm 2012. Truy cập ngày 27 tháng 10 năm 2016. Phiên bản cũ hơn xuất bản lần đầu trong New English Dictionary, 1888.
- ^ FQA. “Tính chất, điều chế và ứng dụng của Xesi (Cs) | Fqa.vn”.
Có nhiều nghiên cứu hơn về nguyên tố Xesi và những ứng dụng được phát triển gồm: Cesium-137 là một đồng vị phóng xạ, nó được sử dụng trong y học, thiết bị đo công nghiệp và thủy văn.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa Butterman, William C.; Brooks, William E.; Reese, Jr., Robert G. (2004). “Mineral Commodity Profile: Cesium” (PDF). United States Geological Survey. Lưu trữ bản gốc ngày 7 tháng 2 năm 2007. Truy cập ngày 27 tháng 12 năm 2009.Quản lý CS1: bot: trạng thái URL ban đầu không rõ (liên kết)
- ^ Heiserman, David L. (1992). Exploring Chemical Elements and their Compounds. McGraw-Hill. tr. 201–203. ISBN 0-8306-3015-5.
- ^ Addison, C. C. (1984). The Chemistry of the Liquid Alkali Metals. Wiley. ISBN 0-471-90508-9. Truy cập ngày 28 tháng 9 năm 2012.
- ^ “Francium”. Periodic.lanl.gov. Truy cập ngày 23 tháng 2 năm 2010.
- ^ a b c d e Kaner, Richard (2003). “C&EN: It's Elemental: The Periodic Table – Cesium”. American Chemical Society. Truy cập ngày 25 tháng 2 năm 2010.
- ^ a b “Chemical Data – Cesium – Cs”. Royal Society of Chemistry. Truy cập ngày 27 tháng 9 năm 2010.
- ^ a b Lynch, Charles T. (1974). CRC Handbook of Materials Science. CRC Press. tr. 13. ISBN 978-0-8493-2321-8.
- ^ a b Clark, Jim (2005). “Flame Tests”. chemguide. Truy cập ngày 29 tháng 1 năm 2012.
- ^ Taova, T. M.; và đồng nghiệp (ngày 22 tháng 6 năm 2003). “Density of melts of alkali metals and their Na-K-Cs and Na-K-Rb ternary systems” (PDF). Fifteenth symposium on thermophysical properties, Boulder, Colorado, USA. Bản gốc (PDF) lưu trữ ngày 9 tháng 10 năm 2006. Truy cập ngày 26 tháng 9 năm 2010.
- ^ Deiseroth, H. J. (1997). “Alkali metal amalgams, a group of unusual alloys”. Progress in Solid State Chemistry. 25 (1–2): 73–123. doi:10.1016/S0079-6786(97)81004-7.
- ^ Gray, Theodore (2012) The Elements, Black Dog & Leventhal Publishers, p. 131, ISBN 1-57912-895-5.
- ^ a b c d e Greenwood, N.N.; Earnshaw, A. (1984). Chemistry of the Elements. Oxford, UK: Pergamon Press. ISBN 0-08-022057-6.
- ^ Moskowitz, Clara. “A Basic Rule of Chemistry Can Be Broken, Calculations Show”. Scientific American. Truy cập ngày 22 tháng 11 năm 2013.
- ^ a b c Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). “Vergleichende Übersicht über die Gruppe der Alkalimetalle”. Lehrbuch der Anorganischen Chemie (bằng tiếng Đức) . Walter de Gruyter. tr. 953–955. ISBN 3-11-007511-3.
- ^ Andreev, S. V.; Letokhov, V. S.; Mishin, V. I. (1987). “Laser resonance photoionization spectroscopy of Rydberg levels in Fr”. Physical Review Letters. 59 (12): 1274–76. Bibcode:1987PhRvL..59.1274A. doi:10.1103/PhysRevLett.59.1274. PMID 10035190.
- ^ “Phosphate”. Encyclopedia of Earth. 12 tháng 3 năm 2012. Lưu trữ bản gốc ngày 14 tháng 8 năm 2013. Truy cập ngày 19 tháng 8 năm 2016.Quản lý CS1: bot: trạng thái URL ban đầu không rõ (liên kết)
- ^ Köhler, Michael J. (1999). Etching in microsystem technology. Wiley-VCH. tr. 90. ISBN 3-527-29561-5.[liên kết hỏng]
- ^ Jansen, Martin (ngày 30 tháng 11 năm 2005). “Effects of relativistic motion of electrons on the chemistry of gold and platinum”. Solid State Sciences. 7 (12): 1464–1474. Bibcode:2005SSSci...7.1464J. doi:10.1016/j.solidstatesciences.2005.06.015.
- ^ Moyer, Bruce A.; Birdwell, Joseph F.; Bonnesen, Peter V.; Delmau, Laetitia H. (2005). “Use of Macrocycles in Nuclear-Waste Cleanup: A Realworld Application of a Calixcrown in Cesium Separation Technology”. Macrocyclic Chemistry: 383–405. doi:10.1007/1-4020-3687-6_24. ISBN 1-4020-3364-8.
- ^ Senga, Ryosuke; Suenaga, Kazu (2015). “Single-atom electron energy loss spectroscopy of light elements”. Nature Communications. 6: 7943. doi:10.1038/ncomms8943. PMC 4532884. PMID 26228378.
- ^ F. W. Evans; M. H. Litt; A. M. Weidler-Kubanek; F. P. Avonda (1968). “Reactions Catalyzed by Potassium Fluoride. 111. The Knoevenagel Reaction”. Journal of Organic Chemistry. 33 (5): 1837–1839. doi:10.1021/jo01269a028.
- ^ Wells, A.F. (1984). Structural Inorganic Chemistry (ấn bản thứ 5). Oxford Science Publications. ISBN 0-19-855370-6.
- ^ Cotton, F. Albert; Wilkinson, G. (1962). Advanced Inorganic Chemistry. John Wiley & Sons, Inc. tr. 318. ISBN 0-471-84997-9.
- ^ Lide, David R. biên tập (2006). CRC Handbook of Chemistry and Physics (ấn bản thứ 87). Boca Raton, FL: CRC Press. tr. 451, 514. ISBN 0-8493-0487-3.
- ^ a b Tsai, Khi-Ruey; Harris, P. M.; Lassettre, E. N. (1956). “The Crystal Structure of Cesium Monoxide”. Journal of Physical Chemistry. 60 (3): 338–344. doi:10.1021/j150537a022.
- ^ “New silicotitanate molecular sieve and condensed phases (Patent Application)” (PDF). Office of Scientific and Technical Information — U.S. Department of Energy. ngày 23 tháng 11 năm 2009. Truy cập ngày 15 tháng 2 năm 2010.
- ^ Vol'nov, I. I.; Matveev, V. V. (1963). “Synthesis of cesium ozonide through cesium superoxide”. Bulletin of the Academy of Sciences, USSR Division of Chemical Science. 12 (6): 1040–1043. doi:10.1007/BF00845494.
- ^ Tokareva, S. A. (1971). “Alkali and Alkaline Earth Metal Ozonides”. Russian Chemical Reviews. 40 (2): 165–174. Bibcode:1971RuCRv..40..165T. doi:10.1070/RC1971v040n02ABEH001903.
- ^ Simon, A. (1997). “Group 1 and 2 Suboxides and Subnitrides — Metals with Atomic Size Holes and Tunnels”. Coordination Chemistry Reviews. 163: 253–270. doi:10.1016/S0010-8545(97)00013-1.
- ^ Tsai, Khi-Ruey; Harris, P. M.; Lassettre, E. N. (1956). “The Crystal Structure of Tricesium Monoxide”. Journal of Physical Chemistry. 60 (3): 345–347. doi:10.1021/j150537a023.
- ^ Okamoto, H. (2009). “Cs-O (Cesium-Oxygen)”. Journal of Phase Equilibria and Diffusion. 31: 86. doi:10.1007/s11669-009-9636-5.
- ^ Band, A.; Albu-Yaron, A.; Livneh, T.; Cohen, H.; Feldman, Y.; Shimon, L.; Popovitz-Biro, R.; Lyahovitskaya, V.; Tenne, R. (2004). “Characterization of Oxides of Cesium”. The Journal of Physical Chemistry B. 108 (33): 12360–12367. doi:10.1021/jp036432o.
- ^ Brauer, G. (1947). “Untersuchungen ber das System Csium-Sauerstoff”. Zeitschrift fr anorganische Chemie. 255: 101. doi:10.1002/zaac.19472550110.
- ^ Turekian, K.K.; Wedepohl, K. H. (1961). “Distribution of the elements in some major units of the Earth's crust”. Geological Society of America Bulletin. 72 (2): 175–192. Bibcode:1961GSAB...72..175T. doi:10.1130/0016-7606(1961)72[175:DOTEIS]2.0.CO;2. ISSN 0016-7606.
- ^ Rowland, Simon (ngày 4 tháng 7 năm 1998). “Cesium as a Raw Material: Occurrence and Uses”. Artemis Society International. Bản gốc lưu trữ ngày 8 tháng 7 năm 2021. Truy cập ngày 15 tháng 2 năm 2010.
- ^ a b Černý, Petr; Simpson, F. M. (1978). “The Tanco Pegmatite at Bernic Lake, Manitoba: X. Pollucite” (PDF). Canadian Mineralogist. 16: 325–333. Truy cập ngày 26 tháng 9 năm 2010.
- ^ a b c d Polyak, Désirée E. “Cesium” (PDF). U.S. Geological Survey. Truy cập ngày 17 tháng 10 năm 2009.
- ^ Norton, J. J. (1973). “Lithium, cesium, and rubidium—The rare alkali metals”. Trong Brobst, D. A.; Pratt, W. P. (biên tập). United States mineral resources. Paper 820. U.S. Geological Survey Professional. tr. 365–378. Truy cập ngày 26 tháng 9 năm 2010.
- ^ Busso, M.; Gallino, R.; Wasserburg, G. J. (1999). “Nucleosynthesis in Asymptotic Giant Branch Stars: Relevance for Galactic Enrichment and Solar System Formation” (PDF). Annula Review of Astronomy and Astrophysics. 37: 239–309. Bibcode:1999ARA&A..37..239B. doi:10.1146/annurev.astro.37.1.239. Truy cập ngày 20 tháng 2 năm 2010.
- ^ Arnett, David (1996). Supernovae and Nucleosynthesis: An Investigation of the History of Matter, from the Big Bang to the Present. Princeton University Press. tr. 527. ISBN 0-691-01147-8.
- ^ Goff, C; Matchette, Michael A.; Shabestary, Nahid; Khazaeli, Sadegh (1996). “Complexation of cesium and rubidium cations with crown ethers in N,N-dimethylformamide”. Polyhedron. 15 (21): 3897. doi:10.1016/0277-5387(96)00018-6.
- ^ Brown, F.; Hall, G.R.; Walter, A.J. (1955). “The half-life of Cs137”. Journal of Inorganic and Nuclear Chemistry. 1 (4–5): 241–247. doi:10.1016/0022-1902(55)80027-9.
- ^ Sonzogni, Alejandro. “Interactive Chart of Nuclides”. National Nuclear Data Center: Brookhaven National Laboratory. Bản gốc lưu trữ ngày 10 tháng 10 năm 2018. Truy cập ngày 6 tháng 6 năm 2008.
- ^ Ohki, Shigeo; Takaki, Naoyuki (2002). Transmutation of Cesium-135 with Fast Reactors (PDF). Seventh Information Exchange Meeting on Actinide and Fission Product Partitioning and Transmutation. Jeju, Korea. Bản gốc (PDF) lưu trữ ngày 3 tháng 3 năm 2016. Truy cập ngày 26 tháng 9 năm 2010.
- ^ “20 Xenon: A Fission Product Poison”. CANDU Fundamentals (PDF) (Bản báo cáo). CANDU Owners Group Inc. Lưu trữ bản gốc ngày 23 tháng 7 năm 2011. Truy cập ngày 15 tháng 9 năm 2010.Quản lý CS1: bot: trạng thái URL ban đầu không rõ (liên kết)
- ^ Taylor, V. F.; Evans, R. D.; Cornett, R. J. (2008). “Preliminary evaluation of 135Cs/137Cs as a forensic tool for identifying source of radioactive contamination”. Journal of Environmental Radioactivity. 99 (1): 109–118. doi:10.1016/j.jenvrad.2007.07.006. PMID 17869392.
- ^ “Cesium | Radiation Protection”. U.S. Environmental Protection Agency. ngày 28 tháng 6 năm 2006. Lưu trữ bản gốc ngày 15 tháng 3 năm 2011. Truy cập ngày 15 tháng 2 năm 2010.Quản lý CS1: bot: trạng thái URL ban đầu không rõ (liên kết)
- ^ Zerriffi, Hisham (ngày 24 tháng 5 năm 2000). IEER Report: Transmutation – Nuclear Alchemy Gamble (Bản báo cáo). Institute for Energy and Environmental Research. Truy cập ngày 15 tháng 2 năm 2010.
- ^ Chernobyl's Legacy: Health, Environmental and Socia-Economic Impacts and Recommendations to the Governments of Belarus, Russian Federation and Ukraine (PDF) (Bản báo cáo). International Atomic Energy Agency. Truy cập ngày 18 tháng 2 năm 2010.
- ^ Kase, Takeshi; Konashi, Kenji; Takahashi, Hiroshi; Hirao, Yasuo (1993). “Transmutation of Cesium-137 Using Proton Accelerator”. Journal of Nuclear Science and Technology. 30 (9): 911–918. doi:10.3327/jnst.30.911.
- ^ Knief, Ronald Allen (1992). “Fission Fragments”. Nuclear engineering: theory and technology of commercial nuclear power. Taylor & Francis. tr. 42. ISBN 978-1-56032-088-3.
- ^ Ishiwatari, N.; Nagai, H. “Release of xenon-137 and iodine-137 from UO2 pellet by pulse neutron irradiation at NSRR”. Nippon Genshiryoku Gakkaishi. 23 (11): 843–850. OSTI 5714707.
- ^ a b Burt, R. O. (1993). “Cesium and cesium compounds”. Kirk-Othmer encyclopedia of chemical technology. 5 (ấn bản thứ 4). New York: John Wiley & Sons, Inc. tr. 749–764. ISBN 978-0-471-48494-3.
- ^ Benton, William; Turner, Jim (2000). “Cesium formate fluid succeeds in North Sea HPHT field trials” (PDF). Drilling Contractor (May/June): 38–41. Truy cập ngày 26 tháng 9 năm 2010.
- ^ a b Eagleson, Mary biên tập (1994). Concise encyclopedia chemistry. Eagleson, Mary. Berlin: de Gruyter. tr. 198. ISBN 978-3-11-011451-5.
- ^ Oxford English Dictionary, 2nd Edition
- ^ a b c d Kirchhoff, G.; Bunsen, R. (1861). “Chemische Analyse durch Spectralbeobachtungen”. Annalen der Physik und Chemie. 189 (7): 337–381. Bibcode:1861AnP...189..337K. doi:10.1002/andp.18611890702.
- ^ a b Weeks, Mary Elvira (1932). “The discovery of the elements. XIII. Some spectroscopic discoveries”. Journal of Chemical Education. 9 (8): 1413–1434. Bibcode:1932JChEd...9.1413W. doi:10.1021/ed009p1413.
- ^ Zsigmondy, Richard (2007). Colloids and the Ultra Microscope. Read books. tr. 69. ISBN 978-1-4067-5938-9.
- ^ Setterberg, Carl (1882). “Ueber die Darstellung von Rubidium- und Cäsiumverbindungen und über die Gewinnung der Metalle selbst”. Justus Liebig's Annalen der Chemie. 211: 100–116. doi:10.1002/jlac.18822110105.
- ^ Strod, A.J. (1957). “Cesium—A new industrial metal”. American Ceramic Bulletin. 36 (6): 212–213.
- ^ a b The 13th General Conference on Weights and Measures of 1967 defined a second as: "the duration of 9,192,631,770 cycles of microwave light absorbed or emitted by the hyperfine transition of cesium-133 atoms in their ground state undisturbed by external fields" “Cesium Atoms at Work”. Time Service Department—U.S. Naval Observatory—Department of the Navy. Bản gốc lưu trữ ngày 23 tháng 2 năm 2015. Truy cập ngày 27 tháng 10 năm 2016.
- ^ a b Downs, J. D.; Blaszczynski, M.; Turner, J.; Harris, M. (tháng 2 năm 2006). Drilling and Completing Difficult HP/HT Wells With the Aid of Cesium Formate Brines-A Performance Review. IADC/SPE Drilling Conference. Miami, Florida, USASociety of Petroleum Engineers. doi:10.2118/99068-MS. Lưu trữ bản gốc ngày 12 tháng 10 năm 2007. Truy cập ngày 3 tháng 3 năm 2016.
- ^ Drilling and Completing Difficult HP/HT Wells With the Aid of Cesium Formate Brines-A Performance Review
- ^ “Overview: Cesium Formate Fluids”. Lưu trữ bản gốc ngày 13 tháng 2 năm 2008. Truy cập ngày 13 tháng 2 năm 2008.
- ^ Flatern, Rick (2001). “Keeping cool in the HPHT environment”. Offshore Engineer (February): 33–37.
- ^ Essen, L.; Parry, J.V.L. (1955). “An Atomic Standard of Frequency and Time Interval: A Cesium Resonator”. Nature. 176 (4476): 280. Bibcode:1955Natur.176..280E. doi:10.1038/176280a0.
- ^ Reel, Monte (ngày 22 tháng 7 năm 2003). “Where timing truly is everything”. The Washington Post. tr. B1. Bản gốc lưu trữ ngày 5 tháng 5 năm 2016. Truy cập ngày 26 tháng 1 năm 2010.
- ^ Rasor, Ned S.; Warner, Charles (tháng 9 năm 1964). “Correlation of Emission Processes for Adsorbed Alkali Films on Metal Surfaces”. Journal of Applied Physics. 35 (9): 2589–2600. Bibcode:1964JAP....35.2589R. doi:10.1063/1.1713806.
- ^ “Cesium Supplier & Technical Information”. American Elements. Truy cập ngày 25 tháng 1 năm 2010.
- ^ Smedley, John; Rao, Triveni; Wang, Erdong (2009). “K 2CsSb Cathode Development”. American Institute of Physics Conference Proceedings. 1149: 1062–1066. doi:10.1063/1.3215593.
- ^ Görlich, P. (1936). “Über zusammengesetzte, durchsichtige Photokathoden”. Zeitschrift für Physik. 101 (5–6): 335–342. Bibcode:1936ZPhy..101..335G. doi:10.1007/BF01342330.
- ^ Groeger, S.; Pazgalev, A. S.; Weis, A. (2005). “Comparison of discharge lamp and laser pumped cesium magnetometers”. Applied Physics B. 80 (6): 645–654. arXiv:physics/0412011. Bibcode:2005ApPhB..80..645G. doi:10.1007/s00340-005-1773-x.
- ^ Haven, Mary C.; Tetrault, Gregory A.; Schenken, Jerald R. (1994). “Internal Standards”. Laboratory instrumentation. New York: John Wiley and Sons. tr. 108. ISBN 978-0-471-28572-4.
- ^ McGee, James D. (1969). Photo-electronic image devices: proceedings of the fourth symposium held at Imperial College, London, September 16–20, 1968. 1. Academic Press. tr. 391. ISBN 978-0-12-014528-7.
- ^ Manfred Bick, Horst Prinz, "Cesium and Cesium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a06 153.
- ^ Desai, Mohamed A. biên tập (2000). “Gradient Materials”. Downstream processing methods. Totowa, N.J.: Humana Press. tr. 61–62. ISBN 978-0-89603-564-5.
- ^ Burt, R. O. (1993). “Cesium and cesium compounds”. Kirk-Othmer encyclopedia of chemical technology. 5 (ấn bản thứ 4). New York: John Wiley & Sons. tr. 759. ISBN 978-0-471-15158-6.
- ^ Friestad, Gregory K.; Branchaud, Bruce P.; Navarrini, Walter and Sansotera, Maurizio (2007) "Cesium Fluoride" in Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons. doi:10.1002/047084289X.rc050.pub2
- ^ Okumura, Takeshi (ngày 21 tháng 10 năm 2003). “The material flow of radioactive cesium-137 in the U.S. 2000” (PDF). United States Environmental Protection Agency. Lưu trữ bản gốc ngày 20 tháng 7 năm 2011. Truy cập ngày 20 tháng 12 năm 2009.Quản lý CS1: bot: trạng thái URL ban đầu không rõ (liên kết)
- ^ Jensen, N. L. (1985). “Cesium”. Mineral facts and problems. Bulletin 675. U.S. Bureau of Mines. tr. 133–138.
- ^ “IsoRay's Cesium-131 Medical Isotope Used In Milestone Procedure Treating Eye Cancers At Tufts-New England Medical Center”. Medical News Today. ngày 17 tháng 12 năm 2007. Truy cập ngày 15 tháng 2 năm 2010.
- ^ Bentel, Gunilla Carleson (1996). “Cesium-137 Machines”. Radiation therapy planning. McGraw-Hill Professional. tr. 22–23. ISBN 978-0-07-005115-7. Truy cập ngày 26 tháng 9 năm 2010.
- ^ National Research Council (U.S.). Committee on Radiation Source Use and Replacement (2008). Radiation source use and replacement: abbreviated version. National Academies Press. ISBN 978-0-309-11014-3.
- ^ Loxton, R.; Pope, P. biên tập (1995). “Level and density measurement using non-contact nuclear gauges”. Instrumentation: A Reader. London: Chapman & Hall. tr. 82–85. ISBN 978-0-412-53400-3.
- ^ Timur, A.; Toksoz, M. N. (1985). “Downhole Geophysical Logging”. Annual Review of Earth and Planetary Sciences. 13: 315. Bibcode:1985AREPS..13..315T. doi:10.1146/annurev.ea.13.050185.001531.
- ^ Kendall, Carol. “Isotope Tracers Project – Resources on Isotopes – Periodic Table--Cesium”. National Research Program – U.S. Geological Survey. Truy cập ngày 25 tháng 1 năm 2010. Chú thích journal cần
|journal=(trợ giúp) - ^ Marcucci, M. G.; Polk, J. E. (2000). “NSTAR Xenon Ion Thruster on Deep Space 1: Ground and flight tests (invited)”. Review of Scientific Instruments. 71 (3): 1389–1400. Bibcode:2000RScI...71.1389M. doi:10.1063/1.1150468.
- ^ Sovey, James S.; Rawlin, Vincent K.; Patterson, Michael J. “A Synopsis of Ion Propulsion Development Projects in the United States: SERT I to Deep Space I” (PDF). NASA. Bản gốc (PDF) lưu trữ ngày 29 tháng 6 năm 2009. Truy cập ngày 12 tháng 12 năm 2009.
- ^ Marrese, C.; Polk, J.; Mueller, J.; Owens, A.; Tajmar, M.; Fink, R. & Spindt, C. (tháng 10 năm 2001). In-FEEP ion beam neutralization with thermionic and field emission cathodes. 27th International Electric Propulsion Conference. Pasadena, California. tr. 1–15. Bản gốc (PDF) lưu trữ ngày 1 tháng 12 năm 2016. Truy cập ngày 25 tháng 1 năm 2010.
- ^ “Infrared illumination compositions and articles containing the same”. United States Patent 6230628. Freepatentsonline.com. Truy cập ngày 25 tháng 1 năm 2010.
- ^ “LUU-19 Flare”. Federation of American Scientists. ngày 23 tháng 4 năm 2000. Bản gốc lưu trữ ngày 17 tháng 8 năm 2000. Truy cập ngày 12 tháng 12 năm 2009.
- ^ Charrier, E.; Charsley, E.L.; Laye, P.G.; Markham, H.M.; Berger, B.; Griffiths, T.T. (2006). “Determination of the temperature and enthalpy of the solid–solid phase transition of cesium nitrate by differential scanning calorimetry”. Thermochimica Acta. 445: 36–39. doi:10.1016/j.tca.2006.04.002.
- ^ Crickmore, Paul F. (2000). Lockheed SR-71: the secret missions exposed. Osprey. tr. 47. ISBN 978-1-84176-098-8.
- ^ National Research Council (U.S.) (2001). Energy research at DOE—Was it worth it?. National Academy Press. tr. 190–194. ISBN 978-0-309-07448-3. Truy cập ngày 26 tháng 9 năm 2010.
- ^ Roskill Information Services (1984). Economics of Cesium and Rubidium (Reports on Metals & Minerals). London, United Kingdom: Roskill Information Services. tr. 51. ISBN 978-0-86214-250-6.
- ^ Data from the Nuclear Data Center at KAERI and The radiochemical Manual (2nd ed.) B.J. Wilson (1966).
- ^ Pinsky, Carl; Bose, Ranjan; Taylor, J. R.; McKee, Jasper; Lapointe, Claude; Birchall, James (1981). “Cesium in mammals: Acute toxicity, organ changes and tissue accumulation”. Journal of Environmental Science and Health, Part A. 16 (5): 549–567. doi:10.1080/10934528109375003.
- ^ Johnson, Garland T.; Lewis, Trent R.; Wagner, D. Wagner (1975). “Acute toxicity of cesium and rubidium compounds”. Toxicology and Applied Pharmacology. 32 (2): 239–245. doi:10.1016/0041-008X(75)90216-1. PMID 1154391.
- ^ Rundo, J. (1964). “A Survey of the Metabolism of Cesium in Man”. British Journal of Radiology. 37 (37): 108–114. doi:10.1259/0007-1285-37-434-108.
- ^ Nishita, H.; Dixon, D.; Larson, K. H. (1962). “Accumulation of Cs and K and growth of bean plants in nutrient solution and soils”. Plant and Soil. 17 (2): 221–242. doi:10.1007/BF01376226.
- ^ Avery, S. (1996). “Fate of cesium in the environment: Distribution between the abiodic and biodic components of aquatic and terrestrial ecosystems”. Journal of Environmental Radioactivity. 30 (2): 139–171. doi:10.1016/0265-931X(96)89276-9.
- ^ Salbu, Brit; Østby, Georg; Garmo, Torstein H.; Hove, Knut (1992). “Availability of cesium isotopes in vegetation estimated from incubation and extraction experiments”. Analyst. 117 (3): 487–491. Bibcode:1992Ana...117..487S. doi:10.1039/AN9921700487. PMID 1580386.
- ^ M Vinichuk, A F S Taylor, K Rosén, K J Johanson. Accumulation of potassium, rubidium and cesium ((133)Cs and (137)Cs) in various fractions of soil and fungi in a Swedish forest. Science of the total envrironment 03: 2010 doi:10.1016/j.scitotenv.2010.02.024
- ^ Smith, Jim T.; Beresford, Nicholas A. (2005). Chernobyl: Catastrophe and Consequences. Berlin: Springer. ISBN 3-540-23866-2.
- ^ Eremeev, V. N.; Chudinovskikh, T. V.; Batrakov, G. F.; Ivanova, T. M. (1991). “Radioactive isotopes of cesium in the waters and near-water atmospheric layer of the Black Sea”. Physical Oceanography. 2 (1): 57–64. doi:10.1007/BF02197418.
- ^ Redman, H. C.; McClellan, R. O.; Jones, R. K.; Boecker, B. B.; Chiffelle, T. L.; Pickrell, J. A.; Rypka, E. W. (1972). “Toxicity of 137-CsCl in the Beagle. Early Biological Effects”. Radiation Research. 50 (3): 629–648. doi:10.2307/3573559. JSTOR 3573559. PMID 5030090.
- ^ “Chinese 'find' radioactive ball”. BBC News. ngày 27 tháng 3 năm 2009. Truy cập ngày 25 tháng 1 năm 2010.
- ^ Charbonneau, Louis (ngày 12 tháng 3 năm 2003). “IAEA director warns of 'dirty bomb' risk”. The Washington Post. Reuters. tr. A15. Bản gốc lưu trữ ngày 5 tháng 5 năm 2016. Truy cập ngày 28 tháng 4 năm 2010.
Liên kết ngoài
[sửa | sửa mã nguồn]- Caesi tại Từ điển bách khoa Việt Nam
- (Cs) (Chemical element) tại Encyclopædia Britannica (tiếng Anh)
- Cesium: the essentials WebElements
- Frequently Asked Questions about Cesium and alt.cesium Humor site dedicated to cesium
- Cesium Phòng thí nghiệm quốc gia Los Alamos (Hoa Kỳ)
- CESIUM | Cs - PubChem
- Periodic Table of Elements | Element Cesium - Cs EnvironmentalChemistry
- The Modern Alchemist: Reacting Fluorine with Cesium Lưu trữ 2017-11-04 tại Wayback Machine Ri Channel 2012
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |


